【高考真题】2022年北京市高考真题化学试题
试卷更新日期:2022-09-26 类型:高考真卷
一、第一部分 本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法错误的是( )A、醋酸钠是强电解质 B、醋酸钠晶体与冰都是离子晶体 C、常温下,醋酸钠溶液的 D、该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出2. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型:
 C、基态原子的价层电子的轨道表示式:
C、基态原子的价层电子的轨道表示式: D、的电子式:
D、的电子式: 3. (锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法错误的是( )A、位于元素周期表中第六周期、第ⅡA族 B、可用质谱法区分和 C、和含有的中子数分别为49和48 D、同一地域产出的同种土壤生物中值相同4. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊:
3. (锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法错误的是( )A、位于元素周期表中第六周期、第ⅡA族 B、可用质谱法区分和 C、和含有的中子数分别为49和48 D、同一地域产出的同种土壤生物中值相同4. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊: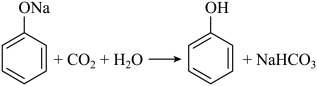 D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
5. 下列实验中,不能达到实验目的的是( )
D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
5. 下列实验中,不能达到实验目的的是( )由海水制取蒸馏水
萃取碘水中的碘
分离粗盐中的不溶物
由制取无水固体



A
B
C
D
A、A B、B C、C D、D6. 下列物质混合后,因发生氧化还原反应使溶液减小的是( )A、向溶液中加入少量溶液,生成白色沉淀 B、向和的悬浊液中通入空气,生成红褐色沉淀 C、向溶液中加入少量溶液,生成蓝绿色沉淀 D、向溶液中通入氯气,生成黄色沉淀7. 已知:。下列说法错误的是( ) A、分子的共价键是键,分子的共价键是键 B、燃烧生成的气体与空气中的水蒸气结合呈雾状 C、停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟 D、可通过原电池将与反应的化学能转化为电能8. 我国科学家提出的聚集诱导发光机制已成为研究热点之一、一种具有聚集诱导发光性能的物质,其分子结构如图所示。下列说法错误的是( )
A、分子的共价键是键,分子的共价键是键 B、燃烧生成的气体与空气中的水蒸气结合呈雾状 C、停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟 D、可通过原电池将与反应的化学能转化为电能8. 我国科学家提出的聚集诱导发光机制已成为研究热点之一、一种具有聚集诱导发光性能的物质,其分子结构如图所示。下列说法错误的是( )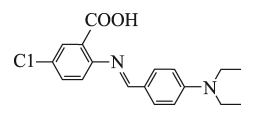 A、分子中N原子有、两种杂化方式 B、分子中含有手性碳原子 C、该物质既有酸性又有碱性 D、该物质可发生取代反应、加成反应9. 由键能数据大小,不能解释下列事实的是( )
A、分子中N原子有、两种杂化方式 B、分子中含有手性碳原子 C、该物质既有酸性又有碱性 D、该物质可发生取代反应、加成反应9. 由键能数据大小,不能解释下列事实的是( )化学键
键能/
411
318
799
358
452
346
222
A、稳定性: B、键长: C、熔点: D、硬度:金刚石>晶体硅10. 利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )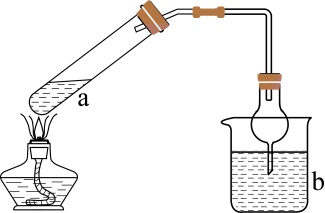
a中反应
b中检测试剂及现象
A
浓分解生成
淀粉溶液变蓝
B
与浓生成
品红溶液褪色
C
浓与溶液生成
酚酞溶液变红
D
与乙醇溶液生成丙烯
溴水褪色
A、A B、B C、C D、D11. 高分子Y是一种人工合成的多肽,其合成路线如下。
下列说法错误的是( )
A、F中含有2个酰胺基 B、高分子Y水解可得到E和G C、高分子X中存在氢键 D、高分子Y的合成过程中进行了官能团保护12. 某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。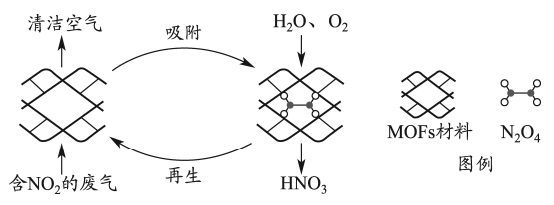
已知:
下列说法错误的是( )
A、温度升高时不利于吸附 B、多孔材料“固定” , 促进平衡正向移动 C、转化为的反应是 D、每获得时,转移电子的数目为13. 利用下图装置进行铁上电镀铜的实验探究。装置示意图
序号
电解质溶液
实验现象
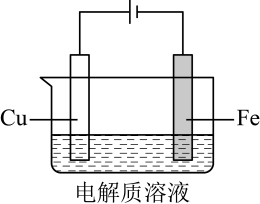
①
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
②
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
下列说法错误的是( )
A、①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触 B、①中检测到 , 推测可能发生反应: C、随阴极析出 , 推测②中溶液减少,平衡逆移 D、②中生成 , 使得比①中溶液的小,缓慢析出,镀层更致密14. 捕获和转化可减少排放并实现资源利用,原理如图1所示。反应①完成之后,以为载气,以恒定组成的混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 , 在催化剂上有积碳。
下列说法错误的是( )
A、反应①为;反应②为 B、 , 比多,且生成速率不变,可能有副反应 C、时刻,副反应生成的速率大于反应②生成速率 D、之后,生成的速率为0,是因为反应②不再发生二、第二部分 本部分共5题,共58份。
-
15. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
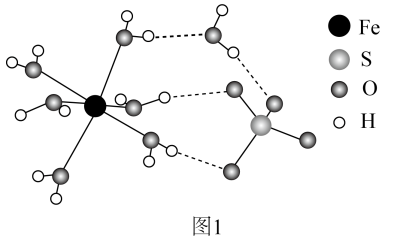
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。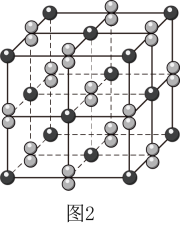
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
(3)、加热脱水后生成 , 再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点。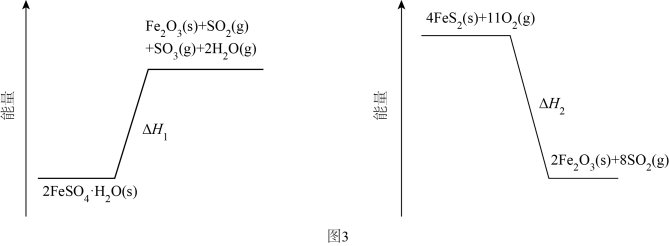 16. 煤中硫的存在形态分为有机硫和无机硫(、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
16. 煤中硫的存在形态分为有机硫和无机硫(、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。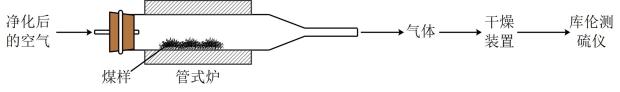
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含。
(1)、煤样需研磨成细小粉末,其目的是。(2)、高温下,煤中完全转化为 , 该反应的化学方程式为。(3)、通过干燥装置后,待测气体进入库仑测硫仪进行测定。已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。待测气体进入电解池后,溶解并将还原,测硫仪便立即自动进行电解到又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

①在电解池中发生反应的离子方程式为。
②测硫仪工作时电解池的阳极反应式为。
(4)、煤样为 , 电解消耗的电量为x库仑,煤样中硫的质量分数为。已知:电解中转移电子所消耗的电量为96500库仑。
(5)、条件控制和误差分析。①测定过程中,需控制电解质溶液 , 当时,非电解生成的使得测得的全硫含量偏小,生成的离子方程式为。
②测定过程中,管式炉内壁上有残留,测得全硫量结果为。(填“偏大”或“偏小”)
17. 碘番酸是一种口服造影剂,用于胆部X—射线检查。其合成路线如下: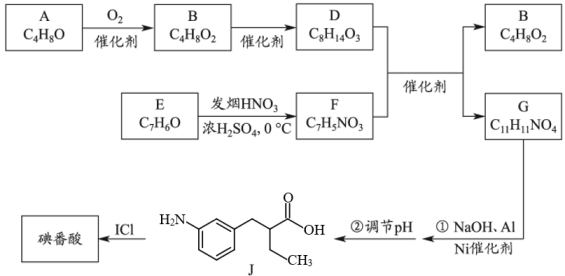
已知:R1COOH+R2COOH
 +H2O (1)、A可发生银镜反应,A分子含有的官能团是。(2)、B无支链,B的名称是。B的一种同分异构体,其核磁共振氢谱只有一组峰,结构简式是。(3)、E为芳香族化合物,E→F的化学方程式是。(4)、G中含有乙基,G的结构简式是。(5)、碘番酸分子中的碘位于苯环上不相邻的碳原子上。碘番酸的相对分子质量为571,J的相对分子质量为193,碘番酸的结构简式是。(6)、口服造影剂中碘番酸含量可用滴定分析法测定,步骤如下。
+H2O (1)、A可发生银镜反应,A分子含有的官能团是。(2)、B无支链,B的名称是。B的一种同分异构体,其核磁共振氢谱只有一组峰,结构简式是。(3)、E为芳香族化合物,E→F的化学方程式是。(4)、G中含有乙基,G的结构简式是。(5)、碘番酸分子中的碘位于苯环上不相邻的碳原子上。碘番酸的相对分子质量为571,J的相对分子质量为193,碘番酸的结构简式是。(6)、口服造影剂中碘番酸含量可用滴定分析法测定,步骤如下。步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I- , 冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数。
18. 白云石的主要化学成分为 , 还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。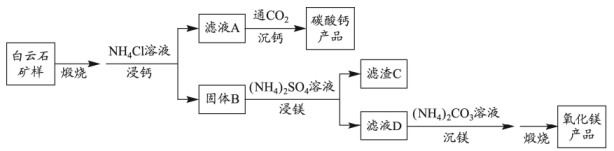
已知:
物质
(1)、白云石矿样煅烧完全分解的化学方程式为。(2)、用量对碳酸钙产品的影响如下表所示。氧化物()浸出率/%
产品中纯度/%
产品中Mg杂质含量/%
(以计)
计算值
实测值
2.1∶1
98.4
1.1
99.1
99.7
——
2.2∶1
98.8
1.5
98.7
99.5
0.06
2.4∶1
99.1
6.0
95.2
97.6
2.20
备注:ⅰ、浸出率=(浸出的质量/煅烧得到的质量)(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
(3)、“浸镁”过程中,取固体B与一定浓度的溶液混合,充分反应后的浸出率低于60%。加热蒸馏,的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是。(4)、滤渣C中含有的物质是。(5)、该流程中可循环利用的物质是。19. 某小组同学探究不同条件下氯气与二价锰化合物的反应。资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、B中试剂是。(2)、通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为。(3)、对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是。(4)、根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。