浙科版科学九年级上学期 第二单元 第五节物质的转化 同步练习(1)
试卷更新日期:2022-09-21 类型:同步测试
一、单选题
-
1. 能一次性鉴别NaCl、BaCl2、Na2CO3 , 三种无色溶液的试剂是( )A、稀硫酸 B、盐酸 C、石灰水 D、硝酸银溶液2. 取少量碳酸饮料“雪碧”滴入紫色石蕊试液,然后再加热,溶液颜色变化情况是( )A、先变红后变紫 B、先变蓝后变紫 C、先变无色后变红 D、变红后颜色不再改变3. 小科把家里的一种白色粉末拿到学校实验室进行实验,如图,则该粉末( )
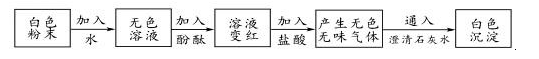 A、可能是碳酸钠 B、可能是碳酸钙 C、一定是一种碱 D、一定是生石灰4. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A、可能是碳酸钠 B、可能是碳酸钙 C、一定是一种碱 D、一定是生石灰4. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
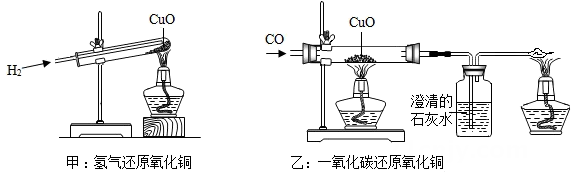 A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应5. 如图为三种物质可能存在的转化关系,根据所学物质的性质及化学变化规律,判断下列说法中正确的是( )
A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应5. 如图为三种物质可能存在的转化关系,根据所学物质的性质及化学变化规律,判断下列说法中正确的是( )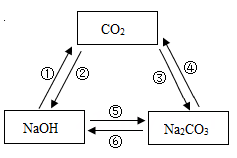 A、不能一步实现转化的有①② B、实现③转化,可通至氯化钠溶液 C、实现⑤转化,可加入碳酸钙粉末 D、实现⑥转化,可加入氢氧化钾溶液6. 下列物质间的转化不能一步完成的是( )A、NaNO3→Na2CO3 B、HCl→HNO3 C、CaCO3→CaCl2 D、BaCl2→NaCl7. 下列实验方案合理的是( )
A、不能一步实现转化的有①② B、实现③转化,可通至氯化钠溶液 C、实现⑤转化,可加入碳酸钙粉末 D、实现⑥转化,可加入氢氧化钾溶液6. 下列物质间的转化不能一步完成的是( )A、NaNO3→Na2CO3 B、HCl→HNO3 C、CaCO3→CaCl2 D、BaCl2→NaCl7. 下列实验方案合理的是( )选项
实验目的
所用试剂或方法
A
稀释浓硫酸
把水倒入浓硫酸中,不断搅拌
B
鉴别NaCl溶液和稀盐酸
向盛有两种溶液的试管中分别滴入AgNO3溶液
C
除去NaOH溶液中的Na2CO3
加入适量的Ca(OH)2溶液、搅拌、过滤
D
验证Zn、Cu、Fe的金属活动性强弱
将铜片分别插入ZnSO4和FeSO4溶液中
A、A B、B C、C D、D8. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
A、HCl、BaCl2、Na2CO3、H2SO4 B、Na2CO3、BaCl2、H2SO4、HCl C、H2SO4、HCl、Na2CO3、BaCl2 D、HCl、H2SO4、BaCl2、Na2CO39. 某固体由 Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀;②在沉淀中加入过量稀硝酸,仍有3克白色沉淀;③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有( )A、Na+、CO32-、SO42- B、Cu2+、CO32-、SO42- C、Cl-、CO32-、SO42- D、Na+、Ba2+、Cl-10. 小金完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,后又出现白色沉淀,则下列说法中正确的是( )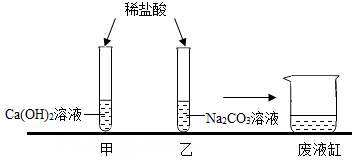 A、甲实验结束后,试管中的溶液中含稀盐酸和CaCl2 B、乙实验结束后,试管中的废液只含NaCl溶质 C、最终,废液缸中一定含有NaCl、NaCO3两种溶质 D、最终,废液缸中一定含有NaCl、CaCl2两种溶质
A、甲实验结束后,试管中的溶液中含稀盐酸和CaCl2 B、乙实验结束后,试管中的废液只含NaCl溶质 C、最终,废液缸中一定含有NaCl、NaCO3两种溶质 D、最终,废液缸中一定含有NaCl、CaCl2两种溶质二、填空题
-
11. 有一包白色粉末,可能含有Na2CO3、Na2SO4、NaCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如下图所示:
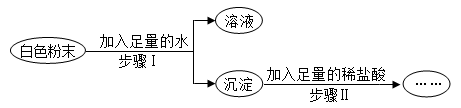 (1)、如果步骤Ⅱ中沉淀全部溶解,写出步骤Ⅰ中生成沉淀的化学方程式。(2)、如果步骤Ⅱ中沉淀部分溶解,则原白色粉末中一定含有。12. 物质王国举行击鼓传花的游戏。某学习小组由铁、氢气、氧化铜、二氧化碳、稀硫酸、氢氧化钠、氯化铜七名成员组成。游戏的规则是:相互之间能发生反应就可以进行传递。请把上述成员安排在A-G的相应位置上,使花束能从A传到G。其中 A为组长,其固体俗称为干冰,F为副组长,其为黑色固体,请回答:
(1)、如果步骤Ⅱ中沉淀全部溶解,写出步骤Ⅰ中生成沉淀的化学方程式。(2)、如果步骤Ⅱ中沉淀部分溶解,则原白色粉末中一定含有。12. 物质王国举行击鼓传花的游戏。某学习小组由铁、氢气、氧化铜、二氧化碳、稀硫酸、氢氧化钠、氯化铜七名成员组成。游戏的规则是:相互之间能发生反应就可以进行传递。请把上述成员安排在A-G的相应位置上,使花束能从A传到G。其中 A为组长,其固体俗称为干冰,F为副组长,其为黑色固体,请回答: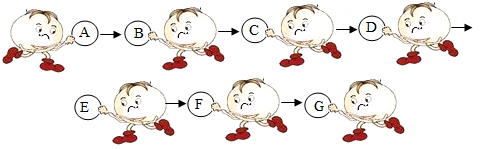 (1)、氢氧化钠应放在位置上。(2)、C和D反应的化学方程式为。(3)、当G换成另一个与G同类别的物质时就能将花束传回起点A,它是(填物质名称)。13. 如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
(1)、氢氧化钠应放在位置上。(2)、C和D反应的化学方程式为。(3)、当G换成另一个与G同类别的物质时就能将花束传回起点A,它是(填物质名称)。13. 如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。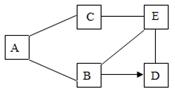 (1)、A物质是(填化学式)。(2)、从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有(填序号)。
(1)、A物质是(填化学式)。(2)、从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有(填序号)。①2类 ②3类 ③4类 ④5类
14. 现有一包固体粉末,可能由硝酸钙、碳酸钠、硫酸钠、碳酸钙和氯化钠中的一种或几种组成,某同学想确定其组成成分,按如图所示步骤进行了如下实验(各步骤中加入的试剂均为足量): (1)、固体粉末中肯定不存在的物质是 , 用化学方程式表示白色沉淀部分溶解的原因是。(2)、如何判断固体粉末中是否有“可能存在的物质”,简述实验操作步骤、现象和结论。15. 某溶液由NaOH、HCl、H2SO4和CuCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。请你从图中获得的信息来分析:
(1)、固体粉末中肯定不存在的物质是 , 用化学方程式表示白色沉淀部分溶解的原因是。(2)、如何判断固体粉末中是否有“可能存在的物质”,简述实验操作步骤、现象和结论。15. 某溶液由NaOH、HCl、H2SO4和CuCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。请你从图中获得的信息来分析: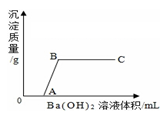 (1)、该溶液中不可能存在的物质是(写化学式);(2)、写出AB段发生反应的化学方程式16. 某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)、该溶液中不可能存在的物质是(写化学式);(2)、写出AB段发生反应的化学方程式16. 某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。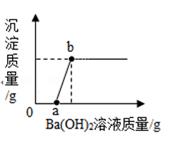 (1)、ab段生成的沉淀是:(填化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填化学式)
(1)、ab段生成的沉淀是:(填化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填化学式)三、实验探究题
-
17. 实验室有一包没有标签的白色固体粉末,老师告知同学其可能由氯化钾、碳酸钾、氢氧化钾中的一种或几种组成。为了检测该白色粉末的成分,科学兴趣小组取一定量样品按以下流程进行实验:
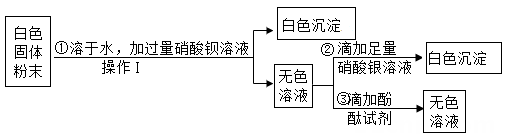 (1)、上述实验中,“操作Ⅰ”的名称是。(2)、根据实验现象,可确定组成白色固体粉末的物质有。(3)、步骤①中不能用 BaCl2 溶液代替 Ba(NO3)2 溶液,其理由是。18. 现有一份质量为m1的氧化铜样品,小金想要测定该样品中氧化铜的质量分数,进行了如图所示实验(样品中的杂质不参加反应)。
(1)、上述实验中,“操作Ⅰ”的名称是。(2)、根据实验现象,可确定组成白色固体粉末的物质有。(3)、步骤①中不能用 BaCl2 溶液代替 Ba(NO3)2 溶液,其理由是。18. 现有一份质量为m1的氧化铜样品,小金想要测定该样品中氧化铜的质量分数,进行了如图所示实验(样品中的杂质不参加反应)。 (1)、写出反应后装置A中的现象;(2)、停止加热后,继续通CO的目的是。(3)、完全反应后,甲同学称得装置B增重m2 , 则样品中氧化铜的质量分数为(用实验所得数据表示);(4)、小胡觉得该装置存在不足,需改进之处是。19. H2、CO和CO2都是初中化学常见的气体。(1)、可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先。(2)、某无色气体X可能含有上述3种气体中的一种或几种。为了确认气体X的组成,同学们按下图装置进行实验。(小资料:碱石灰的主要成分是CaO和NaOH)
(1)、写出反应后装置A中的现象;(2)、停止加热后,继续通CO的目的是。(3)、完全反应后,甲同学称得装置B增重m2 , 则样品中氧化铜的质量分数为(用实验所得数据表示);(4)、小胡觉得该装置存在不足,需改进之处是。19. H2、CO和CO2都是初中化学常见的气体。(1)、可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先。(2)、某无色气体X可能含有上述3种气体中的一种或几种。为了确认气体X的组成,同学们按下图装置进行实验。(小资料:碱石灰的主要成分是CaO和NaOH)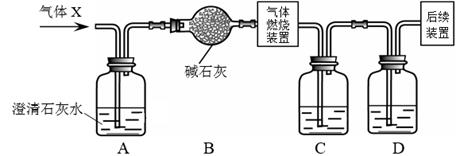
①装置C、D中盛放的试剂依次是。(填序号)
a.烧碱溶液 b.浓硫酸
②若取一定质量的气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C和装置D质量均增加。则气体X的组成是。
四、解答题
-
20. 实验室可用下图装置模拟工业炼铁.
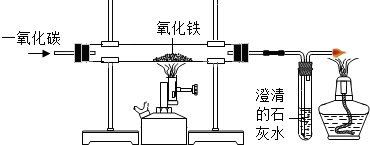 (1)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(2)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨?(计算结果保留一位小数)21. 工业上利用Fe2O3和CO在高温下炼制铁(3CO+Fe2O3 2Fe+3CO2),试通过计算回答(1)、用80吨Fe2O3和足量CO反应可炼得多少铁?(2)、现在冶铁得到56吨铁需80%的赤铁矿石多少吨?22. 用氢气还原氧化铜的方法测定某氧化铜样品的含量(杂质参不与反应),同学们设计了如下实验装置,准确称取10克干燥样品进行实验。
(1)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(2)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨?(计算结果保留一位小数)21. 工业上利用Fe2O3和CO在高温下炼制铁(3CO+Fe2O3 2Fe+3CO2),试通过计算回答(1)、用80吨Fe2O3和足量CO反应可炼得多少铁?(2)、现在冶铁得到56吨铁需80%的赤铁矿石多少吨?22. 用氢气还原氧化铜的方法测定某氧化铜样品的含量(杂质参不与反应),同学们设计了如下实验装置,准确称取10克干燥样品进行实验。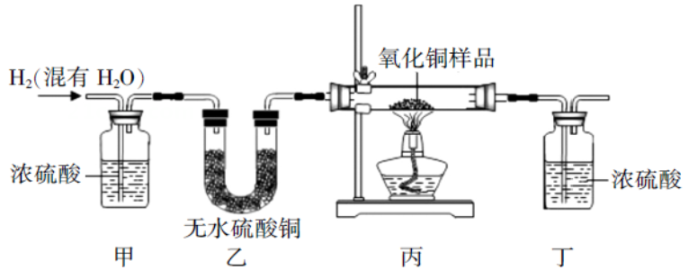 (1)、实验中,乙装置的作用是。(2)、充分反应后,丁装置的质量增加了1.8克,则样品中含氧化铜的质量分数为多少?(3)、下列原因,可能会导致测得的氧化铜的质量分数偏大的是 。A、样品的质量太多 B、空气中的水分被丁处浓硫酸吸收 C、通入的氢气量不足 D、丁处浓硫酸的质量太多23. 建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
(1)、实验中,乙装置的作用是。(2)、充分反应后,丁装置的质量增加了1.8克,则样品中含氧化铜的质量分数为多少?(3)、下列原因,可能会导致测得的氧化铜的质量分数偏大的是 。A、样品的质量太多 B、空气中的水分被丁处浓硫酸吸收 C、通入的氢气量不足 D、丁处浓硫酸的质量太多23. 建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。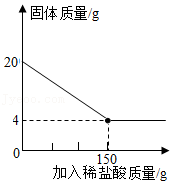 (1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?
(1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?