浙科版科学九年级上学期 第二单元 第一节第二节金属综合 同步练习(3)提高练习
试卷更新日期:2022-09-21 类型:同步测试
一、单选题
-
1. 下列物质可用相应的金属和稀盐酸反应直接制取的是( )。A、AlCl3 B、FeCl3 C、CuCl2 D、AgCl2. 某汽车安全气囊中的反应之一为:6Na+Fe2O3=2Fe+3Na2O,该反应属于( )。A、化合反应 B、置换反应 C、分解反应 D、复分解反应3. 向CuSO4、ZnSO4、H2SO4的混合溶液中,加入过量的Fe粉,反应后溶液中一定有( )A、ZnSO4和H2SO4 B、FeSO4和H2SO4 C、ZnSO4和CuSO4 D、ZnSO4和FeSO44. 生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65~80℃酸性水溶液及氧气存在等条件下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和硫酸亚铁,主要流程如图(“…”表示省略的部分流程):
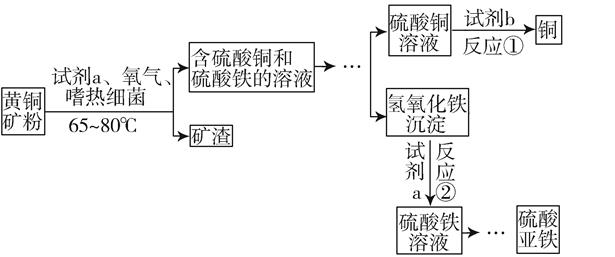
有以下说法:①分离出矿渣的操作是过滤;②试剂b只能是铁粉;③试剂a是稀硫酸;④铁元素在整个流程中都以Fe2+存在。其中错误的是( )
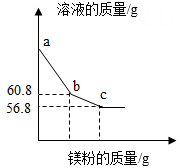
A、①② B、①③ C、②③ D、②④5. 向一定质量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。对该反应过程描述下列说法正确的是( )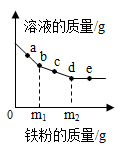 A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中溶质为Mg(NO3)2、Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质6. 在“甲+乙→丙+丁”的反应中。下列说法正确的是( )A、若只有甲、丙为单质,则该反应一定是置换反应 B、若丙、丁为化合物,则该反应一定是复分解反应 C、若丙、丁中有沉淀,则甲、乙中一定有碱 D、若丙、丁为盐和水,则甲、乙一定是酸和碱7. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、
A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中溶质为Mg(NO3)2、Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质6. 在“甲+乙→丙+丁”的反应中。下列说法正确的是( )A、若只有甲、丙为单质,则该反应一定是置换反应 B、若丙、丁为化合物,则该反应一定是复分解反应 C、若丙、丁中有沉淀,则甲、乙中一定有碱 D、若丙、丁为盐和水,则甲、乙一定是酸和碱7. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、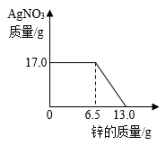 B、
B、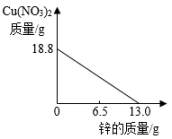 C、
C、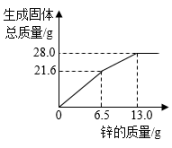 D、
D、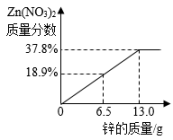 8. 某溶液含有Cu(NO3)2和AgNO3 , 现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( )
8. 某溶液含有Cu(NO3)2和AgNO3 , 现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( ) A、ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等9. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A、ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等9. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( ) A、图线 y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大10. 如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应完的过程中,天平指针指向的变化是( )
A、图线 y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大10. 如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应完的过程中,天平指针指向的变化是( ) A、向左偏 B、向右偏 C、先向左偏后向右偏 D、先向右偏后向左偏
A、向左偏 B、向右偏 C、先向左偏后向右偏 D、先向右偏后向左偏二、填空题
-
11. 2021年6月,嘉兴市有轨电车T1线示范段正式开通。(1)、列车轨道由锰钢制成,锰钢属于材料 (选填“合金”或“有机合成”)。(2)、已知锰的金属活动性介于镁和锌之间,通过实验来比较铁和锰的金属活动性强弱,下列试剂中可以选用的是________。A、Fe、Mn、ZnSO4溶液 B、Fe、Mn、CuSO4溶液 C、Cu、FeSO4 溶液、MnSO4溶液12. 金属在生产生活中得到广泛应用.(1)、铝可以制成铝箔,这是利用了金属铝具有良好的;(2)、现有两种金属单质组成的混合物。向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示。下列说法不正确的一项是。
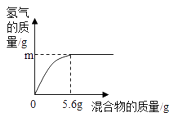
a.若混合物为Zn、Al,则m可能是0.2g
b.若混合物为Zn、Cu,则m=0.2g
c.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
d.若混合物为Fe、Cu,m=0.1g,则混合物中Fe的质量分数为50%
13. 化学就在我们身边,与我们的生活息息相关。请回答以下生活中的问题:(1)、“沙里淘金”说明黄金在自然界中能够以(填“单质”或“化合物”)形式存在。(2)、刘大爷种的小麦出现倒伏现象,你会建议他使用化肥中的肥。(3)、长期使用的热水瓶内胆常有一层水垢(主要成分为碳酸钙),可以用稀盐酸除去。请写出反应的化学方程式:。14. 为了验证铁、铜、银的金属活动性顺序,设计了如下实验:Ⅰ.将铁片浸入稀硫酸;Ⅱ.将铜片浸入稀硫酸;Ⅲ.将铁片浸入硝酸银溶液(1)、写出实验Ⅲ发生的化学方程式.(2)、上述实验(选填“能”或“不能”)验证三种金属的活动性顺序。(3)、将铁、铜、银三种金属浸入溶液(只填一种),即可验证它们的活动性顺序三、实验探究题
-
15.
根据下列图示的探究过程,回答下列问题:
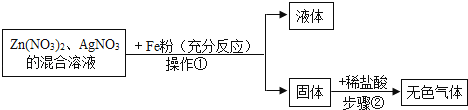 (1)、操作①的名称 .(2)、图中固体中含有的物质(化学式) .(3)、写出步骤②发生反应的化学方程式 .16. 为研究锌和铝的金属活动性,某研究小组进行了如下探究。(1)、小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸,写出锌与盐酸反应的化学方程式:(2)、小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是。(3)、小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
(1)、操作①的名称 .(2)、图中固体中含有的物质(化学式) .(3)、写出步骤②发生反应的化学方程式 .16. 为研究锌和铝的金属活动性,某研究小组进行了如下探究。(1)、小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸,写出锌与盐酸反应的化学方程式:(2)、小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是。(3)、小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
实验编号
实验操作
实验现象
①
加入适量稀盐酸
有微量气泡,固体全部溶解,得到澄清溶液
②
加入适量蒸馏水
固体部分溶解
③
加入适量无水乙醇
固体部分溶解
【得出结论】由实验①可判断假设c(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是。
(4)、你认为(1)中小明的实验能否比较锌和铝的金属活动性强弱?并分别从设计方法和操作可行性的角度,具体说明理由:。17. 一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示:
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10毫升
产生蓝绿色沉淀
②
绿豆大小
浓溶液10毫升
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10毫升
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10毫升
产生蓝色絮状沉淀,并出现黑色固体
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(1)、【实验结论】a.上述实验中均未观察到色固体生成,由此判断猜想一错误。
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
(2)、【实验反思】a.实验中生成氢氧化铜沉淀的原理是。b.由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。
c.为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中,更合理的方案是 , 理由是。
四、解答题
-
18. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
甲
乙
丙
取用金属混合物的质量/g
10
10
20
取用稀硫酸的质量/g
100
120
100
反应后过滤,得干燥固体的质量/g
4.4
4.4
14.4
回答下列问题:
(1)、丙同学所得混合物中铜的质量是。(2)、甲所得溶液中含有溶质的是。(3)、根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为。(4)、计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)19. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。(1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。 (2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。
(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。