浙科版科学九年级上学期 第二单元 第一节第二节金属综合 同步练习(1)
试卷更新日期:2022-09-20 类型:同步测试
一、单选题
-
1. 钡是很活泼的金属。它与水反应的化学方程式为:Ba+2H2O=Ba(OH)2+H2↑,该反应类型属于( )A、置换反应 B、分解反应 C、化合反应 D、复分解反应2. 金属钛有银白色金属光泽,密度为4.5g/cm3 , 熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )A、保险丝 B、医疗器械 C、潜艇外壳 D、眼镜架3. 金属防锈既可以节约资源,又能美化环境,下列钢铁制品经过如下处理后,防锈效果最差的是( )A、经常在表面涂油的大型钢制机械 B、涂上防锈漆后的“辽宁”号航母舰体外壳 C、擦洗干净后长期存放在室外的大型铁制农机具 D、经过“烤蓝”,在表面形成致密氧化膜的钢制枪管4. 甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现如图中箭头所示的转化。不符合上述要求的一组物质是( )
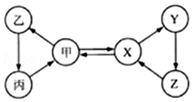
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
A、A B、B C、C D、D5. 有关专家提出了“以废治废”的治理污染新思路,并且起到了一定的成效。如冶炼钢时,为减少煤中硫燃烧生成的二氧化硫所造成的污染,一般是在煤燃烧时添加生石灰或 石灰石进行固硫(主要是利用氧化钙与二氧化硫反应生成亚硫酸钙)。 根据这一原理, 有人将造纸厂回收的碱白泥(主要成分:CaCO3 和 NaOH)掺进煤中进行固硫。用碱白泥固硫时,可能发生了下列化学反应:①S+O2 SO2 ②CaCO3 CaO+CO2 ③SO2+2NaOH=Na2SO3+H2O ④CaCO3+2NaOH=Na2CO3+Ca(OH)2 ⑤SO2+CaO CaSO3
下列说法不正确的是( )
A、①是化合反应 B、生成物都是含氧化合物 C、④这个反应肯定会发生 D、确定能发生的化学反应有①②③⑤6. 据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )A、能与盐酸反应产生氢气 B、在空气中容易锈蚀 C、能与硫酸亚铁发生置换反应 D、具有良好的导电性7. 探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件,对应关系正确的( ) A、甲和乙:水 B、乙和丙:空气 C、甲和丙:空气 D、甲和丁:水8. 已知金属M与硫酸铜溶液反应的化学方程式为M+CuSO4=MSO4+Cu,则下列说法正确的是( )A、M可能是铝 B、反应后M的化合价降低 C、M不可能是铁 D、M的金属活动性比Ag强9. 同质量的铁、锌、镁、铝分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属是( )
A、甲和乙:水 B、乙和丙:空气 C、甲和丙:空气 D、甲和丁:水8. 已知金属M与硫酸铜溶液反应的化学方程式为M+CuSO4=MSO4+Cu,则下列说法正确的是( )A、M可能是铝 B、反应后M的化合价降低 C、M不可能是铁 D、M的金属活动性比Ag强9. 同质量的铁、锌、镁、铝分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属是( ) A、铝、镁、锌、铁 B、铁、锌、镁、铝 C、铝、镁、铁、锌 D、锌、镁、铁、铝10. 现把足量的稀盐酸分为两等份,分别与等质量的X、Y金属反应,生成气体的质量与时 间的关系如图所示。则下列说法正确的是( )
A、铝、镁、锌、铁 B、铁、锌、镁、铝 C、铝、镁、铁、锌 D、锌、镁、铁、铝10. 现把足量的稀盐酸分为两等份,分别与等质量的X、Y金属反应,生成气体的质量与时 间的关系如图所示。则下列说法正确的是( ) A、金属X、Y的活动性关系为:X<Y B、金属完全反应时消耗稀盐酸的质量:X=Y C、X、Y的相对原子质量大小关系为:X<Y D、t3时烧杯中溶液的质量:X<Y
A、金属X、Y的活动性关系为:X<Y B、金属完全反应时消耗稀盐酸的质量:X=Y C、X、Y的相对原子质量大小关系为:X<Y D、t3时烧杯中溶液的质量:X<Y二、填空题
-
11. 铁、镁、铜三种金属的活动性由强到弱的顺序为;将铜投入稀硫酸中反应(选填“会”或“不会”)。12. 如图为铁钉的一系列变化,据图回答问题。
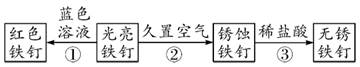 (1)、①中铁钉变红的原因(用化学方程式表示)。(2)、若①②所用的光亮铁钉的质量相同,均为a,无锈铁钉质量b,红色铁钉质量c,则它们的质量由大到小的顺序为(用字母表示)。13. 如图甲所示为探究铁钉锈蚀条件的实验,如图乙所示为用稀盐酸除铁钉表面的铁锈的实验。回答问题:
(1)、①中铁钉变红的原因(用化学方程式表示)。(2)、若①②所用的光亮铁钉的质量相同,均为a,无锈铁钉质量b,红色铁钉质量c,则它们的质量由大到小的顺序为(用字母表示)。13. 如图甲所示为探究铁钉锈蚀条件的实验,如图乙所示为用稀盐酸除铁钉表面的铁锈的实验。回答问题: (1)、如图甲所示实验,若实验结果是试管①③中的铁钉不生锈,试管②中铁钉生锈;则可得出铁钉生锈的条件是:。(2)、如图乙所示实验,若观察到试管中铁钉变得光亮且表面有气泡生成,溶液呈黄色;此时溶液中存在的微粒除H+和Cl-外,还有(不考虑H2O)。14. 人类的生活和生产都离不开金属。铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关(1)、生活中常用铜作导线,主要是利用了铜的。(2)、铁制品锈蚀的过程,实际上是铁丝与空气中的和水蒸气生了化学反应。(3)、为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的 来达到实验目的。(选填字母序号)A、Al2(SO4)3溶液 B、FeSO4溶液 C、CuSO4溶液(4)、可“用稀盐酸除去铁锈,原理是(用化学方程式表示)。15. 如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。请根据下图回答下列问题:
(1)、如图甲所示实验,若实验结果是试管①③中的铁钉不生锈,试管②中铁钉生锈;则可得出铁钉生锈的条件是:。(2)、如图乙所示实验,若观察到试管中铁钉变得光亮且表面有气泡生成,溶液呈黄色;此时溶液中存在的微粒除H+和Cl-外,还有(不考虑H2O)。14. 人类的生活和生产都离不开金属。铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关(1)、生活中常用铜作导线,主要是利用了铜的。(2)、铁制品锈蚀的过程,实际上是铁丝与空气中的和水蒸气生了化学反应。(3)、为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的 来达到实验目的。(选填字母序号)A、Al2(SO4)3溶液 B、FeSO4溶液 C、CuSO4溶液(4)、可“用稀盐酸除去铁锈,原理是(用化学方程式表示)。15. 如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。请根据下图回答下列问题: (1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,这是利用了铝的性。16. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入6.5克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为6.5克。取反应后的滤液观察,滤液 (填“一定”、“一定不”或“可能”)呈蓝色,滤渣中的物质一定有。
(1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,这是利用了铝的性。16. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入6.5克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为6.5克。取反应后的滤液观察,滤液 (填“一定”、“一定不”或“可能”)呈蓝色,滤渣中的物质一定有。三、实验探究题
-
17. 小红为了探究相关金属的化学性质,做了下列实验:
 (1)、A试管中实验现象是。(2)、只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明补充实验所用试剂合理的是 (选填字母)A、Cu、Ag、稀盐酸 B、Cu、AgNO3溶液(3)、实验C中物质充分反应后,小红对试管中固体的成分提出以下四种猜想:A、Zn、Cu、Ag B、Zn、Cu C、Cu、Ag D、Ag 这四种猜想中明显不合理的是 (选填字母)18. 小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先 随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
(1)、A试管中实验现象是。(2)、只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明补充实验所用试剂合理的是 (选填字母)A、Cu、Ag、稀盐酸 B、Cu、AgNO3溶液(3)、实验C中物质充分反应后,小红对试管中固体的成分提出以下四种猜想:A、Zn、Cu、Ag B、Zn、Cu C、Cu、Ag D、Ag 这四种猜想中明显不合理的是 (选填字母)18. 小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先 随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:某金属与同体积盐酸溶液反应实验数据表
盐酸溶液浓度 反应开始时酸
溶液的温度反应开始到2分钟产生的气体体积 反应结束共产生气体体积 5% 20℃ 10mL 60mL 10% 20℃ 19mL 118mL 15% 20℃ 28mL 175mL 5% 35℃ 28mL 60mL 10% 35℃ 72mL 118mL 15% 35℃ 103mL 175mL (1)、分析实验数据得出:一定质量的某种金属和同体积盐酸反应,影响金属和酸反应快慢的主要因素有、。(2)、可以通过比较实验数据来确定金属和酸反应的快慢。(3)、过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因。。19. 为研究锌和铝的金属活动性,某研究小组进行了如下探究。(1)、小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸,写出锌与盐酸反应的化学方程式:(2)、小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是。(3)、小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
实验编号
实验操作
实验现象
①
加入适量稀盐酸
有微量气泡,固体全部溶解,得到澄清溶液
②
加入适量蒸馏水
固体部分溶解
③
加入适量无水乙醇
固体部分溶解
【得出结论】由实验①可判断假设c(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是。
(4)、你认为(1)中小明的实验能否比较锌和铝的金属活动性强弱?并分别从设计方法和操作可行性的角度,具体说明理由:。四、解答题
-
20. 为测定黄铜(铜锌合金)样品中铜的质量分数,某同学先将样品粉碎,再加入足量稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示。请回答:
 (1)、黄铜属于(填“金属材料”或“有机材料”)。(2)、样品中铜的质量是克。(3)、恰好完全反应时,所得溶液中溶质的质量分数是多少?(计算结果精确到0.1%)21. 某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表。请计算:
(1)、黄铜属于(填“金属材料”或“有机材料”)。(2)、样品中铜的质量是克。(3)、恰好完全反应时,所得溶液中溶质的质量分数是多少?(计算结果精确到0.1%)21. 某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表。请计算:第一次 第二次 第三次 第四次 所取合金的质量∕g 10 10 20 30 所加稀硫酸的质量∕g 100 120 80 X 生成氢气的质量∕g 0.2 0.2 0.2 Y (1)、上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则:其中X=;Y=。(2)、该铜铁合金中铁的质量分数是多少?(3)、所加稀硫酸溶质质量分数为多少?22. 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算: (1)、稀硫酸反应完时,产生氢气的质量为g(2)、消耗金属锌的质量是多少克(3)、反应结束时溶液溶质的质量分数?
(1)、稀硫酸反应完时,产生氢气的质量为g(2)、消耗金属锌的质量是多少克(3)、反应结束时溶液溶质的质量分数?