浙教版科学九年级上学期 第一单元 物质及其变化 综合卷(2)
试卷更新日期:2022-09-20 类型:单元试卷
一、单选题
-
1. “庄稼一枝花,全靠肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起重要作用。下列属于复合肥料的是 ( )A、硝酸铵NH4NO3 B、磷酸二氢铵NH4H2P04 C、尿素CO(NH2)2 D、碳酸氢钾KHCO32. 下列变化中,属于化学变化的是( )A、石蜡熔化 B、汽油挥发 C、湿衣晾干 D、木柴燃烧3. 在下列物质的溶液中,分别滴加氢氧化钠溶液,能产生红褐色沉淀的是( )。A、CuCl2 B、BaCl2 C、MgCl2 D、FeCl34. 用酒精和水浸泡蝴蝶兰花可得到紫色溶液,该溶液遇酸溶液显红色,遇碱性溶液显黄色。下列说法正确的是( )A、蝴蝶兰花的溶液与酸作用显红色是物理变化 B、能使蝴蝶兰花的溶液显黄色的一定是碱溶液 C、将氯化钠溶液滴入蝴蝶兰花的溶液后,溶液仍为紫色。 D、往氢氧化镁中滴加蝴蝶兰花的溶液呈黄色5. 小科学习了《物质的酸碱性》课程后,决定用 pH 试纸测定一些物质的 pH,下列做法能达到实验目的是( )A、用湿润的pH试纸测定稀硫酸的pH B、用干燥的pH试纸测定浓硫酸的pH C、用pH试纸浸入矿泉水测得pH为7.2 D、用干燥的pH试纸测出胃液的pH为26. 一种用软锰矿(主要成分是MnO2)制备KMnO4的工艺中主要涉及下列反应:
①
②
下列有关说法正确的是( )
A、K2MnO4中锰元素显+7价 B、KMnO4属于盐类物质 C、反应②属于复分解反应 D、该制法中K2MnO4是主要原料7. 三氧化二碳(化学式C2O3)通常情况下是一种无色无味的气体,可溶于水,与水反应生成草酸,且常温下不稳定,其他的化学性质与一氧化碳相似。下列有关三氧化二碳说法正确的是( )A、三氧化二碳是由2个碳原子和3个氧原子构成的 B、用干燥的蓝色石蕊试纸检测 C2O3时试纸变红 C、在空气中充分燃烧的产物为二氧化碳 D、不能与氢氧化钠溶液反应生成盐8. 将稀盐酸与澄清石灰水充分反应后的溶液倒入烧杯,向烧杯逐滴加入碳酸钠溶液。生成沉淀的质量与加入碳酸钠溶液的质量之间的关系如图所示。下列说法正确的是( ) A、ab段溶液质量逐渐减少 B、bc段氯化钙的质量逐渐增大 C、c点时溶液中溶质为NaCl、CaCl2 D、d点对应溶液中含有的微粒只有Na+、Cl-、Ca2+9. 在Na2CO3溶液中逐渐加入盐酸,反应中溶液pH随加入盐酸质量变化的关系为( )
A、ab段溶液质量逐渐减少 B、bc段氯化钙的质量逐渐增大 C、c点时溶液中溶质为NaCl、CaCl2 D、d点对应溶液中含有的微粒只有Na+、Cl-、Ca2+9. 在Na2CO3溶液中逐渐加入盐酸,反应中溶液pH随加入盐酸质量变化的关系为( )
A、 B、
B、 C、
C、 D、
D、 10. 取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
10. 取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
玫瑰
粉红色
粉红色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
则下列说法中正确的是( )
A、可用雏菊花汁来区别稀HCl和NaCl溶液 B、25℃时,遇到pH=10的溶液,玫瑰花汁会变成粉红色 C、研磨花瓣过程中加入酒精是为了溶解其中的色素 D、上述三种花汁都能用作酸碱指示剂11. 氢氧化钾性质与氢氧化钠相似,下列有关氢氧化钾的说法正确的是 ( )A、氢氧化钾固体露置在空气中易变质 B、氢氧化钾溶液能使石蕊溶液变红 C、氢氧化钾溶液与碳酸铜反应生成蓝色沉淀 D、112 克氢氧化钾溶液与 98 克硫酸溶液恰好完全反应12. 小科完成了图示实验①②③,下列判断正确的是( ) A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含 CaCl2和 NaCl13. 某兴趣小组以“稀硫酸与氢氧化钠能否发生反应"为题探究,下列试剂中,不能用来证明两者能发生反应的是( )A、pH试纸 B、硫酸铜溶液 C、氯化钡溶液 D、铁粉14. 盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,错误的是( )A、盐酸是氯化氢气体的水溶液 B、浓盐酸是黄色有刺激性气味的液体 C、人的胃液里含少量的盐酸,可以帮助消化 D、浓盐酸具有挥发性,在空气中会形成白雾15. 稀NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示,下列说法正确的是( )
A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含 CaCl2和 NaCl13. 某兴趣小组以“稀硫酸与氢氧化钠能否发生反应"为题探究,下列试剂中,不能用来证明两者能发生反应的是( )A、pH试纸 B、硫酸铜溶液 C、氯化钡溶液 D、铁粉14. 盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,错误的是( )A、盐酸是氯化氢气体的水溶液 B、浓盐酸是黄色有刺激性气味的液体 C、人的胃液里含少量的盐酸,可以帮助消化 D、浓盐酸具有挥发性,在空气中会形成白雾15. 稀NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示,下列说法正确的是( ) A、该实验是将稀Na0H溶液滴入稀盐酸 B、稀NaOH溶液与稀盐酸反应为吸热反应 C、40s时,溶液中溶质为HCl、NaOH和NaCl D、在20s到40s之间某一时刻,两溶液恰好完全反应16. 向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )
A、该实验是将稀Na0H溶液滴入稀盐酸 B、稀NaOH溶液与稀盐酸反应为吸热反应 C、40s时,溶液中溶质为HCl、NaOH和NaCl D、在20s到40s之间某一时刻,两溶液恰好完全反应16. 向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )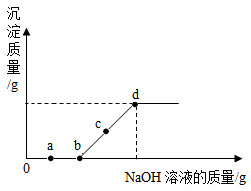 A、a 点溶液中滴入紫色石蕊试液变红 B、bd 段(不含 b、d 点)反应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl C、整个变化过程中氯离子数目发生改变 D、c 点溶液中含两种溶质17. 将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
A、a 点溶液中滴入紫色石蕊试液变红 B、bd 段(不含 b、d 点)反应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl C、整个变化过程中氯离子数目发生改变 D、c 点溶液中含两种溶质17. 将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( ) A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HICl=BaCl2+2H2O18. 往含有少量HCl的MgSO4溶液中滴加Ba(OH)2溶液,最终得到BaSO4和Mg(OH)2两种沉淀,生成沉淀的质量与加入的Ba(OH)2溶液质量的关系图像为( )A、
A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HICl=BaCl2+2H2O18. 往含有少量HCl的MgSO4溶液中滴加Ba(OH)2溶液,最终得到BaSO4和Mg(OH)2两种沉淀,生成沉淀的质量与加入的Ba(OH)2溶液质量的关系图像为( )A、 B、
B、 C、
C、 D、
D、 19. 在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:
19. 在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:AlCl3+ 3NaOH = Al(OH)3↓+ 3NaCl ,Al(OH)3 + NaOH = NaAlO2 + 2H2O ,NaAlO2易溶于水。
下列图像正确的是( )
A、 B、
B、 C、
C、 D、
D、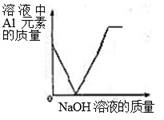 20. 已知,电磁铁的磁性随电流的增大而增强。如图,电源电压保持不变,弹簧秤下挂着一块铁。现在盛有硫酸铜溶液的烧杯中,逐渐滴入氢氧化钡溶液可发现弹簧秤的示数( )
20. 已知,电磁铁的磁性随电流的增大而增强。如图,电源电压保持不变,弹簧秤下挂着一块铁。现在盛有硫酸铜溶液的烧杯中,逐渐滴入氢氧化钡溶液可发现弹簧秤的示数( )
 A、逐渐变小,最后趋于稳定 B、一直保持不变 C、先变小,后变大,最后趋于稳定 D、先变大,后变小,最后趋于稳定
A、逐渐变小,最后趋于稳定 B、一直保持不变 C、先变小,后变大,最后趋于稳定 D、先变大,后变小,最后趋于稳定二、填空题
-
21. 浓硫酸在实验室中常用作干燥剂,因为浓硫酸具有 , 下列气体①SO2②NH3③H2;其中浓硫酸能干燥的气体有(填序号);
①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中少量的氢氧化钠杂质,不能用硫酸来代替的是(填序号)。22. 实验室存放石灰水的试剂瓶壁往往附有一层不溶于水的白色固体物质,主要成分为 , 可以用清洗。石灰浆[主要成分是Ca(OH)2]广泛用来黏合砖石,石灰浆表面迅速硬化的主要原因是(用化学方程式表示)。23. 测定人体体液的pH可以帮助我们了解身体状况,如图是小茗同学体检报告单截图,看图后回答问题:项目
检测值
正常pH范围
血浆
7.4
7.35-7.45
胃液
0.8
0.9-1.5
胆汁
7.21
7.1-7.3
胰液
7.8
7.5-8.0
(1)、小茗同学的指标中有一项出现异常,医生除了给他开了药物之外,还提醒他注意饮食,下列食物(近似PH如下)中适合该同学得有 。
A、番茄(4.0--4.4) B、苹果(2.9--3.3) C、牛奶(6.3-6.6) D、鸡蛋清(7.6--8.0)(2)、小茗同学想到在实验室中可用pH试纸测量溶液酸碱度,于是他从家里找来苹果,并用湿润的pH试纸进行了测量,那么测得的pH比实际结果 。A、偏大 B、偏小 C、不变 D、无法判断24. 从HCl、NaCl、NaOH、Na2CO3、Ca(OH)2几种溶液中取出其中的两种混合进行相关实验。 (1)、若两种溶液混合后溶液的总质量减小,则它们的组合可能是:。(2)、将稀硫酸逐滴滴入某种组合后的溶液中,若产生气体与加入稀硫酸如图所示的关系,则这样的组合可能是。25. 室温下,将稀盐酸慢慢滴入滴有酚酞的氢氧化钠溶液中,利用温度计测出溶液的温度随加入的稀盐酸质量而发生的变化,如图所示。
(1)、若两种溶液混合后溶液的总质量减小,则它们的组合可能是:。(2)、将稀硫酸逐滴滴入某种组合后的溶液中,若产生气体与加入稀硫酸如图所示的关系,则这样的组合可能是。25. 室温下,将稀盐酸慢慢滴入滴有酚酞的氢氧化钠溶液中,利用温度计测出溶液的温度随加入的稀盐酸质量而发生的变化,如图所示。 (1)、由图示可知,稀盐酸与氢氧化钠溶液的反应是(填“吸热”、“放热”)反应;(2)、B处溶液的溶质是;(3)、在C点可观察到的现象是;(4)、在D处溶液里滴加AgNO3溶液,出现白色沉淀,即可推断稀盐酸已过量,请判断该推断是否合理并说明理由。26. 为证明酸与碱发生反应,实验小组同学进行了如下实验。室温下,甲同学将稀硫酸慢慢滴入装有氢氧化钠稀溶液的烧杯中,利用温度计测出烧杯中溶液的温度随时间的变化曲线如图。
(1)、由图示可知,稀盐酸与氢氧化钠溶液的反应是(填“吸热”、“放热”)反应;(2)、B处溶液的溶质是;(3)、在C点可观察到的现象是;(4)、在D处溶液里滴加AgNO3溶液,出现白色沉淀,即可推断稀盐酸已过量,请判断该推断是否合理并说明理由。26. 为证明酸与碱发生反应,实验小组同学进行了如下实验。室温下,甲同学将稀硫酸慢慢滴入装有氢氧化钠稀溶液的烧杯中,利用温度计测出烧杯中溶液的温度随时间的变化曲线如图。 (1)、该曲线说明中和反应是放热反应,B 点后溶液温度下降的原因是。(2)、B 点对应溶液的溶质成分是 , B 到 A 的过程中溶液的 pH 逐渐减小。(3)、向氢氧化钠溶液中加入一定量的稀硫酸,测得反应后溶液中 Na+与 SO42-的个数比为时,证明两者恰好完全中和。
(1)、该曲线说明中和反应是放热反应,B 点后溶液温度下降的原因是。(2)、B 点对应溶液的溶质成分是 , B 到 A 的过程中溶液的 pH 逐渐减小。(3)、向氢氧化钠溶液中加入一定量的稀硫酸,测得反应后溶液中 Na+与 SO42-的个数比为时,证明两者恰好完全中和。三、实验探究题
-
27. 某兴趣小组对“稀盐酸与石灰石是否恰好完全反应”展开了系列实验(稀盐酸与石灰石中杂质不反应)。

【实验操作】取一块状石灰石于试管中,往试管中加入5毫升稀盐酸。
【实验现象】①开始时固体表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液无色。
【初步分析】⑴反应停止后,某同学根据上述实验现象进行初步判断,得出了石灰石没有反应完的结论。支持该同学得出这一结论的依据是(填上述实验现象的序号)。
【小组讨论】大家讨论后认为,要判断是否恰好完全反应,可以从液体和固体两条途径进行探究:一是探究残留液体中是否还有盐酸;二是探究残留块状固体中是否还有碳酸钙。
【继续探究】⑵对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论。
⑶探究原残留液体中是否还有盐酸,真正需要检验的离子是;
⑷探究残留块状固体中是否还有碳酸钙。小丽取原残留块状固体用水洗净后加入稀盐酸,将产生的气体通入澄清石灰水,出现了的现象,于是得出残留块状固体中还存在碳酸钙。
【实验结论】在原反应结束时,稀盐酸与石灰石没有恰好完全反应,石灰石中碳酸钙有剩余。
28. 小苏打(NaHCO3)和食盐NaCl是厨房中常用物质,现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组同学展开了系列拓展性研究。【实验目的】确定白色固体的组成
【实验方案】

【实验结论】该白色固体由NaHCO3和NaCl两种物质组成
(1)、基于上述实验结论,则步骤①中加入的过量稀酸应该是。(2)、写出步骤②中生成白色沉淀的化学反应方程式。29. 某兴趣小组同学发现实验台上整齐摆放的药品中(如图),有一试剂瓶的标签受损。



【提出问题】这瓶试剂是什么?
【讨论、猜想】可能是Na2SO4溶液;也可能是NaOH溶液;还可能是……。
【设计与实验】
(1)、甲同学根据受损标签及实验室药品分类摆放的原则,认为如果是NaOH溶液可以不用做实验只要看一下就可以分辨,你认为甲同学能这么快分辨的理由是。(2)、乙同学用上图已有的试剂做实验,鉴别出了该试剂就是Na2SO4溶液。操作步骤
实验现象
取样于试管中,滴入溶液;
30. Mg(OH)2是一种新型的阻燃剂,在温度达到380℃时分解吸收热量并释放出水,同时生成的氧化镁附着于可燃物的表面阻止了进一步燃烧。某同学用氨水在实验室模拟制取 Mg(OH)2的过程:一定温度下,往一定量的氯化镁中加入氨水(氨水易挥发),生成Mg(OH)2 , 再通过结晶、过滤,得到Mg(OH)2晶体。为探究获得较高Mg(OH)2晶体转化率的条件,该同学进行下述对比实验,数据如下:实验编号
氯化镁溶液浓度/g•L﹣1
反应温度/℃
Mg(OH)2转化率/%
a
20
30
27.06
b
40
30
56.77
c
40
40
69.64
d
40
60
54.30
e
60
60
50.60
(1)、实验b和c的目的是。(2)、由实验数据可知,能够得到最多Mg(OH)2的条件是(填浓度和温度)(3)、在氯化镁溶液浓度都是40g•L﹣1的情况下,60℃时Mg(OH)2的转化率比40℃时低的原因是。四、解答题
-
31. 向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答:
 (1)、OA段无沉淀产生,请写出反应的化学方程式:。(2)、求产生氢气的质量是多少克?(写出计算过程)32. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:(1)、配制了8 g 10%的NaOH溶液,需要水的质量为。(2)、计算该盐酸的溶质质量分数。(写出计算过程)(3)、当滴入4 g盐酸时,烧杯内溶液中钠元素的质量为。
(1)、OA段无沉淀产生,请写出反应的化学方程式:。(2)、求产生氢气的质量是多少克?(写出计算过程)32. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:(1)、配制了8 g 10%的NaOH溶液,需要水的质量为。(2)、计算该盐酸的溶质质量分数。(写出计算过程)(3)、当滴入4 g盐酸时,烧杯内溶液中钠元素的质量为。 33. 学校某兴趣小组做了氧化铜和盐酸反应的实验,小明为测定反应后混合溶液的成分及含量,想烧杯中分5次共加入200克10%的氢氧化钠溶液,得到沉淀的质量记录如下:
33. 学校某兴趣小组做了氧化铜和盐酸反应的实验,小明为测定反应后混合溶液的成分及含量,想烧杯中分5次共加入200克10%的氢氧化钠溶液,得到沉淀的质量记录如下: (1)、分析实验过程,第一次加入40.0克NaOH,为什么没有生成沉淀?。(2)、分析实验过程,如果加入90克NaOH,溶液中的溶质是。(3)、原来混合液中氯化铜的质量为多少克?(写出具体计算过程)(4)、若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成就计算氯化铜的含量 。A、偏高 B、偏低 C、不变
(1)、分析实验过程,第一次加入40.0克NaOH,为什么没有生成沉淀?。(2)、分析实验过程,如果加入90克NaOH,溶液中的溶质是。(3)、原来混合液中氯化铜的质量为多少克?(写出具体计算过程)(4)、若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成就计算氯化铜的含量 。A、偏高 B、偏低 C、不变