云南省名校联盟2022届高三第二次模拟考试理科综合化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、科技、医药等密切相关。下列叙述正确的是( )A、疫苗一般应冷藏存放,其目的是避免蛋白质变性 B、聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程 C、“嫦娥5号”带回的月壤中含3He,它与4He互为同素异形体 D、“天和”核心舱中使用的氮化硼陶瓷基复合材料属于高分子材料2. CO与气体均会造成环境污染,研究表明二者可在表面转化为无害气体,其反应进程及能量变化过程如图所示。下列说法正确的是( )
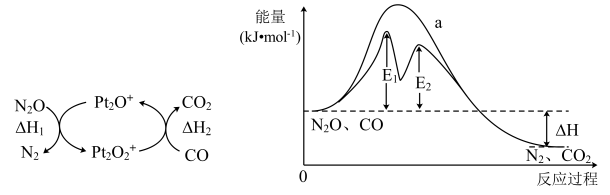 A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂3. 下列实验操作对应的现象和根据现象得出的结论均正确的是( )
A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂3. 下列实验操作对应的现象和根据现象得出的结论均正确的是( )选项
实验操作
现象
结论
A
向溶液中加入浓KOH溶液
溶液由黄色变为红褐色
生成了氢氧化铁胶体
B
向某溶液中滴加NaSCN溶液
产生红色沉淀
溶液中存在三价铁离子
C
向某溶液中滴加溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
向溶液中滴加溶液
有白色沉淀和气体产生
与发生了相互促进水解反应
A、A B、B C、C D、D4. 2020年初爆发的新型冠状病毒及其变异病株,至今还对世界人民的健康造成巨大威胁,我国政府在抗击疫情方面作出巨大贡献。茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示,下列说法错误的是( ) A、茚地那韦可以发生水解反应、酯化反应、还原反应 B、茚地那韦分子中含有羟基和酯基 C、虚线框内的所有原子一定不处于同一平面 D、茚地那韦属于芳香化合物,能使高锰酸钾溶液褪色5. 下列离子组在对应的溶液中一定能大量共存的是( )A、在加入铝粉能产生的溶液中:、、、 B、能使紫色石蕊变红的溶液:、、、 C、含有大量的溶液:、、、 D、1 mol∙L−1 溶液中:、、、6. 据相关资料报道,一种新型漂白剂M(如图)可用于漂白羊绒、羽毛等,其中W、Y、Z为不同周期不同主族元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布均与Ne原子相同。下列叙述错误的是( )
A、茚地那韦可以发生水解反应、酯化反应、还原反应 B、茚地那韦分子中含有羟基和酯基 C、虚线框内的所有原子一定不处于同一平面 D、茚地那韦属于芳香化合物,能使高锰酸钾溶液褪色5. 下列离子组在对应的溶液中一定能大量共存的是( )A、在加入铝粉能产生的溶液中:、、、 B、能使紫色石蕊变红的溶液:、、、 C、含有大量的溶液:、、、 D、1 mol∙L−1 溶液中:、、、6. 据相关资料报道,一种新型漂白剂M(如图)可用于漂白羊绒、羽毛等,其中W、Y、Z为不同周期不同主族元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布均与Ne原子相同。下列叙述错误的是( ) A、M的漂白原理与相同 B、是一种弱酸 C、W、X元素的简单离子半径相比,W简单离子的半径大 D、M中部分原子未达到8电子稳定结构7. 我国化学工作者提出一种利用有机电极()和无机电极(/石墨毡)在酸性环境中可充电的电池,其放电时的工作原理如图所示:
A、M的漂白原理与相同 B、是一种弱酸 C、W、X元素的简单离子半径相比,W简单离子的半径大 D、M中部分原子未达到8电子稳定结构7. 我国化学工作者提出一种利用有机电极()和无机电极(/石墨毡)在酸性环境中可充电的电池,其放电时的工作原理如图所示:
下列说法正确的是( )
A、放电时,/石墨毡为负极,发生还原反应 B、充电时,有机电极和外接电源的正极相连 C、放电时,/石墨毡电极的电极反应式为 D、充电时,每生成2molHQ,理论上外电路中转移电子数为8mol二、非选择题
-
8. 碳酸锂广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。从煤粉灰(、、、等)中回收提取铝、锂元素的化合物的流程如图所示:

已知:碳酸锂的溶解度为(g/L)
温度/℃
0
10
20
30
40
50
60
80
100
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
(1)、如何提高酸浸速率?(任写一条)(2)、滤渣2的主要成分为;刚好沉淀完全的pH为。{已知: , 离子浓度≤时表示该离子沉淀完全}。(3)、从滤渣2中分离出 , 可用如图所示的方法,步骤1的离子方程式为。 (4)、“沉锂”的化学反应方程式为。(5)、“沉锂”中的“一系列操作”依次为、、洗涤、干燥,检验碳酸锂已经洗涤干净的方法为。9. 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
(4)、“沉锂”的化学反应方程式为。(5)、“沉锂”中的“一系列操作”依次为、、洗涤、干燥,检验碳酸锂已经洗涤干净的方法为。9. 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
已知:①不溶于水,密度比水的大;
②不溶于;
③三颈烧瓶内盛放有、水和催化剂。
回答下列问题:
(1)、制备溶液:①实验前,经检验装置的气将性良好。其中装置A中发生反应的化学方程式为;的电子式为;三颈烧瓶的下层液体必须浸没导气管口,目的是。
②实验开始时,打开K1 , 加热装置A、D,使A中产生的气体缓缓通入D中,发生反应: , 该反应缓慢进行至消失。
(2)、制备KSCN溶液:①地灭A处的酒精灯,关闭K1和K2 , 移开水浴,将装置D继续加热至105℃,当完全分解后(),打开K2 , 继续保持液温105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。使用KOH溶液会使产品KSCN固体混有较多的 , 工业上用相同浓度的溶液替换KOH溶液,除能与反应产生更多和气体,有利于残留在装置中的溢出,同时又使原料成本(填“增大”或“降低”);
②装置E中,被酸性重铬酸钾氧化为氮气,反应的离子方程式为;装置E的作用是。
(3)、测定晶体史KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴溶液作指示剂,用标准溶液滴定,达到滴定终点时消耗标准溶液20.00mL。①滴定时发生的反应:(白色)。则判断达到滴定终点的现象是。
②晶体中KSCN的质量分数为(计算结果精确至0.1%)。
10. 目前人工固氨和二氧化碳利用技术,对人类生存、社会进步和经济发展都有着重大意义。(1)、Ⅰ.目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,其总反应可表示为。该反应能自发的条件是(填“低温”或“高温”)。
(2)、二氧化碳催化加氢制甲醇合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃时x(CH3OH)随压强(p)的变化及在时x(CH3OH)随温度(t)的变化,如图所示。
①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②t=250℃时,当x(CH3OH)=0.10时,的平衡转化率 , (保留小数点后一位)此条件下该反应的Kp=。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
(3)、研究表明,在电解质水溶液中,电池中的气体可被还原,在(填“正”或“负”)极发生电化学反应,而在碱性介质中被还原为正丙醇(CH3CH2CH2OH),其电极反应方程式为。(4)、Ⅱ.目前工业上利用氮气和氢气催化合成氨是人工固氮的主要手段。合成氨的反应历程和能量变化如图所示。请回答下列问题:
合成氨反应的热化学方程式为。
(5)、对总反应速率影响较大的步骤的能垒(活化能)为kJ,该步骤的化学方程式为。11. 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:(1)、过渡元素Co基态原子的核外电子排布式为;第四电离能 , 其原因是。(2)、Fe、Fe2+、Fe3+可以与CO、、、(尿素)等多种配体形成很多的配合物。①配合物的熔点为-20℃,沸点为103℃,可用于制备纯铁。的结构如图所示。下列关于说法错误的是(填序号)。

A.是分子晶体
B.中Fe原子的配体与互为等电子体
C.中σ键与π键之比为1∶1
D.反应中没有新化学键生成
②的电子式为。
③(尿素)中N原子的杂化方式为 , 组成尿素的4种元素的第一电离能由大到小的顺序为。
(3)、Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为( , , )。
①Ni的配位数为。
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为。
12. 光刻胶的生产流程如图(部分试剂和产物略去)。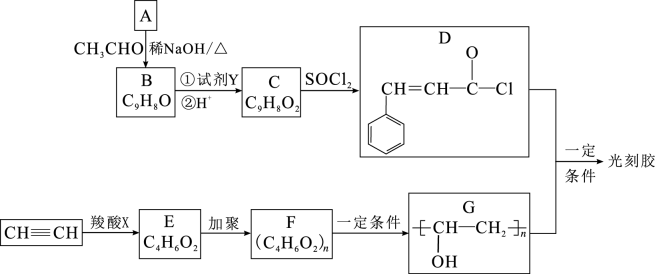
已知:①
 +
+ 
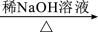
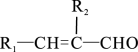 (R1、R2为羟基或氢原子);
(R1、R2为羟基或氢原子);②
 +R4OH
+R4OH 
 +HCl (R3、R4为烃基)。(1)、羧酸X的名称为 , E的核磁共振氢谱为三组峰,且峰面积之比为3∶2∶1,E能发生水解反应,则E中所含官能团名称为。(2)、D的分子式为。(3)、若试剂Y为银氨溶液,写出反应①的化学方程式: , 由C到D的反应类型为。(4)、光刻胶的结构简式为。(5)、C的同分异构体满足下列条件:①能发生银镜反应,其水解产物之一能与溶液发生显色反应;②除苯环外不含其他环状结构;则该同分异构体共有种。(6)、根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任选)。
+HCl (R3、R4为烃基)。(1)、羧酸X的名称为 , E的核磁共振氢谱为三组峰,且峰面积之比为3∶2∶1,E能发生水解反应,则E中所含官能团名称为。(2)、D的分子式为。(3)、若试剂Y为银氨溶液,写出反应①的化学方程式: , 由C到D的反应类型为。(4)、光刻胶的结构简式为。(5)、C的同分异构体满足下列条件:①能发生银镜反应,其水解产物之一能与溶液发生显色反应;②除苯环外不含其他环状结构;则该同分异构体共有种。(6)、根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任选)。