四川省泸州市2021-2022学年高三第一次教学质量诊断性考试理科综合化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 2021年诺贝尔化学奖授予德国本杰明·李斯特和英国戴维·麦克米兰发明的不对称有机催化成果,全世界催化剂贡献GDP约占35%。下列有关催化剂的说法错误的是( )A、催化剂不只是含金属元素的物质 B、催化剂能降低反应所需的活化能 C、催化剂能改变化学反应的平衡常数 D、催化剂能加快正逆反应速率并降低能耗2. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,3.6gH2O中所含电子数为2NA B、标准状况下,44.8LCO2含有2NA个O2 C、0.1mol/LKAl(SO4)2溶液中所含Al3+的数目小于0.1NA D、足量铁与7.1g氯气加热反应转移电子的数目为0.3NA3. 下列装置对应操作正确且能达到实验目的的是( )
装置
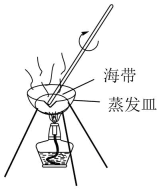

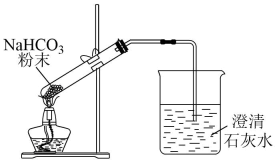

目的
A.将海带灼烧成灰烬
B.将Fe(OH)3胶体与FeCl3溶液分离
C.验证碳酸氢钠受热易分解
D.排掉碱式滴定管
胶管内的气泡
A、A B、B C、C D、D4. 下列实验方案设计中,操作现象都正确且能达到实验目的的是( )选项
实验目的
实验方案
A
证明:H2SO3的酸性大于H2S
向Na2S溶液中缓缓通入过量SO2 , 观察到大量臭鸡蛋气味气体逸出
B
证明:Fe比Cu活泼
Cu片插入稀硫酸无气泡,Fe片和Cu片用导线连接后插入稀硫酸中,铜片表面产生气泡
C
证明:K2Cr2O7溶液中存在下列平衡Cr2O+H2O2CrO+2H+
将K2Cr2O7固体溶于水后,加入浓盐酸,观察到溶液
橙色加深
D
证明:硫酸能否将Fe2+氧化为Fe3+
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,观
察到溶液变红
A、A B、B C、C D、D5. 某离子反应中涉及H+、Fe3+、MnO、FeO、Mn2+、H2O六种粒子,其中MnO的浓度随反应进行逐渐增大。下列说法错误的是( )A、该反应的氧化产物为MnO B、氧化剂与还原剂的物质的量之比为5:3 C、该溶液中FeO的氧化性强于MnO D、溶液中FeO、Na+、Cl-、S2-能大量共存6. 复旦大学教授吴字平课题组研制的水溶液锂电池成功应用于电动汽车,原理如图所示。其中锂电极用复合膜包裹,复合膜只允许Li+通过;尖晶石锰酸锂(LiMn2O4)覆盖碳膜上,发生的转化为LiMn2O4Li1-xMn2O4。下列有关说法正确的是( ) A、放电时,Li+由电解质溶液穿进复合膜 B、放电时,正极反应为Li1-xMn2O4+xLi++xe-=LiMn2O4 C、充电时,电极a为阳极,发生氧化反应 D、该电池的缺点是存在副反应2Li+2H2O=2LiOH+H2↑7. 天然水体中的H2CO3与空气中的CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9 , 温度不变下若改变某溶洞水体中的pH,测得平衡时溶液中pX=-lgc(X)(X为H2CO3、HCO、CO或Ca2+)与pH的关系如图所示。下列说法错误的是( )
A、放电时,Li+由电解质溶液穿进复合膜 B、放电时,正极反应为Li1-xMn2O4+xLi++xe-=LiMn2O4 C、充电时,电极a为阳极,发生氧化反应 D、该电池的缺点是存在副反应2Li+2H2O=2LiOH+H2↑7. 天然水体中的H2CO3与空气中的CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9 , 温度不变下若改变某溶洞水体中的pH,测得平衡时溶液中pX=-lgc(X)(X为H2CO3、HCO、CO或Ca2+)与pH的关系如图所示。下列说法错误的是( ) A、曲线①代表X为HCO B、H2CO3的二级电离常数为1×10-10.3 C、点a溶液中,c(Ca2+)=0.28mol·L-1 D、点b溶液中,c(HCO)=1×10-3mol·L-1
A、曲线①代表X为HCO B、H2CO3的二级电离常数为1×10-10.3 C、点a溶液中,c(Ca2+)=0.28mol·L-1 D、点b溶液中,c(HCO)=1×10-3mol·L-1二、非选择题
-
8. 氯化亚砜(SOCl2)常用作脱水剂。某校科研小组拟以Cl2、S2Cl2、ClSO3H(氯磺酸)为原料合成SOCl2并探究其相关性质,制备装置如图所示。有关物质的部分性质见表。
物质
熔点/℃
沸点/℃
其他性质
SOCl2
-105
78.8
易水解,温度高于150℃分解
ClSO3H
-80
156
具有强吸水性,不易分解
S2Cl2
-77
138
遇水即反应

回答下列问题:
(1)、装置A中可能的试剂是(选填数字编号)。①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
(2)、装置D中盛放的试剂是 , 装置E的作用是。(3)、将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3 , 试解释原因。(4)、小明同学认为SOCl2也可与FeCl3·6H2O混合制取无水FeCl3 , 但小强同学认为可能会发生副反应使最后的产品不纯,可能产生的杂质微粒是;为验证猜想,可选择的试剂是(选填数字编号)。①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液
(5)、若硫元素全部转化到目标产物中,在50℃下C中发生反应的化学方程式为;反应结束后,利用如图所示装置将C中混合物分离,毛细玻璃管的作用是。 9. 硫氰化钾(KSCN)俗称玫瑰红酸钾,主要用于合成树脂、杀虫杀菌剂等。某小组通过实验制备硫氰化钾,探究其性质,测定其含量。已知:
9. 硫氰化钾(KSCN)俗称玫瑰红酸钾,主要用于合成树脂、杀虫杀菌剂等。某小组通过实验制备硫氰化钾,探究其性质,测定其含量。已知:①NH3不溶于CS2 , CS2密度比水大且不溶于水;
②3NH3+CS2NH4SCN+NH4HS,该反应比较缓慢。NH4SCN、NH4HS和(NH4)2CO3的分解温度依次是170℃、105℃、58℃;
③SCN-+Ag+=AgSCN↓(白色)。
回答下列问题:
(1)、I.制备:在反应釜中加入固体催化剂与CS2 , 加压条件下通入氨气,水浴加热充分反应。加压的目的是、。
(2)、反应后将反应釜保持105℃一段时间,其目的是。(3)、适宜温度下向反应釜中滴入适量的K2CO3溶液,过滤。反应的化学方程式是。滤液继续进行的操作是减压、过滤、洗涤、干燥,得到硫氰化钾晶体。(4)、II.性质探究:向氯化亚铁溶液中滴加KSCN溶液,再滴加少量氯水,观察到的现象是 , 继续滴加氯水颜色先变深后消失,可推断出离子还原性的结论是。
(5)、III.含量测定:测定晶体中KSCN的含量(KSCN的摩尔质量为Mg/mol):取ag待测试样溶于蒸馏水配成250mL溶液;取25.00mL待测液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3作指示剂;用0.1000mol/LAgNO3标准溶液滴定至终点,平行滴定三次,平均消耗AgNO3标准溶液12mL。
晶体中KSCN的含量为%(用含a、M的代数式表示);若其它操作及读数均正确,下列操作会导致所测定KSCN的含量偏高的是(填字母)。
A.滴加AgNO3标准溶液时,滴加前仰视读数,滴加后俯视读数
B.滴加AgNO3标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
C.配制AgNO3标准溶液时,烧杯中的溶液有少量溅出
D.滴定过程中,将挂在锥形瓶壁上的AgNO3标准溶液用蒸馏水冲进瓶内
10. 绿水青山和金山银山绝不是对立的,关键在人,关键在思路。消除NOx、CO、SO2等大气污染物对建设美丽环境具有重要意义。(1)、工业上常用氨水吸收法处理尾气中的SO2 , 已知吸收过程中相关反应的热化学方程式如下:①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
(2)、工业上可将SO2和NO2混合转化,反应为SO2(g)+NO2(g)SO3(g)+NO(g) △H<0,进而制取硫酸。欲使该反应的速率增大且平衡逆向移动,改变的反应条件为。一定温度下,能判断该反应已达到化学平衡状态的是(填字母)。A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变
(3)、NO和NO2尾气可用碱液吸收,生成的可用电化学原理降解,原理如图所示,则阴极为(填a或b),电极反应式为。 (4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。
(4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。
 11. 三氧化二钴(Co2O3)常用于颜料、釉料及磁性材料。工业上以钴矿石(主要成分是CoO(OH)、CoCO3、CoO、Co2O3 , 及少量SiO2、Al2O3、Fe2O3、MnO2等)为原料制备Co2O3的工艺流程如图所示。
11. 三氧化二钴(Co2O3)常用于颜料、釉料及磁性材料。工业上以钴矿石(主要成分是CoO(OH)、CoCO3、CoO、Co2O3 , 及少量SiO2、Al2O3、Fe2O3、MnO2等)为原料制备Co2O3的工艺流程如图所示。 (1)、“浸泡”过程中,为加快反应速率和提高矿石原料利用率,下列方法不可取的是____。A、将钴矿石粉碎,搅拌 B、适当升高温度 C、适当降低溶液的pH D、使用过量的NaHSO3溶液(2)、“浸泡”时CoO(OH)参与反应的离子方程式为。(3)、“除杂”时加入试剂①的作用是;若溶液中c(Co2+)=0.1mol/L,根据表中数据计算,加入试剂②调节pH范围是6~(忽略过程中溶液体积变化)。
(1)、“浸泡”过程中,为加快反应速率和提高矿石原料利用率,下列方法不可取的是____。A、将钴矿石粉碎,搅拌 B、适当升高温度 C、适当降低溶液的pH D、使用过量的NaHSO3溶液(2)、“浸泡”时CoO(OH)参与反应的离子方程式为。(3)、“除杂”时加入试剂①的作用是;若溶液中c(Co2+)=0.1mol/L,根据表中数据计算,加入试剂②调节pH范围是6~(忽略过程中溶液体积变化)。沉淀
Al(OH)3
Fe(OH)3
Co(OH)2
Fe(OH)2
Mn(OH)2
沉淀完全的pH
5.2
3.2
9.4
9.5
10.1
(4)、“萃取”时发生反应:Co2++n(HA)2CoA2·(n-1)(HA)2+2H+ , 则试剂③为。设计萃取、反萃取的目的是。(5)、“沉钴”时的离子方程式为 , 证明Co2+已沉淀完全的实验操作和现象为。