上海市宝山区2022届高三模拟考试化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 乙醇汽油是在汽油中加入适量乙醇(C2H5OH)作为汽车燃料,乙醇属于( )A、氧化物 B、碱 C、无机物 D、有机物2. 下列我国科学家中,为化学理论做出重大贡献的是( )A、徐光宪(创立稀土萃取理论) B、屠呦呦(创制新的抗疟疾药) C、袁隆平(培育杂交水稻) D、于敏(提出氢弹构型理论)3. 我国科学家成功地研制出长期依赖进口、价格昂贵的物质O2 . 下列说法正确的是( )A、它是O2的同分异构体 B、它是O3的一种同素异形体 C、O2与O2互为同位素 D、1molO2分子中含有20mol电子4. 化学与生活生产密切相关。下列说法正确的是( )A、研究表明,新冠病毒可通过气溶胶传播,气溶胶的粒子直径大小在之间 B、84消毒液(含)与盐酸混合后消毒效果更佳 C、用生石灰作吸氧剂和干燥剂 D、采用“燃煤固硫”、“汽车尾气催化净化”等方法,提高了空气质量,使我们的生活环境更美好5. 在短周期元素中,原子最外电子层只有1个或2个电子的元素()A、是非金属元素 B、是稀有气体元素 C、是金属元素 D、无法确认为哪一类元素6. 下列表达方式或说法正确的是( )A、NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2 B、氯化铵的电子式:
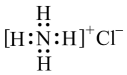 C、硫离子的核外电子排布式 1s22s22p63s23p4
D、基态到激发态产生的光谱是发射光谱
7. 下列有关σ键和π键的说法错误的是( )A、π键是原子轨道“肩并肩”方式重叠形成的共价键 B、当原子形成分子时,首先形成σ键,可能形成π键 C、σ键较π键稳定 D、苯分子中含有12个σ键和3个π键8. 下列实验装置能达到相应实验目的的是( )
C、硫离子的核外电子排布式 1s22s22p63s23p4
D、基态到激发态产生的光谱是发射光谱
7. 下列有关σ键和π键的说法错误的是( )A、π键是原子轨道“肩并肩”方式重叠形成的共价键 B、当原子形成分子时,首先形成σ键,可能形成π键 C、σ键较π键稳定 D、苯分子中含有12个σ键和3个π键8. 下列实验装置能达到相应实验目的的是( ) A、装置甲稀释浓硫酸 B、装置乙制备并检验SO2气体的性质 C、装置丙检查装置的气密性 D、装置丁收集NO9. 下列属于水解反应的是( )A、HCOOH+H2O⇌H3O++HCOO- B、+OH-⇌H2O+ C、SO2+H2O⇌+H+ D、+H2O⇌H2CO3+OH-10. 分析如表中各项的排布规律,有机物X是按此规律排布的第20项,下列有关X的组成、性质的说法中肯定错误的是( )
A、装置甲稀释浓硫酸 B、装置乙制备并检验SO2气体的性质 C、装置丙检查装置的气密性 D、装置丁收集NO9. 下列属于水解反应的是( )A、HCOOH+H2O⇌H3O++HCOO- B、+OH-⇌H2O+ C、SO2+H2O⇌+H+ D、+H2O⇌H2CO3+OH-10. 分析如表中各项的排布规律,有机物X是按此规律排布的第20项,下列有关X的组成、性质的说法中肯定错误的是( )1
2
3
4
5
6
7
8
①是戊酸、②是戊醇、③是乙酸丙酯、④一定能发生酯化反应、⑤一定能与钠反应。
A、①③④ B、②④⑤ C、②③④ D、②③⑤11. 下列关于工业生产过程的叙述正确的是( )A、联合制碱法中循环使用CO2和NH3 , 以提高原料利用率 B、硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 D、SO2在接触室被氧化成SO3 , SO3在吸收塔内被吸收制成浓硫酸12. 下列说法正确的是( )A、苯与溴水、酸性高锰酸钾溶液不反应,说明苯分子中碳碳原子间只存在单键 B、纤维素的水解和油脂的皂化反应都是由高分子生成小分子的过程 C、判断皂化反应是否完全可以用玻璃棒蘸取反应液滴到冷水中,若有油状液体说明皂化反应未完全 D、花生油能使酸性高锰酸钾溶液褪色13. 下列为除去括号内的杂质而选用的除杂试剂对应正确的是( )选项
主要物质(杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
H2O2
B
CO2(CO)
饱和NaHCO3溶液
C
Fe2O3(Al2O3)
NaOH溶液
D
Na2CO3固体(NaHCO3)
HCl溶液
A、A B、B C、C D、D14. 用惰性电极电解100mL4mol•L-1Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L。停止电解,向电解后的溶液中加入足量的铁粉,充分反应后溶液中的Fe2+浓度为(设溶液的体积不变)( )A、0.75mol•L-1 B、3mol•L-1 C、4mol•L-1 D、3.75mol•L-115. 在无色强酸性溶液中,下列各组离子能够大量共存的是( )A、Cl-、Na+、NO、Ca2+ B、NH、HCO、Cl-、K+ C、K+、Ba2+、Cl-、SO D、Cu2+、NH、I-、Cl-16. 反应4NH3+5O24NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol。在此时间内用NH3表示的化学反应速率为( )A、0.002mol·L-1·s-1 B、0.6mol·L-1·s-1 C、0.01mol·L-1·s-1 D、0.12mol·L-1·s-117. 某烃的结构简式为 , 若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( ) A、3、4、5 B、3、10、4 C、3、14、4 D、4、10、418. 下列实验不能达到目的的是( )
, 若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( ) A、3、4、5 B、3、10、4 C、3、14、4 D、4、10、418. 下列实验不能达到目的的是( )选项
目的
实验
A
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
B
加快氧气的生成速率
在过氧化氢溶液中加入少量
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
配制浓度为的溶液
称取固体4.0g,放入100容量瓶中,加水溶解并稀释至刻度
A、A B、B C、C D、D19. 化学与生活密切相关。下列叙述错误的是,( )A、碘酒可用于皮肤外用消毒 B、过氧乙酸( )溶液可用于环境消毒
C、84消毒液可用于消杀新型冠状病毒
D、硫酸铝可除去水体中的悬浮杂质并起到杀菌消毒的作用
20. 室温下,通过下列实验探究NaHC2O4(Kh为NaHC2O4水解平衡常数、Ka1、Ka2分别为H2C2O4第一、二步电离平衡常数)溶液的性质。
)溶液可用于环境消毒
C、84消毒液可用于消杀新型冠状病毒
D、硫酸铝可除去水体中的悬浮杂质并起到杀菌消毒的作用
20. 室温下,通过下列实验探究NaHC2O4(Kh为NaHC2O4水解平衡常数、Ka1、Ka2分别为H2C2O4第一、二步电离平衡常数)溶液的性质。实验
实验操作和现象
1
用试纸测定0.1mol·L-1NaHC2O4溶液的pH,测得约为5.5
2
向含0.1molNaHC2O4稀溶液中加入0.05molBa(OH)2 , 产生沉淀BaC2O4
3
向0.1mol·L-1NaHC2O4溶液中通入过量HCl,无现象
4
向0.1mol·L-1NaHC2O4溶液中通入一定量NH3 , 测得溶液pH=7
下列有关说法正确的是( )
A、实验1可知该条件下:Kh>Ka2 B、实验2反应静置后的上层清液中:c(Na+)>c(C2O)>c(HC2O)>c(OH-) C、实验3得到的溶液中:c(Na+)>c(Cl-)>c(H2C2O4)>c(H+) D、实验4所得的溶液中:c(NH)+c(H2C2O4)=c(C2O)21. 下列物质所属晶体类型分类正确的是( )选项
A
B
C
D
共价晶体
石墨
生石灰
碳化硅
金刚石
分子晶体
冰
固态氨
氯化铯
干冰
离子晶体
氮化铝
食盐
明矾
芒硝
金属晶体
铜
汞
铝
铁
A、A B、B C、C D、D二、综合题
-
22. [选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:(1)、镍元素基态原子的电子排布式为3d能级上的未成对电子数为。(2)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
氨的沸点(填“高于”或“低于”)膦(PH3),原因是
氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为。
(3)、单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1 , ICu>INi的原因是。(4)、某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为。
23. 根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:(1)、还原产物是。还原剂与还原产物的物质的量之比为。(2)、当有2 mol HNO3参加反应时,被氧化的物质质量为g。24. 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:。C(s)、CO(g)和完全燃烧的热化学方程式分别为:① ;
② ;
③ 。
试回答:
(1)、请你根据以上数据,写出C(s)与水蒸气反应生成CO和的热化学方程式:。(2)、比较反应热数据可知,和完全燃烧放出的热量之和,比完全燃烧放出的热量(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图
 (3)、请你写出、、、之间存在的关系式。(4)、乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。25. CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。(1)、I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
(3)、请你写出、、、之间存在的关系式。(4)、乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。25. CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。(1)、I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号) , 理由是。
 (2)、实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由反应产生。
(2)、实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由反应产生。综合以上分析,为抑制积炭产生,应选用高温、低压条件。
(3)、II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。该反应可以储能的原因是。
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
(4)、【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。序号
加热温度/℃
反应物气体流量/L·min-1
CH4/CO2
XCH4/%
ηchem/%
①
800
4
2:2
79.6
52.2
②
800
6
3:3
64.2
61.9
③
800
6
2:4
81.1
41.6
气体流量越大,CH4转化率越低,原因是:随着流量的提高,反应物预热吸热量增多,体系温度明显降低,。
(5)、对比实验(填序号),可得出结论:CH4/CO2越低,CH4转化率越高。(6)、对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是(该条件下设备的加热功率视为不变)。26. 某化学兴趣小组为探究二氧化硫的化学性质,他们采用下图装置进行有关实验。请回答下列问题: (1)、装置A中发生反应的化学方程式为。(2)、组成装置B的玻璃仪器有:导气管、广口瓶和。装置B的作用是贮存多余的气体,广口瓶内不能盛放的液体是(填字母)。
(1)、装置A中发生反应的化学方程式为。(2)、组成装置B的玻璃仪器有:导气管、广口瓶和。装置B的作用是贮存多余的气体,广口瓶内不能盛放的液体是(填字母)。a.水 b.浓硫酸 c.酸性KMnO4溶液 d. H2O2溶液
(3)、装置C中的现象是溶液红色褪去,该反应的离子方程式为。(4)、装置D中的现象是溶液红色褪去,其原因是。(5)、为进一步探究二氧化硫的化学性质,他们还设计了如图所示装置,图中a、b为止水夹,X溶液为紫色石蕊试液。实验操作如下:打开a、b,同时通入体积(同温同压)比为1:1的两种气体,则X中的现象为: , 反应的离子方程式为。 27. 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。(1)、I.碳酸亚铁的制备(装置如下图所示)
27. 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。(1)、I.碳酸亚铁的制备(装置如下图所示)
仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
(2)、接下来要使仪器C中的制备反应发生,需要进行的操作是 , 该反应产生一种常见气体,写出反应的离子方程式。(3)、仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是。(4)、Ⅱ.乳酸亚铁的制备及铁元素含量测定向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)、两位同学分别用不同的方案进行铁元素含量测定:①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液 , 即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
28. 喹啉类有机物X可用于制取医药、燃料、杀虫剂等,它的一种合成路线如下:
已知:① +
②

完成下列填空:
(1)、A无支链,A官能团的名称是;A生成B的化学方程式为:。(2)、的反应类型:反应。(3)、W是C的同分异构体,写出两种属于不同类有机物的W的结构简式。(4)、与溶液反应时,最多消耗。(5)、P能发生银镜反应,写出P的结构简式。(6)、利用已学知识和本题中的信息,写出以乙烯为原料合成A的路线(无机试剂任用)。(合成路线的表示方法为:甲乙……目标产物)