吉林省长春市2022届高三上学期化学第一次质量监测
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是( )A、自来水厂常用明矾、O3、ClO2等做水处理剂,其作用都是杀菌消毒 B、食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 C、华为自主研发的“麒麟”芯片与太阳能电池感光板所用材料均为晶体硅 D、用于制造“山东舰”上舰载机降落拦阻索的特种钢,属于新型无机非金属材料2. 下列表示正确的是( )A、含8个中子的氧原子的核素符号: B、CH4分子的球棍模型:
 C、K+离子的结构示意图:
C、K+离子的结构示意图: D、二氧化碳的电子式:
D、二氧化碳的电子式: 3. 阿伏加德罗常数的值为NA。下列说法正确的是( )A、标准状况下,2.24LCl2完全溶于水转移电子数目为0.2NA B、标准状况下,11.2L丙烷中含有的极性键数目为4NA C、将0.1mol FeCl3水解制成胶体,所得胶体粒子数目为0.1NA D、0.1mol NaHSO4固体中含有的阳离子数目为0.2NA4. 下列关于有机物说法正确的是( )
3. 阿伏加德罗常数的值为NA。下列说法正确的是( )A、标准状况下,2.24LCl2完全溶于水转移电子数目为0.2NA B、标准状况下,11.2L丙烷中含有的极性键数目为4NA C、将0.1mol FeCl3水解制成胶体,所得胶体粒子数目为0.1NA D、0.1mol NaHSO4固体中含有的阳离子数目为0.2NA4. 下列关于有机物说法正确的是( )①理论上1mol苯和1mol甲苯均能与3molH2发生加成反应;
②用灼烧的方法可以区别蚕丝和棉花;
③油脂水解可得到氨基酸和甘油;
④纤维素和淀粉都是多糖,二者互为同分异构体;
⑤多糖和蛋白质在一定条件下都能水解;
⑥乙醇中是否含水,可用金属钠来检测
A、①②⑤ B、①②⑥ C、②⑤⑥ D、④⑤⑥5. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、c(Al3+)=0.5mol/L的溶液中:K+、、、 B、在c(H+)∶c(OH-)=1∶1012的溶液中:Na+、I-、、 C、含有0.1mol/LFe3+的溶液中:K+、Mg2+、I-、 D、能溶解Al(OH)3的溶液中:、K+、、6. 以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法正确的是( ) A、a为铅蓄电池的正极 B、电解过程中,阳极区溶液中c(H+)逐渐减小 C、阴极反应式: D、每生成1mol乙烯,理论上铅蓄电池中消耗6molH2SO47. 下列关于如图所示转化关系(X代表卤素),说法正确的是( )
A、a为铅蓄电池的正极 B、电解过程中,阳极区溶液中c(H+)逐渐减小 C、阴极反应式: D、每生成1mol乙烯,理论上铅蓄电池中消耗6molH2SO47. 下列关于如图所示转化关系(X代表卤素),说法正确的是( )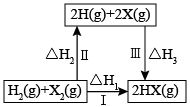 A、 <0 B、生成HX(g)的反应热与途径有关,所以 C、若X分别表示Cl、Br、I,则过程Ⅲ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则K1>K38. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
A、 <0 B、生成HX(g)的反应热与途径有关,所以 C、若X分别表示Cl、Br、I,则过程Ⅲ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则K1>K38. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( ) A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体9. 反应在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A、保持容器体积不变,增加H2O(g)的量 B、保持容器体积不变,充入氦气使体系压强增大 C、将容器的体积缩小一半 D、保持容器压强不变,充入氦气使容器体积变大10. 下列实验的现象与对应结论均正确的是( )
A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体9. 反应在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A、保持容器体积不变,增加H2O(g)的量 B、保持容器体积不变,充入氦气使体系压强增大 C、将容器的体积缩小一半 D、保持容器压强不变,充入氦气使容器体积变大10. 下列实验的现象与对应结论均正确的是( )选项
操作
现象
结论
A
往蓝色石蕊试纸上滴几滴新制饱和氯水
试纸先变红后褪色
新制氯水既有酸性,又有漂白性
B
向CaCl2溶液中通入少量CO2
溶液中出现白色沉淀
Ca2+与不能大量共存
C
取少量NH4Cl固体于试管底部,加热试管底部
试管口处有晶体出现
NH4Cl易升华
D
往少量酸性KMnO4溶液中通入SO2
溶液褪色
SO2有漂白性
A、A B、B C、C D、D11. X、Y、Z、W、M均为短周期主族元素,X、Y同周期,Z、W、M也处于同一周期,Y是形成化合物种类最多的元素,M为短周期中除稀有气体元素外原子半径最大的元素,X、Y原子最外层电子数之和等于Z、W原子最外层电子数之和,X、W的简单离子X2-、W3+具有相同的电子层结构。下列说法正确的是( )A、Y最高价氧化物对应的水化物为强酸 B、原子半径大小顺序为:M>W>X>Y>Z C、水溶液中Z的单核离子能促进水的电离 D、简单氢化物的沸点:X>Y12. 工业制硫酸的接触室中发生反应:。该反应在500℃和催化剂存在下进行,下列有关说法正确的是( )A、如果使氧气过量,并给足够时间让反应充分进行,SO2可以全部转化为SO3 B、该反应的平衡常数(K)随体系压强的增加而增大 C、该反应选择在500℃和催化剂存在下进行,因此该反应是吸热反应 D、反应达到化学平衡后,只改变温度,化学平衡一定会被破坏13. 白屈菜有止痛、止咳等功效,但又称为“断肠草”,有很强的毒性,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中错误的是( ) A、分子中含有羧基、羰基和醚键 B、分子式是C7H6O6 C、能发生加成反应和酯化反应 D、1mol白屈菜酸最多能与2molNaHCO3发生反应14. 常温下,向1L浓度为0.1mol/LHA溶液中逐渐加入NaOH固体的过程中,主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化如图所示。忽略过程中溶液体积的变化,下列说法错误的是( )
A、分子中含有羧基、羰基和醚键 B、分子式是C7H6O6 C、能发生加成反应和酯化反应 D、1mol白屈菜酸最多能与2molNaHCO3发生反应14. 常温下,向1L浓度为0.1mol/LHA溶液中逐渐加入NaOH固体的过程中,主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化如图所示。忽略过程中溶液体积的变化,下列说法错误的是( ) A、HA的电离常数的数量级为10-5 B、pH=5.6时,溶液中 C、加入NaOH固体的质量为2.0g时,溶液的pH>7 D、pH=7时,溶液中c(Na+)=c(A-)
A、HA的电离常数的数量级为10-5 B、pH=5.6时,溶液中 C、加入NaOH固体的质量为2.0g时,溶液的pH>7 D、pH=7时,溶液中c(Na+)=c(A-)二、综合题
-
15. 碳酸镧La2(CO3)3(Mr=458)可用于治疗高磷酸盐血症,它为白色粉末、难溶于水、分解温度900℃,在溶液中制备时,形成水合碳酸镧La2(CO3)3·xH2O,如果溶液碱性太强,易生成受热分解的碱式碳酸镧La(OH)CO3。回答下列问题:(1)、Ⅰ.用如图装置模拟制备水合碳酸镧:

仪器A的名称为。
(2)、装置接口的连接顺序为a→→→→→f。(3)、连接仪器之后,添加药品之前的操作为。(4)、Z中通入CO2应过量的原因是。(5)、Ⅱ.某实验小组通过以下实验验证制得的样品中是否含La(OH)CO3 , 将石英玻璃A管称重,记为m1g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g,将装有试剂的装置C称重,记为m3g。按图示连接好装置进行实验。
实验步骤:
①打开K1、K2和K3 , 关闭K4 , 缓缓通入干燥的N2;
②数分钟后关闭K1、K3 , 打开K4 , 点燃酒精喷灯(酒精喷灯灯焰温度可达1000℃),加热A中样品;
③一段时间后,熄灭酒精喷灯,打开K1 , 通入N2数分钟后关闭K1和K2 , 冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
装置B中的试剂为(写名称)。
(6)、装置D的作用为。(7)、根据实验记录,当=时,说明制得的样品中不含有La(OH)CO3。16. 硼砂的化学式为。利用硼镁矿(主要成分为)制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)、硼镁矿加入NaOH溶液后过滤得到的滤渣的主要成分为。(2)、硼砂中B的化合价为 , 溶于热水后,常用稀H2SO4调pH=2~3得到H3BO3 , 该反应的离子方程式为。(3)、需要在HCl氛围中加热,其目的是。(4)、Mg—H2O2酸性电池的反应机理为。则该电池的正极反应式为:;常温下,当电路中通过的电子的物质的量为0.08mol时,溶液的pH=6,此时(填“有”或“无”)Mg(OH)2沉淀析出。(已知①Ksp[Mg(OH)2]=5.6×10-12;②电解质溶液的体积为1L,忽略电解前后溶液体积的变化)(5)、制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol/LNa2S2O3(强碱弱酸盐)溶液滴定至终点,消耗Na2S2O3溶液16.00mL。盛装Na2S2O3溶液的仪器应为(填“酸式”或“碱式”)滴定管。该粗硼样品的纯度为(提示:)。17. 根据题意回答有关氮的化合物的问题:(1)、随着人类社会的发展,氮氧化物的排放导致一系列问题。NO2形成硝酸型酸雨的化学方程式为。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则 =。
(2)、肼(N2H4)可以用作燃料电池的原料。肼的电子式为;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的极(填“正”或“负”),a电极的电极反应式为。 (3)、可逆反应: 。
(3)、可逆反应: 。
①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“”或“”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
18. 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:(1)、Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:。(2)、与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是。(3)、氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有(填字母)。A.离子键 B.金属键 C.氢键 D.配位键
(4)、F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为、 , BF3的空间构型是 , H3O+的空间构型是。(5)、I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为 , 已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值) 19. 气态烃X是一种基本化工原料,可催熟水果,其产量可以用来衡量一个国家的石油化工发展水平。用X合成一种化工产品Y(2-苄基-1,3-二氧戊环)的具体合成路线如图(部分反应条件略去):
19. 气态烃X是一种基本化工原料,可催熟水果,其产量可以用来衡量一个国家的石油化工发展水平。用X合成一种化工产品Y(2-苄基-1,3-二氧戊环)的具体合成路线如图(部分反应条件略去):
已知:①+2R'OH→2ROH+;
②C为能与金属钠反应的芳香族化合物。
回答下列问题:
(1)、X中官能团名称是;B的化学名称是。(2)、A的结构简式为;产品Y的分子式为。(3)、下列有关B的说法正确的是(填字母)。a.易溶于水b.分子中所有原子可能在同一平面
c.与乙醇互为同系物d.在一定条件下能发生消去反应生成乙炔
(4)、反应④的化学方程式为。(5)、反应⑤的反应类型为。(6)、写出满足下列条件的苯乙醛的同分异构体的结构简式:。i.含有苯环;
ii.加入FeCl3溶液显紫色;
iii.核磁共振氢谱有5组峰,峰面积之比为。