四川省巴中市2023届高三上学期零诊考试理综化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 化学与生活、生产息息相关,下列叙述错误的是( )A、用于3D打印材料的光敏树脂是高聚物,高聚物都是混合物 B、铝合金的硬度较大、密度较小、抗腐蚀能力较强,因此高铁车厢的大部分材料选用铝合金 C、市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤 D、医疗上常用碳酸钠治疗胃酸过多2. 手性碳是指连接4个不同的原子或基团的碳原子。北京冬奥会在场馆建设中用到的一种耐腐蚀、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示,下列说法正确的是( )
 A、1mol 该物质最多能和2mol H2发生加成反应 B、该双烯环酯分子中有3个手性碳原子 C、该分子中所有原子可能共平面 D、该有机物的分子式为C14H18O23. NA为阿伏加德罗常数的值,下 列说法正确的是( )A、1mol D2O比1mol H2O多NA个质子 B、密闭容器中,2mol SO2和 1mol O2发生催化反应后分子总数小于2NA C、20g 异戊烷和38g新戊烷的混合物中共价键的数目为16NA D、C2H4和C2H6O混合气体2.24L,完全燃烧,消耗O2的体积一定为6.72L4. 下列离子方程式正确的是( )A、向硅酸钠溶液中通入过量二氧化碳: SiO+ 2CO2+ 2H2O = H2SiO3↓+2HCO B、工业上制漂白粉: Cl2+ 2OH- =Cl-+ ClO-+ H2O C、明矾溶液与过量氨水混合: Al3++ 4NH3+ 2H2O = AlO+4NH D、硫化钠溶液与氯化铁溶液反应: 2Fe3+ +3S2-= Fe2S35. 世界资源储量最大的滑石矿位于江西上饶,经分析发现滑石中含有4种短周期元素W、X、Y、Z,它们的原子序数依次增大,最外层电子数之和为13,且位于不同的主族,X的某种单质被喻为“地球的保护伞”,W2X2分子中含有18个电子,下列说法正确的是( )A、原子半径大小顺序为Z>Y>X>W B、化合物YX是一种很好的耐火材料 C、Y单质只能与空气中的主要成分氧气反应 D、Z的氧化物的水化物的酸性强于碳酸6. 下列实验操作规范且能达到实验目的的是( )
A、1mol 该物质最多能和2mol H2发生加成反应 B、该双烯环酯分子中有3个手性碳原子 C、该分子中所有原子可能共平面 D、该有机物的分子式为C14H18O23. NA为阿伏加德罗常数的值,下 列说法正确的是( )A、1mol D2O比1mol H2O多NA个质子 B、密闭容器中,2mol SO2和 1mol O2发生催化反应后分子总数小于2NA C、20g 异戊烷和38g新戊烷的混合物中共价键的数目为16NA D、C2H4和C2H6O混合气体2.24L,完全燃烧,消耗O2的体积一定为6.72L4. 下列离子方程式正确的是( )A、向硅酸钠溶液中通入过量二氧化碳: SiO+ 2CO2+ 2H2O = H2SiO3↓+2HCO B、工业上制漂白粉: Cl2+ 2OH- =Cl-+ ClO-+ H2O C、明矾溶液与过量氨水混合: Al3++ 4NH3+ 2H2O = AlO+4NH D、硫化钠溶液与氯化铁溶液反应: 2Fe3+ +3S2-= Fe2S35. 世界资源储量最大的滑石矿位于江西上饶,经分析发现滑石中含有4种短周期元素W、X、Y、Z,它们的原子序数依次增大,最外层电子数之和为13,且位于不同的主族,X的某种单质被喻为“地球的保护伞”,W2X2分子中含有18个电子,下列说法正确的是( )A、原子半径大小顺序为Z>Y>X>W B、化合物YX是一种很好的耐火材料 C、Y单质只能与空气中的主要成分氧气反应 D、Z的氧化物的水化物的酸性强于碳酸6. 下列实验操作规范且能达到实验目的的是( )选项
A
B
C
D
操作


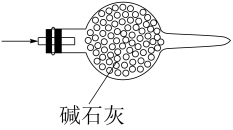

实验目的
混合浓硫酸和乙醇
定容
干燥
分离碘和酒精
A、A B、B C、C D、D7. 下图为最新研制的一款车载双电极镍氢电池,放电时a、c电极的反应物为吸附了氢气的稀土合金,可表示为MH;充电时b、d电极的反应物为吸附的Ni(OH)2 , 下列叙述正确的是( ) A、放电时电子的流动路径为: a→外电路→d→c→铜箔→b B、放电时c极上的反应可表示为: MH-e- + OH-= M+H2O C、充电时a、b接电源的负极,c、d接电源的正极 D、充电时外电路每通过2mol电子,该电池正极共增重4g
A、放电时电子的流动路径为: a→外电路→d→c→铜箔→b B、放电时c极上的反应可表示为: MH-e- + OH-= M+H2O C、充电时a、b接电源的负极,c、d接电源的正极 D、充电时外电路每通过2mol电子,该电池正极共增重4g二、非选择题
-
8. 利用Cl2氧化绿色K2MnO4浓强碱溶液制备KMnO4的装置如下图所示(加热、夹持装置略):
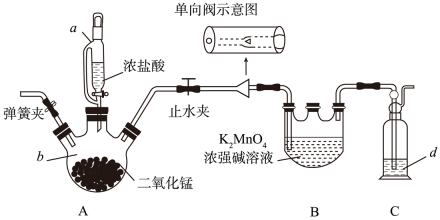 (1)、仪器b的名称为 , d中的溶液是。实验开始前向仪器a中加入水,盖好玻璃塞,关闭止水夹和弹簧夹,打开仪器a玻璃旋塞向b中滴加水,一段时间后看水能不能滴下,此操作(填“能”或“不能”)检验装置的气密性。(2)、装置B中Cl2氧化K2MnO4的化学方程式为。(3)、单向阀的作用是 , 当仪器B中即停止通氯气。(4)、当B中反应结束,后续操作是熄灭A处酒精灯,待冷却后拆除装置。(5)、锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: +MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。(6)、某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2+ 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
(1)、仪器b的名称为 , d中的溶液是。实验开始前向仪器a中加入水,盖好玻璃塞,关闭止水夹和弹簧夹,打开仪器a玻璃旋塞向b中滴加水,一段时间后看水能不能滴下,此操作(填“能”或“不能”)检验装置的气密性。(2)、装置B中Cl2氧化K2MnO4的化学方程式为。(3)、单向阀的作用是 , 当仪器B中即停止通氯气。(4)、当B中反应结束,后续操作是熄灭A处酒精灯,待冷却后拆除装置。(5)、锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: +MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。(6)、某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2+ 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:第一次
第二次
第三次
第四次
17.30
17.90
18.00
18.10
计算试样中过氧化氢的浓度为mol·L-1 .
9. 我国稀土资源丰富,其中二氧化铈(CeO2) 是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为CeCO3F)制备CeO2的工艺流程如下: (1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有 ( 写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、、。(4)、上述流程中 盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性: CeO2 H2O2 (填“>”或“<”)。(5)、写出“沉铈”过程中的离子反应方程式。
(1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有 ( 写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、、。(4)、上述流程中 盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性: CeO2 H2O2 (填“>”或“<”)。(5)、写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1 , 此时溶液的pH为5,则溶液中c()= mol·L-1 (保留2位有效数字)。
已知常温下:
(6)、Ce4+溶 液可以吸收大气中的污染物NOx , 减少空气污染,其转化过程如图所示(以NO2为例)。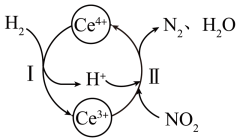
①该反应中的催化剂为(写离子符号);
②该转化过程中还原剂与氧化剂物质的量之比为。
10. 处理、回收利用CO是环境科学研究的热点课题。回答下列问题:(1)、CO用于处理大气污染物N2O的反应为CO(g) + N2O(g)CO2(g) +N2(g)。在Zn*作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应: CO(g) + N2O(g) CO2(g) + N2(g) ∆H= kJ·mol-1; 该总反应的决速步是反应 (填 “①"或“②”),该判断的理由是 .
(2)、已知: CO(g) + N2O(g)CO2(g) + N2(g)的速率方程为v=k·c(N2O), k为速率常数,只与温度有关。为提高反应速率,可采取的措施是____ (填字母序号)。A、升温 B、恒容时,再充入CO C、恒压时,再充入N2O D、恒压时,再充入N2(3)、在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与的变化曲线以及在时N2O的转化率与的变化曲线如图3所示: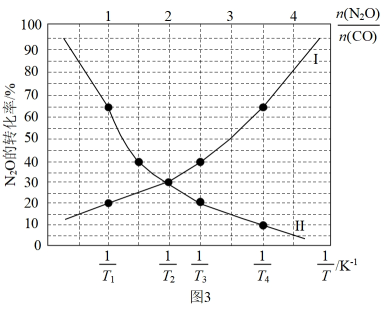
①表示N2O的转化率随的变化曲线为曲线(填“I”或“II”);
②T1T2 (填“>”或“<"),该判断的理由是
③已知:该反应的标准平衡常数 , 其中为标准压强 (100kPa),p(CO2)、p(N2)、 p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数= ( 计算结果保留两位有效数字,p分=p总 ×物质的量分数)。
11. Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:(1)、Fe元素属于元素周期表的 区(填分区)(2)、基态Ni2+核外电子排布式为。(3)、鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
①组成M的5中元素中,除H元素外,另外4种元素第一电离能由大到小的顺序为(填元素符号),其中C原子的杂化类型为。
②图中各微粒不存在的作用力有 ( 填标号)
a. 极性键 b.非极性键 c. 配位键
d. π键 e.离子键 f.氢键
(4)、一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图乙所示。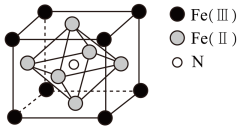
①铁氮化合物的化学式为。
②在该晶胞结构的另一种表示中,N处于顶点位置,则铁处于、位置
③若该化合物密度为pg·cm-3 , 用NA表示阿伏加德罗常数,则由Fe( II )构成的正八面体的体积为cm3
12. 奴佛卡因H是口腔科局部麻醉药,某兴趣小组以甲苯和乙烯为主要原料,采用以下合成路线进行制备。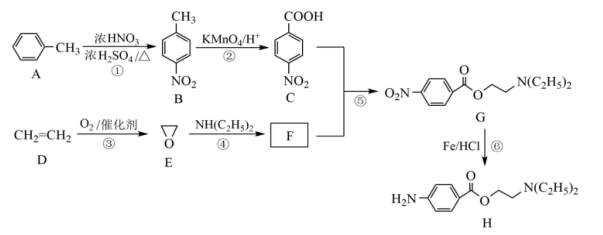
已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
请回答下列问题:
(1)、A的名称 , C中官能团的名称。(2)、F的结构简式 , 反应⑤的反应条件。(3)、下列有关反应的说法正确的是:____。(填标号)A、步骤①和②可以互换 B、步骤①→⑤共有2个取代反应 C、E中所有原子处于同一平面 D、1 mol H物质最多和4 mol氢气发生加成反应(4)、写出A→B的反应方程式。(5)、写出两种同时符合下列条件的B的同分异构体、。①红外光谱检测分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(6)、参照上述路线,写出以苯和 为原料制取的合成
为原料制取的合成 路线图。
路线图。