广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 中华文化源远流长、博大精深,广东省馆藏文物是中华文化的重要代表。下列文物主要是由金属材料制成的是( )
文物




鎏金高士图银杯
南宋德化窑青白釉撇口瓶
明代象牙雕寿星
战国青瓷罐
选项
A
B
C
D
A、A B、B C、C D、D2. 化学与科技、生产、生活密切相关。下列说法错误的是( )A、使用可降解的聚碳酸酯塑料有利于减少白色污染 B、采用风能、太阳能等洁净能源发电,有利于实现碳中和 C、研究合适的催化剂可减少汽车尾气中有害气体的排放 D、将废旧重金属盐的废液深度掩埋会减少环境污染3. 作为广东文化的代表之一,岭南文化历史悠久。下列岭南文化内容中蕴含的化学知识描述错误的是( )选项
文化类别
文化内容
化学知识
A
饮食文化
早茶文化中的叉烧包
叉烧包中富含糖类、油脂、蛋白质等营养物质
B
嫁娶文化
婚礼流程中“敬茶”环节所用陶瓷茶具
陶瓷茶具的主要成分为硅酸盐
C
服饰文化
“丝中贵族”香云纱
鉴别丝和棉花可以用灼烧的方法
D
节日文化
烟花舞龙
烟花利用了“焰色试验”原理,该原理属于化学变化
A、A B、B C、C D、D4. 亚铁氰化铁又名普鲁士蓝,化学式为 , 是一种配位化合物,可以用来上釉、用作油画染料等。下列有关普鲁士蓝构成微粒的符号表征正确的是( )A、基态的价电子排布图为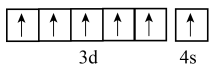 B、氮原子的结构示意图为
B、氮原子的结构示意图为 C、的电子式为
D、阴离子的结构式为
C、的电子式为
D、阴离子的结构式为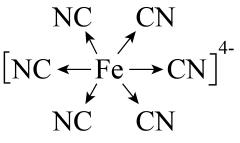 5. 部分含硫物质的分类与相应化合价及部分物质间转化关系如图所示。下列说法不正确的是( )
5. 部分含硫物质的分类与相应化合价及部分物质间转化关系如图所示。下列说法不正确的是( ) A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存6. 下列实验装置及操作均合理的是( )
A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存6. 下列实验装置及操作均合理的是( ) A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热7. 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是( )
A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热7. 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
厨房帮厨:炒菜时,时常会添加料酒
将乙醇氧化为可调昧的乙酸
B
工厂消毒:向各个办公场所喷洒“84”消毒液
NaClO具有强氧化性,能使蛋白质变性杀灭病毒
C
社区服务:用泡沫灭火器演练如何灭火
铝离子与碳酸氢根离子在溶液中相互促进水解
D
自主探究:锌、铜和柠檬为原料制作水果电池
锌能与柠檬中酸性物质发生氧化还原反应
A、A B、B C、C D、D8. 已知X、Y、Z、W、M为原子序数依次递增的短周期元素,其中X、Y、Z元素同周期, Y与W元素同主族,它们可以形成一种重要化合物甲。其结构如图所示。下列说法正确的是( ) A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp29. 某实验小组利用下图装置进行实验。下列说法错误的是( )
A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp29. 某实验小组利用下图装置进行实验。下列说法错误的是( ) A、滴加浓盐酸时需将分液漏斗上端玻璃塞上的凹槽对准漏斗上的小孔 B、蘸有淀粉KI溶液的棉花变蓝,说明氯气的氧化性强于碘 C、蘸有品红溶液的棉花褪色,说明氯气具有漂白性 D、蘸有紫色石蕊溶液的棉花上出现的现象是棉花先变红后褪色10. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A、滴加浓盐酸时需将分液漏斗上端玻璃塞上的凹槽对准漏斗上的小孔 B、蘸有淀粉KI溶液的棉花变蓝,说明氯气的氧化性强于碘 C、蘸有品红溶液的棉花褪色,说明氯气具有漂白性 D、蘸有紫色石蕊溶液的棉花上出现的现象是棉花先变红后褪色10. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( ) A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率11. 下列关于HF、、的说法错误的是( )A、HF、、都是由极性键形成的极性分子 B、HF、、中共价键键长逐渐增大,键能逐渐减小 C、、的中心原子杂化方式相同 D、比HF的沸点高是由于HF分子间不能形成氢键12. 工业上制备硝酸过程中涉及反应: 。某实验小组测得不同条件下反应平衡时的体积分数变化如下图(图中X、Y分别代表温度或压强),下列说法错误的是( )
A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率11. 下列关于HF、、的说法错误的是( )A、HF、、都是由极性键形成的极性分子 B、HF、、中共价键键长逐渐增大,键能逐渐减小 C、、的中心原子杂化方式相同 D、比HF的沸点高是由于HF分子间不能形成氢键12. 工业上制备硝酸过程中涉及反应: 。某实验小组测得不同条件下反应平衡时的体积分数变化如下图(图中X、Y分别代表温度或压强),下列说法错误的是( )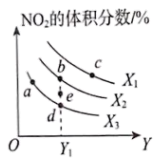 A、图中X表示温度,Y表示压强 B、 C、对应条件下的平衡常数:a>b>c D、、条件下,e点对应状态时v(逆)>v(正)13. 由下列实验及现象推出的相应结论正确的是( )
A、图中X表示温度,Y表示压强 B、 C、对应条件下的平衡常数:a>b>c D、、条件下,e点对应状态时v(逆)>v(正)13. 由下列实验及现象推出的相应结论正确的是( )选项
实验
现象
结论
A
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐属于无碘盐
B
将某硝酸亚铁溶液用盐酸酸化,并滴加少量KSCN溶液
溶液变红
该硝酸亚铁溶液已变质
C
用热碳酸钠溶液清洗铁钉表面上油垢
油垢无明显变化
该油垢的主要成分不是动、植物油脂
D
将新制的氢氧化铜悬浊液与某饮品混合,加热
未出现砖红色沉淀
该饮品不含糖
A、A B、B C、C D、D14. 宏观辨识与微观探析是化学学科核心素养之一、下列关于含N化合物的物质性质实验对应的反应方程式书写错误的是( )A、将过量氨气通入氯化铝溶液中: B、用浓氨水检验氯气管道是否泄漏: C、温度升高气体颜色加深: D、溶液显碱性:15. 常温下,将溶液滴加到20mL二元弱酸溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述错误的是( ) A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a16. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( )
A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a16. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( ) A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu
A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu二、综合题
-
17. 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。(1)、I.配制KI溶液
配制500mL的KI溶液,需要称取KI的质量为g。
(2)、下列关于配制KI溶液的操作错误的是____(填序号)。A、 B、
B、 C、
C、 D、
D、 (3)、II.探究不同条件下空气中氧气氧化KI的速率。
(3)、II.探究不同条件下空气中氧气氧化KI的速率。组别
温度
KI溶液
溶液
蒸馏水
淀粉溶液
c(KI)
V
V
1
298K
5mL
5mL
10mL
3滴
2
313K
mL
5mL
10mL
3滴
3
298K
10mL
5mL
5mL
3滴
酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
(4)、通过实验组别1和组别2探究温度对氧化速率的影响。其中a= , b=。(5)、设计实验组别3的目的是。(6)、III.探究反应“”为可逆反应。试剂:KI溶液,溶液,淀粉溶液,溶液,KSCN溶液。实验如下:

甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为;乙同学认为该现象无法证明该反应为可逆反应,原因为。
(7)、请选择上述试剂重新设计实验,证明该反应为可逆反应:。18. 钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
已知:I.放电时负极的电极反应式为;
II.常温下, , 当溶液中某离子浓度低于时,认为该离子已沉淀完全。
回答下列问题:
(1)、废旧电池放电处理的原因为。(2)、“碱浸”时发生的化学反应方程式为。(3)、已知中的铁为+3价,则“酸溶”时主要反应的离子方程式为;该工序中温度需控制在40℃的原因为。(4)、若最终调节pH=3,则所得母液中的(填“已”或“未”)沉淀完全。(5)、实验室中从“反萃取”所得混合液中分离出溶液的操作名称为。(6)、废旧钾离子电池放电处理并拆解后,从负极得到石墨,其结构如图。石墨两层之间最近碳原子间距远大于层内最近碳原子间距的原因为;设阿伏加德罗常数的值为 , 则石墨晶体密度为(列式即可)。 19. 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。
19. 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。反应i:
反应ii:
回答下列问题:
(1)、反应: △H3=。(2)、在刚性绝热容器中发生反应i,下列能说明已达到平衡状态的有____(填标号)。A、每断裂1 mol O=O键,同时生成4 molO-H键 B、容器内温度不再变化 C、混合气体的密度不再变化 D、n(C3H8)=n(C3H6)(3)、在压强恒定为100 kPa条件下,按起始投料n(C3H8):n(O2)=2:1,匀速通入装有催化剂的反应器中发生反应i和反应ii,其中不同温度下丙烷和氧气的转化率如图。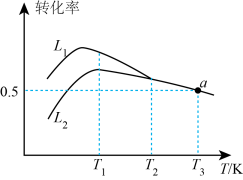
①线(填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1K后曲线L2随温度升高而降低的原因为。
③当温度高于(填“T1”或“T2”)时,可判断反应ii不再发生,a点对应的温度下,丙烯的分压p(C3H6)=kPa(保留3位有效数字,下同),反应i的平衡常数。(已知:分压p分=总压×该组分物质的量分数,对于反应 , , 其中、、、为反应平衡时各组分的分压)
(4)、丙烷在碳纳米材料上脱氢的反应机理如图。
已知三步反应的活化能:反应I>反应III>反应II。则催化过程的决速反应为(填“反应I”“反应II”或“反应III”)。
20. 有机物H是一种新型药物的合成中间体。其一种合成路线如下图所示:
回答下列问题:
(1)、C的化学式为 , D中含氧官能团的名称为。(2)、D→E的化学方程式为 , 其反应类型为。(3)、设计D→E和F→G两步反应的目的为。(4)、H中手性碳原子的数目为。(5)、化合物M比C在组成上多1个 , 则同时满足下列条件的M有种,写出一种核磁共振氢谱有2组峰的结构简式。I.M为芳香类化合物;
II.只含有一种官能团;
III.能发生银镜反应。
(6)、参照上述合成路线,设计以1,4-丁二醇和苯胺(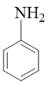 )为原料制备
)为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。