安徽省池州市2022届高三下学期4月联考理综化学试题
试卷更新日期:2022-09-19 类型:高考模拟
一、单选题
-
1. 用化学用语表示2H2S+3O22SO2+2H2O中的相关微粒,其中正确的是( )A、H2O的比例模型为
 B、N2的电子式
B、N2的电子式 C、中子数为18的硫原子为34S
D、S2-的结构示意图为
C、中子数为18的硫原子为34S
D、S2-的结构示意图为 2. 联二没食子酸内酯(EA)是一种芳香类化合物,可用于制抗乙肝药物,其球棍模型如图。下列关于EA的说法正确的是( )
2. 联二没食子酸内酯(EA)是一种芳香类化合物,可用于制抗乙肝药物,其球棍模型如图。下列关于EA的说法正确的是( ) A、分子中有6个氧原子 B、含有2种官能团 C、不能与H2发生加成反应 D、能与NaHCO3溶液反应生成CO23. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1molNa和足量O2反应,生成Na2O和Na2O2的混合物,转移电子数为2NA B、46gNO2和N2O4的混合气体中所含原子数大于3NA C、1molH2O最多可以形成的氢键数为2NA D、1mol·L-1的氢氧化钠溶液含有的阴离子数为NA4. 下列离子方程式书写正确的是( )A、向NH4HSO4溶液中滴加少量NaOH溶液:+OH-=NH3·H2O B、向漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=+HClO C、向CaSO4沉淀中滴加饱和Na2CO3溶液:Ca2++=CaCO3↓ D、H2S气体通入到CuSO4溶液中:H2S+Cu2+=CuS↓+2H+5. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( )
A、分子中有6个氧原子 B、含有2种官能团 C、不能与H2发生加成反应 D、能与NaHCO3溶液反应生成CO23. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1molNa和足量O2反应,生成Na2O和Na2O2的混合物,转移电子数为2NA B、46gNO2和N2O4的混合气体中所含原子数大于3NA C、1molH2O最多可以形成的氢键数为2NA D、1mol·L-1的氢氧化钠溶液含有的阴离子数为NA4. 下列离子方程式书写正确的是( )A、向NH4HSO4溶液中滴加少量NaOH溶液:+OH-=NH3·H2O B、向漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=+HClO C、向CaSO4沉淀中滴加饱和Na2CO3溶液:Ca2++=CaCO3↓ D、H2S气体通入到CuSO4溶液中:H2S+Cu2+=CuS↓+2H+5. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( ) A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH6. 下列实验装置能达到实验目的的是( )
A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH6. 下列实验装置能达到实验目的的是( ) A、图I:收集NO B、图II:分离戊烷同分异构体 C、图III:实验室制氯气 D、图IV:制备无水氯化铁7. 常温下,向20mL0.1000mol·L-1NaB溶液中滴加等浓度的弱酸HA溶液,所得混合溶液中lg与1g的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是( )
A、图I:收集NO B、图II:分离戊烷同分异构体 C、图III:实验室制氯气 D、图IV:制备无水氯化铁7. 常温下,向20mL0.1000mol·L-1NaB溶液中滴加等浓度的弱酸HA溶液,所得混合溶液中lg与1g的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是( ) A、Ka(HB)>Ka(HA) B、pH=4时,的值比pH=3的大 C、滴入20mLHA溶液后存在关系:c(A-)>c(HB) D、pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-)
A、Ka(HB)>Ka(HA) B、pH=4时,的值比pH=3的大 C、滴入20mLHA溶液后存在关系:c(A-)>c(HB) D、pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-)二、综合题
-
8. 利用铝锂钴废料(主要成分为Co3O4 , 还含有少量铝箔、LiCoO2等杂质,Co3O4具有较强氧化性)制备CoO的工艺流程如图所示。

已知:I.不同浸出剂“酸溶”结果
浸出剂
浸出液化学成分/(g·L-1)
钴浸出率/%
Co
Al
HCl
80.84
5.68
98.4
H2SO4+Na2S2O3
84.91
5.96
98.0
II.Al3+在pH为5.2时沉淀完全。
III.LiF的Ksp为1.8×10-3。
回答下列问题:
(1)、“碱溶”时为提高浸出率可采取的措施是(写出一种即可),并写出主要的离子方程式:。(2)、“酸溶”时最佳的浸出剂应该选择 , 并说明理由:。(3)、“净化”时,加NaF目的是将Li+转化为沉淀,当滤液③中c(F-)=4.0×10-3mol·L-1时计算“净化”后残余c(Li+)=mol·L-1。(4)、写出滤渣②“酸溶”后与草酸铵反应的离子方程式。9. 有多种检验方法,某实验小组欲探究KSCN检验法在不同反应体系的实验条件,进行了如下实验研究(已知CuSCN为白色沉淀)。(1)、实验一:单一溶液检验
配制100 mL溶液,除了烧杯、量筒,还需用到的玻璃仪器有。
(2)、向溶液中滴加1滴溶液,无明显现象,通入 , 仍无明显变化。①该实验的目的是;
②用离子方程式表示II中出现浅红色的原因:、。
(3)、对II中溶液为浅红色的原因,甲同学提出以下假设。①假设1:加入氯水的量少,生成的浓度低
②假设2:氯水氧化性强,将部分氧化为
继续以下实验:
i.取I中浅红色溶液,(填写实验操作,下同),溶液浅红色消失,从而排除了假设1;
ii.向2mL水中滴加1滴KSCN溶液, , 产生白色沉淀,证明假设2正确。
(4)、实验二:KSCN法检测、混合液中的
溶液上层产生的白色沉淀为;请用平衡移动原理解释上述实验现象:。
10. 已知:4HBr(g)+O2(g)⇌2H2O(g)+2Br2(g)ΔH。v正=k正ca(HBr)·cb(O2),v逆=k逆cc<(H2O)·cd(Br2)(v正为正反应速率,v逆为逆反应速率,k正为正反应速率常数,k逆是逆反应速率常数,只与温度和催化剂有关,与浓度和接触面积无关;a、b、c、d是反应级数,可取整数和分数)。(1)、已知几种共价键键能数据如下所示:共价键
H-Br
O=O
H-O
Br-Br
键能(kJ·mol-1)
363
498
467
193
上述反应中,ΔH=kJ·mol-1。
(2)、下列关于k正和k逆的说法正确的是____(填字母)。A、增大压强,k正增大,k逆减小 B、升高温度,k正和k逆都增大 C、加入催化剂,k正和k逆都增大 D、增大接触面积,k正和k逆都减小(3)、为了测定反应级数,设计实验,测定结果如表所示:实验序号
c(HBr)/mol·L-1
c(O2)/mol·L-1
正反应速率
1
0.1
0.1
v
2
0.1
0.2
2v
3
0.2
0.4
8v
4
0.4
x
32v
①x= , a= , b=。
②有人提出如下反应历程:
(I)HBr+O2→HO-OBr(慢反应)
(II)HO-OBr+HBr→H2O+BrOBr(较快反应)
(III)BrOBr+HBr→BrOH+Br2(快反应)
(IV)BrOH+HBr→Br2+H2O(快反应)
活化能最大的反应是(填代号)。
(4)、在密闭容器中充入HBr和O2 , 发生上述反应,在相同时间里,测得HBr的转化率与温度、压强的关系如图。随着温度升高,三种不同压强下HBr的转化率趋向相等,其原因是。 (5)、在一定温度下,向恒容密闭容器中充入4molHBr(g)和1molO2(g),测得起始的压强为10akPa,发生上述反应达到平衡时气体压强为起始压强的。该温度下,平衡常数Kp=(kPa)-1(用含a的代数式表示)。(6)、常温下,如果将上述反应设计成酸性燃料电池,负极反应式为。11. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。
(5)、在一定温度下,向恒容密闭容器中充入4molHBr(g)和1molO2(g),测得起始的压强为10akPa,发生上述反应达到平衡时气体压强为起始压强的。该温度下,平衡常数Kp=(kPa)-1(用含a的代数式表示)。(6)、常温下,如果将上述反应设计成酸性燃料电池,负极反应式为。11. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。CO
C-O
C=O
C
 O
O键能/kJ·mol-1
357.7
798.9
1071.9
N2
N-N
N=N
N≡N
键能/kJ·mol-1
154.8
418.4
941.7
(4)、CO2分子的空间构型为 , 与CO2互为等电子体,写出的结构式。(5)、一种新型Na-Fe3O4/HZSM-5多功能复合催化剂成功实现了CO2直接加氢制取高辛烷值汽油。该催化剂成分Fe3O4的晶胞如图所示。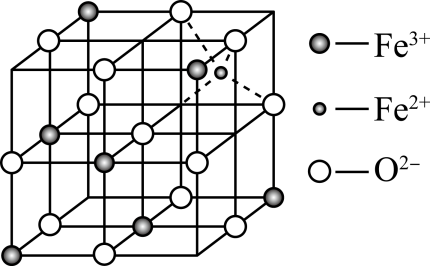
①晶胞中Fe3+处于O2-围成的空隙(填“正四面体”“正八面体”或“正十六面体”)。
②若晶胞体对角线为anm,阿伏加德罗常数为NA , 晶体的密度为g·cm-3(写出表达式)。
12. 氯法齐明是一种抗麻风药物,可通过以下路线合成。
已知:
 +ROH
+ROH +H2O
+H2O回答下列问题:
(1)、A的名称 , C所含的含氧官能团名称是。(2)、反应⑤的反应类型为 , I的结构简式为。(3)、反应④的化学方程式。(4)、化合物M是B的芳香同分异构体,已知M和B具有相同的官能团,则M的可能结构有。种,其中核磁共振氢谱有2组峰,峰面积比为2:1的结构式为(任写一种)。(5)、请仿照题中合成流程图,设计以 和乙烯为起始主要原料合成
和乙烯为起始主要原料合成 的路线(其他无机试剂任选)。
的路线(其他无机试剂任选)。