辽宁省名校联盟2022-2023学年高二上学期9月联合考试化学试题
试卷更新日期:2022-09-14 类型:月考试卷
一、单选题
-
1. 2022年,北京冬奥会成功举办、神舟十三号载人飞船成功返回地球都彰显了我国科技强国的实力。下列有关说法正确的是( )A、冬奥会上的颁奖礼仪服中含有石墨烯,是一种化合物 B、冬奥会采用的“绿电”来自光伏发电,太阳能电池的主要成分为 C、神舟十三号返回舱返回地球进入大气层时,为防止其与空气剧烈摩擦而被烧毁,而在其外表装了保护层。该保护层的材料可能为新型陶瓷 D、宇航员的宇航服材料含有羊毛、蚕丝和棉织品,这些物质的主要成分都是蛋白质2. 下列有关说法中,正确的个数是( )
①阿司匹林是以水杨酸为原料生产的
②汽油、柴油和甲苯完全燃烧只生成和
③石油的裂化、裂解和催化重整,煤的气化和液化都是化学变化
④淀粉和蔗糖水解的最终产物都是葡萄糖
⑤硫酸锌可用作食品添加剂,但亚硝酸钠不可以
A、1 B、2 C、3 D、43. 对于一个放热反应: , 下列条件的改变一定能使该化学反应的速率加快的是( )A、升高温度 B、增加X的物质的量 C、增大压强 D、减少Z的物质的量4. 某有机物的结构如图(图中线段的端点和拐角都表示碳原子),下列关于该有机物的说法正确的是( ) A、分子式为 B、该有机物发生催化氧化时,消耗 C、少量该有机物与反应生成 D、该有机物与足量的钠反应生成氢气5. 分子式为属于羧酸的同分异构体数目和分子式为的同分异构体数目分别为( )A、4种,11种 B、3种,10种 C、4种,9种 D、3种,11种6. 一定温度下,将甲和乙组成的混合气体通入过量的丙溶液中,可能没有沉淀产生的是( )
A、分子式为 B、该有机物发生催化氧化时,消耗 C、少量该有机物与反应生成 D、该有机物与足量的钠反应生成氢气5. 分子式为属于羧酸的同分异构体数目和分子式为的同分异构体数目分别为( )A、4种,11种 B、3种,10种 C、4种,9种 D、3种,11种6. 一定温度下,将甲和乙组成的混合气体通入过量的丙溶液中,可能没有沉淀产生的是( )选项
A
B
C
D
甲气体
乙气体
丙溶液
溶液
溶液
溶液
溶液
A、A B、B C、C D、D7. 是阿伏加德罗常数的值,下列说法正确的是( )A、与足量的浓硫酸在加热条件下反应生成二氧化硫的分子数小于2 B、羟基含有的电子数为7 C、含的溶液最多消耗分子的个数为0.5 D、标准状况下,和混合,在光照下反应后的分子总数为1.58. 下列变化属于吸热反应的是( )A、碳酸氢钠与盐酸反应 B、冰融化成水 C、甲烷在氧气中燃烧 D、铝片与稀硫酸反应9. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是( ) A、转化为的反应为 B、电流从电极b流出,经外电路流向电极a C、有机物在硫酸盐还原菌的作用下与反应,有机物被氧化 D、若外电路中有电子发生转移,则有通过质子交换膜10. 在一定温度时,将和放入容积为的某密闭容器中发生如下反应: , 经后,测得容器内B的浓度减少了 , 则下列叙述错误的是( )A、在内,该反应用C的浓度变化表示的反应速率为 B、在时,容器内D的浓度为 C、该可逆反应未达限度前,随反应的进行,容器内压强逐渐增大 D、时,容器内气体总的物质的量为11. 下列说法正确的是( )A、富勒烯是一种碳纳米材料,富勒烯属于烯烃 B、丙烯可以在一定条件下和溴蒸气发生取代反应 C、芳香烃的官能团为苯环 D、聚丙烯可以使溴水褪色12. 海洋中有丰富的食品、矿产、能源、药物和水产资源等,海水的综合利用如下图所示。
A、转化为的反应为 B、电流从电极b流出,经外电路流向电极a C、有机物在硫酸盐还原菌的作用下与反应,有机物被氧化 D、若外电路中有电子发生转移,则有通过质子交换膜10. 在一定温度时,将和放入容积为的某密闭容器中发生如下反应: , 经后,测得容器内B的浓度减少了 , 则下列叙述错误的是( )A、在内,该反应用C的浓度变化表示的反应速率为 B、在时,容器内D的浓度为 C、该可逆反应未达限度前,随反应的进行,容器内压强逐渐增大 D、时,容器内气体总的物质的量为11. 下列说法正确的是( )A、富勒烯是一种碳纳米材料,富勒烯属于烯烃 B、丙烯可以在一定条件下和溴蒸气发生取代反应 C、芳香烃的官能团为苯环 D、聚丙烯可以使溴水褪色12. 海洋中有丰富的食品、矿产、能源、药物和水产资源等,海水的综合利用如下图所示。
下列有关说法正确的是( )
A、除去粗盐中的等杂质,加入的药品顺序可以为:溶液溶液溶液→盐酸,然后过滤,最后蒸发结晶得到精盐 B、电解熔融状态的来制备镁,也可以电解熔融状态的来制备铝 C、工业上母液过程中选择加入沉淀 D、在过程③⑤中溴元素均被氧化13. 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程,如图所示。已知:①环氧乙烷的分子式为 , ②的结构式为 , ③在化学反应中,催化剂参与化学反应,反应前后质量和化学性质不变。下列说法错误的是( ) A、是反应的催化剂 B、反应过程存在极性键的断裂和形成 C、反应过程中有4种中间体 D、总反应属于加成反应14. 对下列各项叙述的判断及理由正确的是( )
A、是反应的催化剂 B、反应过程存在极性键的断裂和形成 C、反应过程中有4种中间体 D、总反应属于加成反应14. 对下列各项叙述的判断及理由正确的是( )选项
叙述
判断及理由
A
浓硫酸使蓝色的胆矾晶体变成白色粉末
正确,浓硫酸具有吸水性
B
一定条件下乙酸、甲烷均能发生取代反应
错误,乙酸不能发生取代反应
C
淀粉和纤维素互为同分异构体
正确,淀粉和纤维素的化学式均为
D
向鸡蛋清溶液中加入溶液,产生沉淀
正确,蛋白质发生了盐析
A、A B、B C、C D、D15. 一定条件下,溶液的酸碱性对光催化染料R降解反应的影响如图所示。下列判断正确的是( ) A、时,和条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在内,条件下,R的平均降解速率为
A、时,和条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在内,条件下,R的平均降解速率为二、填空题
-
16. 回答下列问题:(1)、下列各组物质中,互为同位素的是(填序号,下同),互为同系物的是 , 互为同分异构体的是。
①红磷与白磷 ②与 ③CH3COOCH3与 ④
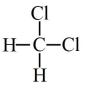 与
与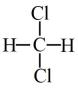 ⑤
⑤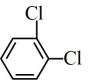 与
与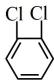 ⑥
⑥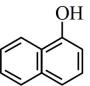 与
与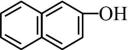 (2)、四种物质皆为烃类有机物,分子球棍模型分别如图所示,请回答下列问题:
(2)、四种物质皆为烃类有机物,分子球棍模型分别如图所示,请回答下列问题: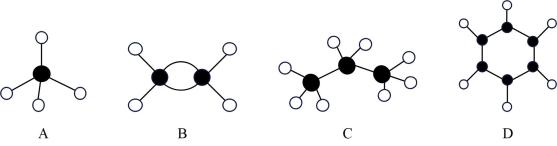
①等物质的量的上述烃,完全燃烧时消耗最多的是(填字母代号,下同),等质量的上述烃完全燃烧时消耗最多的是。
②在 , 下,A,B,C分别与足量混合点燃,完全燃烧后气体体积没有变化的是(填字母代号)。
③B的某种同系物W,分子式为 , 且所有碳原子一定在同一平面上,则W的结构简式为 , W与发生加成反应得到种产物。
④分子式为的饱和一元醇有多种,官能团相连的碳原子上连有两个甲基的醇分子结构简式:。
三、综合题
-
17. 回答下列问题:(1)、化学反应的过程都是旧键断裂、新键形成的过程。对于反应: , 已知断开键,键分别需要吸收的能量是和 , 形成键需要放出的能量是。
①和完全反应共(填“放出”或“吸收”)能量。
②如图,能够反映该反应能量变化的图像是(填“A”或“B”)。
 (2)、①如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌电极上发生的是 (填“氧化”或“还原”)反应,电极反应式为。银片上观察到的现象是。
(2)、①如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌电极上发生的是 (填“氧化”或“还原”)反应,电极反应式为。银片上观察到的现象是。
②将设计成燃料电池,其能量利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得向B电极定向移动,则 (填“A”或“B”)处电极入口通甲烷,其电极反应式为。
(3)、在密闭容器中,X,Y、Z三种气体的物质的量随时间的变化曲线如图:
①该反应的化学方程式是。
②该反应达到平衡状态的标志是(填字母)。
A.Y的体积分数在混合气体中保持不变
B.
C.容器内气体压强保持不变
D.容器内气体的密度保持不变
E.生成的同时消耗
③内Y的转化率为。
18. 某课外活动小组欲利用与反应,研究的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: (1)、仪器a的名称为。(2)、实验中观察到装置C中黑色粉末变为红色固体,量气管有无色无味的气体,上述现象证明具有性,写出相应的化学方程式:。(3)、E装置中浓硫酸的作用是。(4)、U形管中碱石灰换成氯化钙(填“可以”或“不可以”)。(5)、实验完毕,若测得干燥管D增重 , 装置F测得气体的体积为(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n的代数式表示)。(6)、在实验室中用图中A装置也可制取气体:
(1)、仪器a的名称为。(2)、实验中观察到装置C中黑色粉末变为红色固体,量气管有无色无味的气体,上述现象证明具有性,写出相应的化学方程式:。(3)、E装置中浓硫酸的作用是。(4)、U形管中碱石灰换成氯化钙(填“可以”或“不可以”)。(5)、实验完毕,若测得干燥管D增重 , 装置F测得气体的体积为(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n的代数式表示)。(6)、在实验室中用图中A装置也可制取气体:①选用的药品可以是。
A.溶液与 B.固体与浓
C.碳与浓 D.铜与浓
②将制得的通入淀粉碘化钾溶液,现象为 , 表明的氧化性比(填“强”或“弱”)。
19. 乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
回答下列问题:
(1)、A的结构简式为。(2)、B的化学名称是 , 除去B中少量的A需要的试剂名称为。(3)、由乙醇生产C的化学反应类型为 , C中含氧官能团的名称为。(4)、E是一种常见的塑料,其化学名称是。(5)、由乙醇生成F的化学方程式为。(6)、绿色化学提倡化工生产提高原子利用率,下列反应中原子利用率最高的是____。A、乙醇生成F B、乙醇生成C C、D生成E D、C生成D
-