重庆市万盛经济技术开发区2022年中考一模化学试题
试卷更新日期:2022-09-14 类型:中考模拟
一、单选题
-
1. 化学在生产、生活中应用广泛,下列过程属于化学变化的是( )A、
 海水晒盐
B、
海水晒盐
B、 活性炭净水
C、
活性炭净水
C、 煤制煤气
D、
煤制煤气
D、 干冰降雨
2. 下列含有“水”字的物质不属于溶液的是( )A、蒸馏水 B、矿泉水 C、食盐水 D、澄清的石灰水3. 下列物质或方式中的“碳”,主要不是针对碳单质的是( )A、碳素墨水 B、打印碳粉 C、低碳生活 D、石墨碳棒4. 人处于紧张状态时,维生素的消耗会增加,因此考试期间应多补充的食物是( )A、馒头 B、蔬菜 C、啤酒 D、植物油5. 分类是科学研究的重要方法,下列物质对应的类别错误的是( )
干冰降雨
2. 下列含有“水”字的物质不属于溶液的是( )A、蒸馏水 B、矿泉水 C、食盐水 D、澄清的石灰水3. 下列物质或方式中的“碳”,主要不是针对碳单质的是( )A、碳素墨水 B、打印碳粉 C、低碳生活 D、石墨碳棒4. 人处于紧张状态时,维生素的消耗会增加,因此考试期间应多补充的食物是( )A、馒头 B、蔬菜 C、啤酒 D、植物油5. 分类是科学研究的重要方法,下列物质对应的类别错误的是( )选项
A
B
C
D
物质
熟石灰
小苏打
氨气
硅
类别
氧化物
盐
化合物
单质
A、A B、B C、C D、D6. 物质的性质决定物质的用途,下列描述的物质性质与其对应用途不相符的是( )A、浓硫酸有吸水性,可用作干燥剂 B、石墨有导电性,可用作电池的电极 C、氧气有助燃性,可用于登山和潜水 D、一氧化碳有还原性,可用于冶炼金属7. 下列图示的实验操作中,正确的是( )A、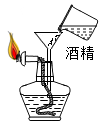 添加酒精
B、
添加酒精
B、 处理废弃固体药品
C、
处理废弃固体药品
C、 测溶液的pH
D、
测溶液的pH
D、 加热溶解
8. 化学用语是学好化学的工具,下列有关化学用语的说法正确的是( )A、2H 表示 2 个氢元素 B、KMnO4和 K2MnO4中有相同的原子团 C、H2O 和 H2O2中 O 的化合价相同 D、Fe2+和 Fe3+都属于铁元素,核外电子数不同9. 金俗称“黄金”,三星堆遗址发掘出一副黄金面具,向世界展现了灿烂的华夏文明,也反映出古蜀人高超的金属冶炼技术和加工水平。如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( )
加热溶解
8. 化学用语是学好化学的工具,下列有关化学用语的说法正确的是( )A、2H 表示 2 个氢元素 B、KMnO4和 K2MnO4中有相同的原子团 C、H2O 和 H2O2中 O 的化合价相同 D、Fe2+和 Fe3+都属于铁元素,核外电子数不同9. 金俗称“黄金”,三星堆遗址发掘出一副黄金面具,向世界展现了灿烂的华夏文明,也反映出古蜀人高超的金属冶炼技术和加工水平。如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( ) A、金元素属于非金属元素 B、一个金原子的中子数为197 C、一个金原子的核外电子数为118 D、一个金原子中粒子总数为27610. 下列物质的转化不能一步实现的是( )A、Fe2O3→Fe→Ag B、Na2CO3→NaCl→MgCl2 C、H2SO4→HCl→HNO3 D、Ca(OH)2→NaOH→Mg(OH)211. 精美的雕花玻璃可以通过氢氟酸(HF)对玻璃的腐蚀作用制成。氢氟酸与玻璃发生反应的化学方程式为:SiO2+4HF= X ↑+2H2O,则X的化学式为( )A、F2 B、O2 C、SiH4 D、SiF412. 海洋是巨大的资源宝库,海水通过“盐田法”得到“粗盐”。实验室中通过溶解、过滤、蒸发三步操作可将“粗盐”中难溶性杂质去除,下列仪器在上述操作过程中不会用到的是( )A、烧杯
A、金元素属于非金属元素 B、一个金原子的中子数为197 C、一个金原子的核外电子数为118 D、一个金原子中粒子总数为27610. 下列物质的转化不能一步实现的是( )A、Fe2O3→Fe→Ag B、Na2CO3→NaCl→MgCl2 C、H2SO4→HCl→HNO3 D、Ca(OH)2→NaOH→Mg(OH)211. 精美的雕花玻璃可以通过氢氟酸(HF)对玻璃的腐蚀作用制成。氢氟酸与玻璃发生反应的化学方程式为:SiO2+4HF= X ↑+2H2O,则X的化学式为( )A、F2 B、O2 C、SiH4 D、SiF412. 海洋是巨大的资源宝库,海水通过“盐田法”得到“粗盐”。实验室中通过溶解、过滤、蒸发三步操作可将“粗盐”中难溶性杂质去除,下列仪器在上述操作过程中不会用到的是( )A、烧杯 B、漏斗
B、漏斗  C、锥形瓶
C、锥形瓶  D、蒸发皿
D、蒸发皿  13. 化学实验中处处表现出颜色变化美,下列化学实验中的颜色变化不符合实验事实的是( )A、铁钉放入硫酸铜溶液中,溶液由蓝色变为浅绿色 B、将空气中燃着的硫伸入氧气瓶中,火焰由黄色变为蓝紫色 C、高温加热木炭与氧化铜的混合物,固体由黑色变成红色 D、往水中加入少量高锰酸钾,液体由无色变成紫红色14. 根据下列实验方案进行实验,能达到相应实验目的的是( )
13. 化学实验中处处表现出颜色变化美,下列化学实验中的颜色变化不符合实验事实的是( )A、铁钉放入硫酸铜溶液中,溶液由蓝色变为浅绿色 B、将空气中燃着的硫伸入氧气瓶中,火焰由黄色变为蓝紫色 C、高温加热木炭与氧化铜的混合物,固体由黑色变成红色 D、往水中加入少量高锰酸钾,液体由无色变成紫红色14. 根据下列实验方案进行实验,能达到相应实验目的的是( )编号
A
B
C
D
实验方案


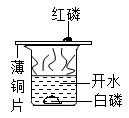

实验目的
探究铁钉生锈时O2是否参与反应
探究影响物质溶解性的因素
比较红磷和白磷的着火点
比较Zn和Fe的金属活动性强弱
A、A B、B C、C D、D15. 为区分硫酸钾、氯化铵、硫酸铵、磷矿粉四种固体物质,以下方案及结论错误的是( )A、观察固体颜色能区分出磷矿粉 B、取样,溶解后加硝酸钡溶液能区分出硫酸铵 C、取样,加熟石灰研磨闻到氨味的物质有两种 D、用水和氢氧化钡溶液能区分出四种物质二、多选题
-
16. 下列图像不能正确反映其对应变化关系的是( )A、
 向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
B、
向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
B、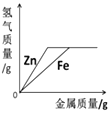 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
C、
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
C、 用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气
D、
用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气
D、 一定质量稀盐酸中逐滴加入氢氧化钠溶液
一定质量稀盐酸中逐滴加入氢氧化钠溶液
三、填空题
-
17. 酸性锌锰干电池的外壳为金属锌,中间是碳棒,其周围是碳粉、二氧化锰、氯化铵和氯化锌等组成的填充物,回收处理该废电池可以得到多种化工原料。请回答:
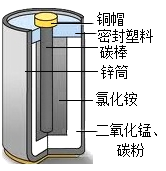 (1)、废电池填充物加水处理后,过滤,滤渣的主要成分是碳粉和(填化学式),滤液中主要的阴离子是(填化学符号)。(2)、欲从滤渣中得到较纯的二氧化锰,最简便的方法是 , 其原理是(写化学方程式)18. 2017年5月,我国自主研制的大型客机C919试飞成功,大飞机使用了多种化学材料(如图甲)。请回答下列问题:
(1)、废电池填充物加水处理后,过滤,滤渣的主要成分是碳粉和(填化学式),滤液中主要的阴离子是(填化学符号)。(2)、欲从滤渣中得到较纯的二氧化锰,最简便的方法是 , 其原理是(写化学方程式)18. 2017年5月,我国自主研制的大型客机C919试飞成功,大飞机使用了多种化学材料(如图甲)。请回答下列问题: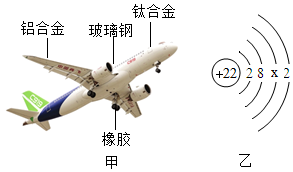 (1)、橡胶属于物(选填“有机”或“无机”)。(2)、玻璃钢属于材料(选填“金属”、“有机高分子”、“复合”)。(3)、图乙是钛的原子结构示意图,则x=。(4)、制造大飞机用铝合金而不用铁合金,主要原因是铝比铁具有更好的抗腐蚀性和密度小特点,写出铝抗腐蚀性的化学方程式。19. 水是我们很熟悉的物质,学习化学以后,我们对水有了一些新的认识。(1)、了解了水的宏观组成。水是由组成的。(2)、知道了水的微观结构。构成水的粒子可表示为(填序号)。
(1)、橡胶属于物(选填“有机”或“无机”)。(2)、玻璃钢属于材料(选填“金属”、“有机高分子”、“复合”)。(3)、图乙是钛的原子结构示意图,则x=。(4)、制造大飞机用铝合金而不用铁合金,主要原因是铝比铁具有更好的抗腐蚀性和密度小特点,写出铝抗腐蚀性的化学方程式。19. 水是我们很熟悉的物质,学习化学以后,我们对水有了一些新的认识。(1)、了解了水的宏观组成。水是由组成的。(2)、知道了水的微观结构。构成水的粒子可表示为(填序号)。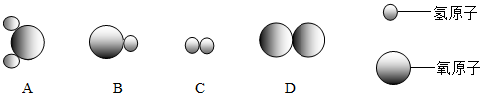 (3)、认识了水的化学性质。写出水中通直流电的化学反应方程式。(4)、知道了水的诸多用途。如水可以溶解许多物质,写出生石灰在水中溶解的化学反应方程式。20. 甲、乙两种物质的溶解度曲线如图,请结合该图回答下列问题:
(3)、认识了水的化学性质。写出水中通直流电的化学反应方程式。(4)、知道了水的诸多用途。如水可以溶解许多物质,写出生石灰在水中溶解的化学反应方程式。20. 甲、乙两种物质的溶解度曲线如图,请结合该图回答下列问题: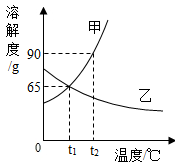 (1)、在℃时,甲、乙两种物质的溶解度相等。(2)、t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数(填“大于”“等于”或“小于”)乙溶液的溶质质量分数。(3)、小明同学用甲物质进行下图所示实验:
(1)、在℃时,甲、乙两种物质的溶解度相等。(2)、t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数(填“大于”“等于”或“小于”)乙溶液的溶质质量分数。(3)、小明同学用甲物质进行下图所示实验: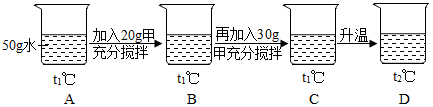
①实验过程中,B、C、D对应的溶液为不饱和溶液的是。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是。
21. 金属钛广泛用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如图所示:
请回答下列问题:
(1)、构成金属钛的微粒是(填“分子”、“原子”或“离子”),H2TiO3中钛元素的化合价为。(2)、反应②需持续通入氩气,氩气的作用是。(3)、反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为。(4)、在反应①、②和③中,基本反应类型相同的是。22. 氨气(NH3)是一种重要化工原料,有刺激性气味,密度比空气小。某兴趣小组用加热NH4CI和Ca(OH)2固体的方法制备、收集干燥的NH3 , 实验装置如下图所示: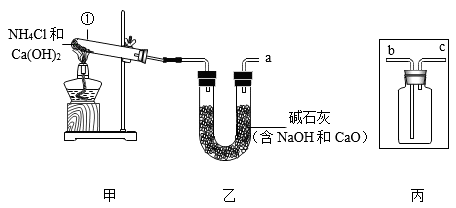
已知: ,回答下列问题:
(1)、图中仪器①的名称为 , 甲装置也可以用于实验室制备某。常见气体,写出制备该气体的化学方程式。(2)、乙装置的作用是。(3)、丙装置用于收集NH3 , 则乙中导管口a应与丙中导管端相连(选填“b”或“c”)。(4)、从保护环境角度,该实验在丙装置后还应接一个装置。23. 某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了如下两个实验:(1)、【实验一】把试管①②中静置后的上层清液倒入洁净的烧杯中,最后只得到蓝色沉淀和无色溶液。
写出混合后得到蓝色沉淀一定发生反应的化学方程式。
(2)、混合后所得无色溶液中一定含有的溶质是(填化学式,下同),可能含有的溶质是。(3)、【实验二】按照下列组合继续验证复分解反应发生的条件:组合序号
①
②
③
组合的溶液
H2SO4、NaOH
H2SO4、NaCl
H2SO4、Na2CO3
在组合①、②、③中,组合无明显现象,但它们的实质不同,为了证明实质不同,小强同学在实验过程中使用了酚酞试液。
(4)、实验结束后把3个组合反应后的溶液混合,混合后溶液也显无色。混合后所得溶液中溶质(除酚酞外)的组成可能有种情况(填数字)。(5)、在组合①、②、③中,组合发生了复分解反应。四、计算题
-
24. 工业造纸、治金、合成洗涤剂等行业都会用到元明粉,元明粉的主要成分为Na2SO4。下表为元明粉的主要质量标准:
质量等级
特等品
一类一等品
二类一等品
二类合格品
Na2SO4质量分数%≥
99.3
99.0
98.0
95.0
质检人员为确定某批产品质量等级,进行了下列实验:称取该样品28.8g(杂质为氯化钠),加100克水使其完全溶解,再向其中加入一定量的20%的BaCl2溶液恰好完全反应,过滤、洗涤、干燥,得沉淀46.6g。
(1)、通过计算判断该批产品的质量等级最高可定为哪一级?(2)、求反应中消耗20%的BaCl2溶液质量。(3)、求该实验所得滤液中溶质的质量分数。
-