初中科学中考复习 物质的鉴别、推断优生特训7
试卷更新日期:2022-09-09 类型:二轮复习
一、单选题
-
1.
有关物质之间的部分转化关系如图所示.其中“﹣”表示物质之间能发生化学反应,“→”表示物质之间的转化关系.下列说法中正确的是( )
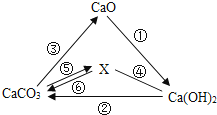 A、物质X是一种常见的有机化合物 B、反应②是一定有盐参加反应 C、向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大 D、图中的所有反应均不属于置换反应2. 黄金是Au对应的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金与假黄金的方案( )A、在空气中灼烧 B、放在盐酸中 C、放在AgNO3溶液中 D、观察颜色3.
A、物质X是一种常见的有机化合物 B、反应②是一定有盐参加反应 C、向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大 D、图中的所有反应均不属于置换反应2. 黄金是Au对应的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金与假黄金的方案( )A、在空气中灼烧 B、放在盐酸中 C、放在AgNO3溶液中 D、观察颜色3.如图所示,处于连线两端的物质,在一定的条件下都能发生化学反应的物质组别是( )
甲
乙
丙
丁
A
C
O2
H2SO4
CuO
B
Fe
H2SO4
CuCl2
NaOH
C
NaOH
CO2
KOH
CuCl2
D
Na2SO4
Ba(OH)2
HCl
Ba(NO3)2
 A、A B、B C、C D、D4. 有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。为确定其组成,进行如下实验:①取少量该固体粉末,加足量水搅拌,静置得到白色沉淀,上层为无色溶液:②过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。根据上述实验现象,下列对原固体粉末的判断正确的是( )A、一定含有碳酸钠、硫酸钠、硝酸钡和氯化钾,可能含有氯化铜 B、一定含有碳酸钠、硫酸钠和硝酸钡,一定不含氯化铜,可能含有氯化钾 C、一定含有碳酸钠、硫酸钠和硝酸钡,可能含有氯化铜和氯化钾 D、一定含有碳酸钠和硝酸钡,一定不含硫酸钠和氯化铜,可能含有氯化钾5.
A、A B、B C、C D、D4. 有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。为确定其组成,进行如下实验:①取少量该固体粉末,加足量水搅拌,静置得到白色沉淀,上层为无色溶液:②过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。根据上述实验现象,下列对原固体粉末的判断正确的是( )A、一定含有碳酸钠、硫酸钠、硝酸钡和氯化钾,可能含有氯化铜 B、一定含有碳酸钠、硫酸钠和硝酸钡,一定不含氯化铜,可能含有氯化钾 C、一定含有碳酸钠、硫酸钠和硝酸钡,可能含有氯化铜和氯化钾 D、一定含有碳酸钠和硝酸钡,一定不含硫酸钠和氯化铜,可能含有氯化钾5.小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
 A、HCl NaOH BaCl2 Na2SO4 B、HCl Ba(OH)2 Na2SO4 BaCl2 C、H2SO4 Ba(OH)2 Na2SO4 BaCl2 D、H2SO4 NaOH BaCl2 Na2SO46. 有一包粉末可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:①将此固体粉末加入到水中,得到白色沉淀,且上层清液为无色;②该白色沉淀部分溶于稀硝酸,且有无色气体产生。据此实验,下列判断正确的是( )A、该粉末中一定含有CaCO3、Na2SO4、BaCl2 B、该粉末中一定不含有KNO3、CuSO4 C、该粉末中一定含有KNO3 D、该粉末中一定含有Na2SO4、KNO3、BaCl27.
A、HCl NaOH BaCl2 Na2SO4 B、HCl Ba(OH)2 Na2SO4 BaCl2 C、H2SO4 Ba(OH)2 Na2SO4 BaCl2 D、H2SO4 NaOH BaCl2 Na2SO46. 有一包粉末可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:①将此固体粉末加入到水中,得到白色沉淀,且上层清液为无色;②该白色沉淀部分溶于稀硝酸,且有无色气体产生。据此实验,下列判断正确的是( )A、该粉末中一定含有CaCO3、Na2SO4、BaCl2 B、该粉末中一定不含有KNO3、CuSO4 C、该粉末中一定含有KNO3 D、该粉末中一定含有Na2SO4、KNO3、BaCl27.甲、乙、丙、丁是初中化学常见的物质,常温下,它们具有如图所示关系.“﹣”表示连接的两种物质能反应,“→”表示物质转化的方向,下列推断错误的是( )
 A、若甲是HCl,则丁可能是CaCl2 B、若甲是HCl,则乙和丙中可能有一个为碱 C、若甲是Ca(OH)2 , 则丁可能是NaOH D、若甲是Ca(OH)2 , 则乙和丙中至少有一个为酸8. 下列各组物质的溶液,需要加入其他试剂才能鉴别出来的是( )
A、若甲是HCl,则丁可能是CaCl2 B、若甲是HCl,则乙和丙中可能有一个为碱 C、若甲是Ca(OH)2 , 则丁可能是NaOH D、若甲是Ca(OH)2 , 则乙和丙中至少有一个为酸8. 下列各组物质的溶液,需要加入其他试剂才能鉴别出来的是( )
A、NaOH NaCl KNO3 MgCl2 B、NaOH NaCl HCl FeCl3 C、Na2SO4 BaCl2 HCl K2CO3 D、Na2CO3 H2SO4 HCl Ba(NO3)29. 纯净物M、N之间存在着如图所示转化关系,且反应物和生成物均表示在图示中。单质A和单质B分别由A、B元素组成。据此,可以得出的正确结论是( ) A、M不属于氧化物 B、M、N中只有N含有A元素 C、N是二氧化碳 D、M与镁的反应是置换反应10. 下列实验能达到目的的是( )A、检验硫酸根离子
A、M不属于氧化物 B、M、N中只有N含有A元素 C、N是二氧化碳 D、M与镁的反应是置换反应10. 下列实验能达到目的的是( )A、检验硫酸根离子 B、探究水的运输部位
B、探究水的运输部位 C、组装省力到1/3的滑轮组
C、组装省力到1/3的滑轮组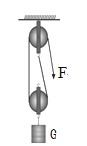 D、验证酶的专一性
D、验证酶的专一性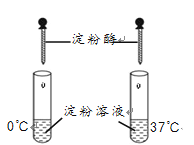
二、多选题
-
11. 某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,某同学取一定量该气体按如图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③质量增加10.8g,装置④质量增加8.8g。下列关于气体X成分的分析中,错误的是( )
 A、一定没有二氧化碳 B、可能含有氢气和一氧化碳 C、可能含有甲烷和氢气 D、可能只有甲烷12.
A、一定没有二氧化碳 B、可能含有氢气和一氧化碳 C、可能含有甲烷和氢气 D、可能只有甲烷12.A.B.C.D.E是初中化学常见的物质,各物质之间的相互转化的关系如图所示(部分反应物、生成物及条件略去).已知:五种物质均含有铜元素,且化合物中的化合价均为+2价;A为单质,在空气中加热生成黑色物质B; C溶液与铁反应可得A;C溶液与氯化钡溶液反应得D,同时又白色沉淀生成;D溶液中加入氢氧化钠溶液得到E.结合信息判断下列叙述正确的是( )
 A、①反应是吸热反应 B、C溶液是无色透明的液体 C、②反应中和反应 D、C、D、E均是盐类
A、①反应是吸热反应 B、C溶液是无色透明的液体 C、②反应中和反应 D、C、D、E均是盐类三、填空题
-
13. 有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验
(1)取样溶于水,无固体残留,得无色溶液.则粉末中一定不含有 、 、 .
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3 , 沉淀部分溶解,则此粉末中一定含有的杂质是 .
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分反应生成19.7g沉淀质量,则原粉末中一定含有Na2CO3 . 你认为此结论(选填“是”或“否”)正确.
14.A、B、C、D、E、F、G、Y为初中化学常见物质,其中C、E、G属于单质,Y是一种有毒气体,反应①是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
(1)D物质的化学式是 ,E物质的化学式是 .
(2)反应①的化学方程式为 ,此反应中被氧化的物质是 (写化学式).
(3)X是 和 (均写化学式)的混合溶液,当 的情况下将没有E生成.
(4)反应②中生成红色固体的化学方程式为 .
 15.
15.甲、乙、丙是三种初中化学常见的物质,相互转化关系如图所示,请完成下列问题:
(1)若甲是黑色固体单质,且甲和乙具有相似的化学性质,则乙是 (填化学式).
(2)若甲是液体化合物,丙为地壳中含量最多的元素组成的单质,乙在通电的条件可生成丙,则甲和乙的组成元素 (填“相同”或“不同”).乙生成丙的化学方程式 .
 16.
16.如图所示A~G是初中化学中常见的物质(反应条件和部分产物已省略,“﹣”表示相互能反应,“→”表示转化关系),其中A是人体胃液中含有的酸,B与C的组成元素相同,D是一种红色粉末,F是相对分子质量最小的氧化物.请回答下列问题.
(1)写出物质E的一种用途:;
(2)A~G七种物质中,氧化物有 种;
(3)F→E的反应现象是;
(4)A→B反应的基本类型属于:;
(5)F→G的化学方程式是: ;C﹣D反应的化学方程式是: .
 17. 甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙→丙+丁.
17. 甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙→丙+丁.(1)若甲、丙为单质,乙、丁为化合物,则上述反应的基本反应类型为 .
(2)若甲、乙、丙、丁均为化合物,丙为不溶于稀HNO3的白色沉淀,写出一个符合要求的化学方程式: .
(3)若甲、乙、丙均为化合物,丁为单质,则丁可能为 .
18.金属钛(Ti)具有熔点高、密度小、抗腐蚀、易于加工等优良性能,被誉为“未来的金属”.工业上以钛酸亚铁(FeTiO3)等原料经过一系列反应制备纳米TiO3和钛,主要生产过程如下:(其他产物已略去)

(1)反应①生成两种氯化物和一种有毒的氧化物气体,该气体的化学式是 .
(2)反应②中的化学方程式是 .
(3)纳米TiO2中钛元素和化合价为 价.
(4)反应①②③④中属于置换反应的是 (填序号).
19.归类、分类、比较、推理是学习化学常用的方法.现有A﹣F六种物质,均是由H、C、N、O、Cl、Na、Ca中的两种或三种元素组成.请回答下列问题:
(1)上述七中元素中属于金属元素的是 (填元素名称).
(2)A属于氧化物,是导致酸雨的气体污染物之一,组成A的两种元素的质量比为7:8,则A的化学式为 .
(3)B、C常温下均为液体,且组成元素相同,B在一定条件下可生成C,写出该反应的化学反应方程式 .
(4)D用于玻璃、造纸和洗涤剂的生成,E、F均由两种元素组成,取D溶液进行实验,操作和现象如图:

写出D与E反应的化学方程式 ,F的化学式为 .
20.如图各物质均是初中化学常见的物质,其中A是紫红色金属,B的固体可用作人工降雨,C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分反应物和生成物已略).
(1)用化学式表示:A ,G .
(2)写出E与F反应的化学方程式: .写出B与D反应的化学方程式: .
(3)C与D反应的基本反应类型是 .
 21.
21.甲、乙、丙、丁均为中学化学中的常见物质,其中甲是大理石的主要成分,乙是造成温室效应的主要气体,它们之间的转化关系如图.请根据相关信息回答问题:
(1)写出有关物质的化学式:甲 ,丁 .
(2)写出反应③的化学方程式 ,该反应属于(填基本反应类型)反应.
(3)生活中,物质丙的用途之一为 .
 22.
22.A﹣J是初中化学常见的物质,它们之间的转化关系如图1所示(“﹣”表示相邻的两物质可以发生反应,“→”表示箭头前面的物质可以转化为箭头后面的物质:部分反应的反应物、生成物和反应条件没有标出).图2所示的是部分物质的相关信息:I、J中含有相同的金属元素,H的相对分子质量比E的大.

请回答下列问题:
(1)、F的化学式是 ;(2)、物质I俗称 ;(3)、写出上述物质转化过程中属于分解反应的一个化学方程式 ;(4)、写出H→E的化学方程式 .23.A、B、C、D、E、F、G、H、I为初中化学常见的物质.其中D、G、I属于单质,A为红褐色固体,G为紫红色固体,H为浅绿色溶液.如图是它们之间的相互转化关系(部分反应条件及生成物略去).

(1)E溶液中的溶质是 .
(2)写出反应①的化学方程式 .
(3)写出反应②中生成G的化学方程式 和生成I的原因 .
24.A、B、C、D是初中常见的化学物质,A是由核电荷数分别为6、8、11的三种元素组成的化合物,B是一种微溶性碱,C是一种可溶性盐酸盐,D是一种可溶性碱,它们之间存在的关系如图所示,图中“﹣”表示物质间能发生的化学反应,“→”表示物质间的转化关系.
(1)A的俗名叫;
(2)写出C的化学式 ;
(3)写出B的一种作用;
(4)写出B与A反应的化学反应方程式 .
 25.
25.A﹣N是初中学过的物质.D是相对分子质量为40的氧化物,A是不溶于水和稀硝酸的白色沉淀,E是难溶于水的白色沉淀,实验室通常用N制取CO2 . 右下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.(注:难溶性碱加热分解生成对应的氧化物)
(1)写出化学式:A , N .
(2)写出E→B的化学方程式 .
(3)由F生成E需加入的物质是 .
(4)C在空气中燃烧生成D的实验现象是 .
C在空气中燃烧除了生成D之外,也可能与空气中的氮气生成氮化物(氮元素化合价为﹣3),该氮化物的化学式是 .
 26.
26.图中A~I是初中化学常见的物质,它们之间的相互关系如图所示,其中B是铁锈的主要成分,A、C常温下是气体.

(1)C的化学式是 .
(2)若H为NaCl,反应③的化学方程式为 ;其反应类型是 .
(3)若H和I中含有一种相同的元素,且H为不溶于稀硝酸的白色沉淀,反应②的化学方程式为 .
27.A~H是初中化学常见物质,已知:A,E是红色固体;C,G是黑色粉末;B,H是气体且B为化合物;D溶液呈蓝色,可用于配制农药波尔多液,它们之间的转化关系如图所示(各步均恰好完全反应,部分生成物已略去),请回答下列问题:

(1)F溶液的溶质是 , G是 ;
(2)反应①的化学方程式是 ;
(3)反应③的基本反应类型是 ;
(4)写出B物质的一种用途 .
28.图中A~F为初中化学常见的六种物质,其中A、B、D含相同的阴离子,C、D、E、F含有同一种元素,C、E、F是不同类别的物质.A、C之间的反应可用于检验铵态氮肥,B、E之间的反应是实验室制取二氧化碳的反应原理.框图中“﹣”表示相连的两种物质间能发生化学反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去).回答下列问题:
 (1)、写出B的名称: ,F的化学式: .(2)、写出C的一种用途: .(3)、写出下列反应的化学方程式:
(1)、写出B的名称: ,F的化学式: .(2)、写出C的一种用途: .(3)、写出下列反应的化学方程式:A→C: ;
D→E: .
基本反应类型是 反应.
29.甲、乙、丙是初中化学常见的物质,甲在一定条件下分解成乙和丙,乙是最常用的溶剂.三种物质转化关系如图所示(部分反应物、生成物和反应条件已略去).
(1)若甲、乙组成元素相同,则丙是 . 从微观角度解释,甲、乙化学性质不同的原因是 .
(2)若丙固体的俗称为干冰,则甲为 . 由丙转化为乙反应的化学方程式为 (答一个即可).
 30. 实验室有一久置的生石灰样品,科学小组同学利用该样品进行了一系列探究活动,具体操作步骤如下:
30. 实验室有一久置的生石灰样品,科学小组同学利用该样品进行了一系列探究活动,具体操作步骤如下:①称取0.75克样品,加足量的水充分溶解,过滤得滤液A和0.1克沉淀B。
②将滤液A等分成2份,一份先加少量酚酞试液再加稀盐酸至过量,得混合物C,另一份加过量的碳酸钠溶液,得混合物D。
③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清夜呈红色,过滤,得滤液E和1克滤渣
④向滤液E中滴加CaCl2溶液,有白色沉沉生成。
(1)、则滤液E中一定含有的溶质是。(2)、依据实验现象和及数据判断,原样品的成分是。31.下图是常见物质的转换关系图。其中A、B常温下都为液体且组成元素相同,A、B、X、Y、E都为氧化物,X、E都为黑色固体,F为白色沉淀,I为蓝色絮状沉淀。

请回答下列问题:
(1)、E的化学式 ;F的化学式 。(2)、反应⑥的化学方程式 。(3)、反应①—⑥涉及的基本反应类型有 种。32.现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成。为确定其组成,进行了如下图所示的实验。

请回答:
(1)、若X溶液只含一种溶质,根据实验可以确定X溶液的溶质是 ;(2)、原固体粉末的所有可能组成是 。四、实验探究题
-
33.
学习碱的个性时,同学们在实验室中做“检测氢氧化钙性质 ”的实验,实验方案如图所示(说明:实验中使用的药品均是溶液)。

请回答下列问题:
(1)、写出盐酸加入氢氧化钙中反应的化学方程式: ;在实验过程中 ,并没有观察到该反应的明显现象 ,请你写出一种能观察到变化发生的方法: 。
(2)、实验结束后,同学们将四支试管中的物质全部倒入废液缸中,为了处理废液渣,首先对废液缸中物质的成分进行初步分析,过程如下图所示:

由上述分析可知:
①固体A中一定还有碳酸钙和 。
②无色溶液 B中使酚酞试液变红的物质是 。
34.小明为了测定铜和氧化铜混合物中氧化铜的质量分数,设计组装了如图的实验装置:
 (1)、仪器识别:a ;b 。(2)、装置A中发生反应的化学方程式 。(3)、能除去H2中混有少量HCl气体的装置是(填装置序号)。(4)、装置E中硫酸铜粉末变蓝色,说明硬质试管中反应后有 生成。(5)、实验前硬质试管中混合物的质量为5g,实验后剩余固体质量为4.2g,求混合物中氧化铜的质量分数 %。35. 天然气作为燃料已进入千家万户。小聪在帮助父母烧菜时想到:天然气燃烧的产物是什么呢?带着这一问题,小聪和同学一起进行了如下的探究。(1)、
(1)、仪器识别:a ;b 。(2)、装置A中发生反应的化学方程式 。(3)、能除去H2中混有少量HCl气体的装置是(填装置序号)。(4)、装置E中硫酸铜粉末变蓝色,说明硬质试管中反应后有 生成。(5)、实验前硬质试管中混合物的质量为5g,实验后剩余固体质量为4.2g,求混合物中氧化铜的质量分数 %。35. 天然气作为燃料已进入千家万户。小聪在帮助父母烧菜时想到:天然气燃烧的产物是什么呢?带着这一问题,小聪和同学一起进行了如下的探究。(1)、设计与实验:同学们设计了甲图装置(固定装置未画出),将天然气在氧气中点燃后得到的混合气体通过该装置进行实验。开始时应 (填“先通气体”或“先加热”);加热过程中发现黑色CuO固体变红,澄清石灰水变浑浊。写出CuO固体变红的化学方程式 。
仅根据甲图装置出现的现象,写出混合气体所有的可能组成 。
 (2)、
(2)、评价与改进:小聪认为上述实验方案有缺陷,通过讨论,增加了乙图中的3个装置(固定装置未画出),对方案作了改进并进行实验:将混合气体先通过乙图中连接的装置后,再通入甲图装置。实验中部分现象如下:A装置质量增加,B装置中溶液不变浑浊,甲图装置中实验现象(1)相同。请你写出改进方案的装置连接顺序(装置不重复使用):混合气体→ →甲图装置(填装置编号)。

(3)交流与讨论:通过对改进实验的现象分析,同学们得出了正确的结论。
36.有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种。为确定其组成,小杨设计出实验方案,实验步骤及现象如下。请回答:
 (1)、写出步骤④中产生白色沉淀的化学方程式。(2)、根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。 。37.
(1)、写出步骤④中产生白色沉淀的化学方程式。(2)、根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。 。37.现有一包固体粉末,可能由碳酸钠、硫酸钠、碳酸钙和氯化钠中的一种或几种组成,某同学想确定其组成成分,按如图所示步骤进行了如下实验(各步骤中加入的试剂均为足量):

请回答:
(1)、固体粉末中肯定存在的物质是 , 用化学方程式表示白色沉淀部分溶解的原因;(2)、如何判断固体粉末中是否有“可能存在的物质”,简述实验操作步骤、现象和结论。38. 工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。【原理思路】利用Na2CO3与稀H2SO4反应产生CO2 , 通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
 (1)、【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略)。装置中,仪器A的名称。(2)、【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差(填序号)。
(1)、【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略)。装置中,仪器A的名称。(2)、【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差(填序号)。①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出 ③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
(3)、【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是。(4)、【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将(填“偏高”、“偏低”或“无影响”)。(5)、【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3 , 当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成 。五、解答题
-
39. 在实验室,小金分别用甲盐的晶体配制了溶质质量分数为5%的A的溶液和30%的B溶液,但忘了帖标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液,请写出简要的实验方案和明确的判断依据,有下列仪器、物品供选择,量筒、天平、小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜萝卜、甲盐的晶体。(实验室的室温为30℃,30℃甲盐的溶解度为50g)40.
过氧化钙晶体(CaO2•8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒.以贝壳为原料制备CaO2流程如下:
 (1)、气体X是CO2 , 其名称是;将过氧化钙晶体与溶液分离的方法是 .(2)、反应Y需控制温度在0~5℃,可将反应容器放在中,该反应是化合反应,反应产物是CaO2•8H2O,请写出化学方程式 .获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 .(3)、CaO2的相对分子质量为 ,过氧化钙晶体(CaO2•8H2O)中H、O元素的质量比为 .(4)、
(1)、气体X是CO2 , 其名称是;将过氧化钙晶体与溶液分离的方法是 .(2)、反应Y需控制温度在0~5℃,可将反应容器放在中,该反应是化合反应,反应产物是CaO2•8H2O,请写出化学方程式 .获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 .(3)、CaO2的相对分子质量为 ,过氧化钙晶体(CaO2•8H2O)中H、O元素的质量比为 .(4)、为测定制得的过氧化钙晶体中CaO2•8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2•8H2O
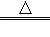 2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2•8H2O的质量分数(CaO2•8H2O相对分子质量为216),写出必要的计算过程.
2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2•8H2O的质量分数(CaO2•8H2O相对分子质量为216),写出必要的计算过程.