陕西省咸阳市武功县2022年中考三模化学试题
试卷更新日期:2022-09-08 类型:中考模拟
一、单选题
-
1. 因胃酸过多引起的胃病可用抗酸剂治疗。下列常用抗酸剂中,属于碱的是( )A、CaCO3 B、Al(OH)3 C、NaHCO3 D、MgO2. 下列相关防控“新冠”疫情的措施中发生了化学变化的是( )A、水银温度计测量体温 B、配制75%的医用酒精 C、喷洒含氯消毒液杀菌 D、裁剪喷绒布制作口罩3. 规范的操作是实验成功的基本保证,下列实验操作正确的是( )A、溶解固体
 B、测溶液pH
B、测溶液pH  C、添加锌粒
C、添加锌粒 D、连接仪器
D、连接仪器 4. 材料、能源、环境、健康与化学发展息息相关,下列说法正确的是( )A、在室内放一盆水,可防止煤气中毒 B、太阳能、水能、风能均属于不可再生能源 C、霉变的大米经高温蒸煮后可食用 D、回收废弃金属,既可节约资源,又能防止污染5. 五月端午粽飘香。粽子的香味源于粽叶的主要成分——对乙烯基苯酚(化学式为C8H8O)。下列说法错误的是( )A、对乙烯基苯酚的相对分子质量为120g B、对乙烯基苯酚由3种元素组成 C、对乙烯基苯酚分子中碳、氢原子的个数比为1:1 D、对乙烯基苯酚中碳元素的质量分数最大6. 化学实验现象千姿百态。下列实验过程中没有出现颜色变化的是( )A、稀盐酸除去铁锈 B、硫在氧气中燃烧 C、向氯化钠溶液中滴加酚酞试液 D、将活性炭加入红墨水中7. 下列除杂方法正确的是( )
4. 材料、能源、环境、健康与化学发展息息相关,下列说法正确的是( )A、在室内放一盆水,可防止煤气中毒 B、太阳能、水能、风能均属于不可再生能源 C、霉变的大米经高温蒸煮后可食用 D、回收废弃金属,既可节约资源,又能防止污染5. 五月端午粽飘香。粽子的香味源于粽叶的主要成分——对乙烯基苯酚(化学式为C8H8O)。下列说法错误的是( )A、对乙烯基苯酚的相对分子质量为120g B、对乙烯基苯酚由3种元素组成 C、对乙烯基苯酚分子中碳、氢原子的个数比为1:1 D、对乙烯基苯酚中碳元素的质量分数最大6. 化学实验现象千姿百态。下列实验过程中没有出现颜色变化的是( )A、稀盐酸除去铁锈 B、硫在氧气中燃烧 C、向氯化钠溶液中滴加酚酞试液 D、将活性炭加入红墨水中7. 下列除杂方法正确的是( )选项
物质(杂质)
加入的试剂和操作
A
Cu(Fe)
加入足量稀硫酸,过滤
B
N2(O2)
将气体通过灼热的CuO
C
K2CO3溶液(K2SO4)
加适量BaCl2溶液,过滤
D
CaCl2溶液(HCl)
加入过量熟石灰,过滤
A、A B、B C、C D、D8. 兴趣小组同学借助pH传感器监测溶液pH的变化情况探究稀盐酸和氢氧化钠溶液的反应。图1是反应装置,图2是反应过程中溶液的pH变化曲线。下列说法错误的是( )
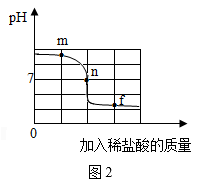 A、能说明稀盐酸与氢氧化钠溶液发生化学反应的现象是溶液由红色变为无色 B、实验过程中氯化钠的质量不断增大 C、曲线上的n点代表二者恰好完全反应 D、实验过程中氢氧化钠的质量不断减小直至为09. 甲、乙、丙、丁均为初中化学常见物质,它们之间的转化关系如图所示(部分反应物、生成物和反应条件已略去。“一”表示两端的物质能发生化学反应,“→”表示物质之间的一步转化关系)。下列说法错误的是( )
A、能说明稀盐酸与氢氧化钠溶液发生化学反应的现象是溶液由红色变为无色 B、实验过程中氯化钠的质量不断增大 C、曲线上的n点代表二者恰好完全反应 D、实验过程中氢氧化钠的质量不断减小直至为09. 甲、乙、丙、丁均为初中化学常见物质,它们之间的转化关系如图所示(部分反应物、生成物和反应条件已略去。“一”表示两端的物质能发生化学反应,“→”表示物质之间的一步转化关系)。下列说法错误的是( )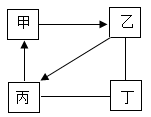 A、若甲是水,则丙可用于人工降雨 B、若乙是熟石灰,则甲转化成乙的反应可能是放热反应 C、若丙是二氧化碳,则丁可以是单质碳 D、若甲是氢氧化钠,乙是水,则甲与丁可以发生复分解反应
A、若甲是水,则丙可用于人工降雨 B、若乙是熟石灰,则甲转化成乙的反应可能是放热反应 C、若丙是二氧化碳,则丁可以是单质碳 D、若甲是氢氧化钠,乙是水,则甲与丁可以发生复分解反应二、填空题
-
10. 2022年5月10日,天舟四号货运飞船成功发射。这是2022年空间站建造任务的首次发射,正式开启了中国空间站全面建造的大幕。(1)、天舟四号货运飞船送去的食物中,蔬菜种类增加至32种。蔬菜中富含各种维生素,人体缺乏维生素A易引发的疾病是____(填字母)。A、夜盲症 B、坏血病 C、贫血 D、佝偻病(2)、航天员出舱活动时佩戴的反光镜采用光学级铝基碳化硅技术,铝基碳化硅是以铝合金为基体,碳化硅为增强材料制成的,它属于(填“合成”或“复合”)材料。(3)、飞船的壳体由铝合金制成。铝土矿经碱溶法制铝涉及反应: ,NaAlO2中铝元素的化合价为。(4)、航天员呼吸所需的氧气可通过电解水产生,电解水实验说明水由组成。11. 如图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和生成物已省略)。回答下列问题:
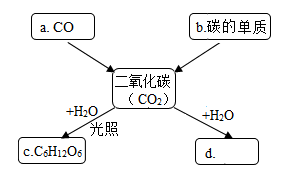 (1)、炭黑的主要成分是碳,用炭黑墨汁书写的字经久不变色,原因是。(2)、物质d的化学式为。(3)、 的过程是(填“光合作用”或“呼吸作用”)。(4)、空气中二氧化碳过多会引起温室效应,有研究指出可用地下盐水储存CO2: ,则X的化学式为。12. 2022年北京冬奥会国家速滑馆的二氧化碳跨临界直冷制冰技术取代了氟利昂这一类对环境污染较大的人工合成制冷剂。氟利昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)、炭黑的主要成分是碳,用炭黑墨汁书写的字经久不变色,原因是。(2)、物质d的化学式为。(3)、 的过程是(填“光合作用”或“呼吸作用”)。(4)、空气中二氧化碳过多会引起温室效应,有研究指出可用地下盐水储存CO2: ,则X的化学式为。12. 2022年北京冬奥会国家速滑馆的二氧化碳跨临界直冷制冰技术取代了氟利昂这一类对环境污染较大的人工合成制冷剂。氟利昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
回答下列问题:
(1)、写出臭氧的化学式。(2)、臭氧与氧气化学性质不同的原因是。(3)、反应①中的氯原子与反应③中的氯原子化学性质(填“相同”或“不同”)。(4)、反应②中的两种物质均由(填“分子”、“原子”或“离子”)构成。13. 如图1是KNO3、NaNO2和NaCl的溶解度曲线图。回答下列问题: (1)、60℃时,在50g水中加入40gNaCl固体,充分溶解后,所得溶液的溶质质量分数为(只列出表达式)。(2)、60℃时,分别将NaNO2、KNO3和NaCl的饱和溶液降温至25℃,所得溶液的溶质质量分数由大到小的顺序是。(3)、若KNO3溶液中混有NaCl,可采用(填“降温结晶”或“恒温蒸发溶剂)的方法提纯KNO3。(4)、如图2,试管中盛有饱和硝酸钾溶液,且试管底部有未溶解的固体。向烧杯中加入物质X后,观察到试管中的固体增加,则加入的物质可能是____(填字母)。A、食盐 B、氢氧化钠固体 C、食用油 D、硝酸铵固体14. 金属在生产、生活中应用广泛。(1)、金属铝虽然较活泼,但抗腐蚀性能好的原因是。(2)、炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,写出一氧化碳与氧化铁在高温下反应的化学方程式。(3)、从金、银、铁、铝混合金属中回收金、银。将混合金属放入一定量的硝酸银溶液中,充分反应后过滤,得到滤渣和浅绿色溶液,向滤渣中加入一定量稀盐酸,有气泡产生。则滤渣中一定含有的金属是(填化学式)。
(1)、60℃时,在50g水中加入40gNaCl固体,充分溶解后,所得溶液的溶质质量分数为(只列出表达式)。(2)、60℃时,分别将NaNO2、KNO3和NaCl的饱和溶液降温至25℃,所得溶液的溶质质量分数由大到小的顺序是。(3)、若KNO3溶液中混有NaCl,可采用(填“降温结晶”或“恒温蒸发溶剂)的方法提纯KNO3。(4)、如图2,试管中盛有饱和硝酸钾溶液,且试管底部有未溶解的固体。向烧杯中加入物质X后,观察到试管中的固体增加,则加入的物质可能是____(填字母)。A、食盐 B、氢氧化钠固体 C、食用油 D、硝酸铵固体14. 金属在生产、生活中应用广泛。(1)、金属铝虽然较活泼,但抗腐蚀性能好的原因是。(2)、炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,写出一氧化碳与氧化铁在高温下反应的化学方程式。(3)、从金、银、铁、铝混合金属中回收金、银。将混合金属放入一定量的硝酸银溶液中,充分反应后过滤,得到滤渣和浅绿色溶液,向滤渣中加入一定量稀盐酸,有气泡产生。则滤渣中一定含有的金属是(填化学式)。三、综合题
-
15. 已知固体混合物A由KCl、KNO3、CaCO3三种物质中的两种组成;固体混合物B由NH4Cl、CuO、CuCl2三种物质中的两种组成。为确定混合物的成分,进行如下实验:(假设过程中所有反应均恰好完全进行)
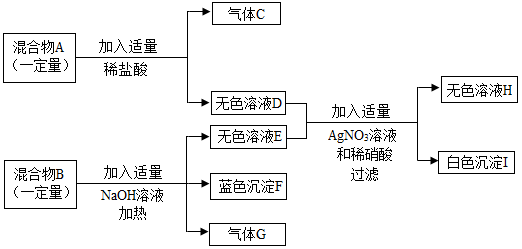
根据实验过程和现象,回答下列问题:
(1)、生成蓝色沉淀F的化学反应方程式为。(2)、下列说法错误的是(填序号)。①混合物B中一定含有的物质是NH4Cl、CuCl2
②气体G能使湿润的红色石蕊试纸变蓝
③无色溶液H中一定含有的溶质是Ca(NO3)2、AgNO3和NaCl
(3)、该实验方案(填“能”或“不能”)确定混合物A的组成成分。16. 实验室部分仪器或装置如图所示,回答下列问题: (1)、仪器B的名称为。(2)、若要组装一套实验室制备并收集二氧化碳的装置,可选择图中的(填字母),发生反应的化学方程式为。(3)、用装置I测定空气中氧气含量。实验过程中,活塞的移动情况是。红磷熄灭并冷却至室温后,活塞约停留在刻度处(已知试管容积为35mL)。17. 化学兴趣小组认为,在实验室可用氢氧化钠溶液吸收多余的二氧化碳,从而实现实验室二氧化碳的“零排放”。小组同学对吸收后溶液中溶质的成分产生兴趣并进行探究。
(1)、仪器B的名称为。(2)、若要组装一套实验室制备并收集二氧化碳的装置,可选择图中的(填字母),发生反应的化学方程式为。(3)、用装置I测定空气中氧气含量。实验过程中,活塞的移动情况是。红磷熄灭并冷却至室温后,活塞约停留在刻度处(已知试管容积为35mL)。17. 化学兴趣小组认为,在实验室可用氢氧化钠溶液吸收多余的二氧化碳,从而实现实验室二氧化碳的“零排放”。小组同学对吸收后溶液中溶质的成分产生兴趣并进行探究。【查阅资料】①CO2与NaOH溶液反应过程中,当CO2过量时,会继续反应生成NaHCO3;
②NaHCO3溶液呈弱碱性,一般不与CaCl2溶液反应,与稀盐酸反应产生气体;
③CaCl2溶液呈中性。
【提出问题】氢氧化钠溶液吸收二氧化碳气体后,溶液中溶质的成分是什么?
【作出猜想】
猜想①:NaOH、Na2CO3; 猜想②:Na2CO3;
猜想③:Na2CO3、NaHCO3; 猜想④:NaHCO3。
(1)、【进行实验】实验步骤
实验现象
实验结论
步骤1:取少量待测液于试管中,加入CaCl2溶液
产生白色沉淀
猜想不成立
步骤2:继续加入CaCl2溶液至不再产生沉淀,过滤,取滤液,向其中加入适量稀盐酸
猜想③不成立
步骤3:另取步骤2的少量滤液,向其中滴入无色酚酞试液
猜想①成立
(2)、【反思与交流】①写出步骤1中发生反应的化学方程式。
②如果去掉步骤2中的“加入适量稀盐酸”,上述实验的最终结论是否可靠?理由是。
(3)、【拓展延伸】“碳中和”是使碳排放与碳吸收达平衡,实现二氧化碳相对“零排放”。为了实现碳中和,下列做法错误的是____(填字母)。A、露天焚烧农作物秸秆以增加肥效 B、废旧书籍、报纸分类回收再利用 C、循环利用CO2制造燃料、尿素 D、大力植树造林,严禁乱砍滥伐森林四、计算题
-
18. 某课外活动小组同学取一定量铜与氧化铜的粉末固体混合物放入烧杯中,加入50 g稀硫酸,恰好完全反应,烧杯中固体的质量随时间变化情况如图所示。
 (1)、混合物中铜的质量是g。(2)、计算所用稀硫酸的溶质质量分数。
(1)、混合物中铜的质量是g。(2)、计算所用稀硫酸的溶质质量分数。