浙江省金华市金东区2020-2021学年九年级上学期科学期中检测试卷
试卷更新日期:2022-09-06 类型:期中考试
一、选择题(本大题共有15小题,每小题3分,共45分。每小题只有一个选项是正确的,不选、多选、错选均不得分)
-
1. 下列是生活中常见物质的pH范围,显碱性的是( )A、葡萄汁(3.5~4.5) B、鸡蛋清(7.6~8.0) C、纯牛奶(6.3~6.6) D、苹果汁(2.9~3.3)2. “垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝制的易拉罐、铜导线等都可以归为一类加以回收。它们属于( )A、化合物 B、非金属 C、金属或合金 D、金属3. 下图几种情景中,人做了功的是( )A、推车而未动
 B、搬而未起
B、搬而未起 C、拉物而升高
C、拉物而升高 D、提物水平而行
D、提物水平而行 4. 2019年我国发行了第五套人民币,伍角硬币材质由钢芯镀铜合金改为钢芯镀镍。选择铸造硬币的材料不需要考虑的因素是( )A、金属的耐腐蚀性 B、金属的导电性 C、金属的硬度 D、金属的耐磨性5. 下列有关酸的性质说法正确的是( )A、浓盐酸和浓硫酸盛放在敞口容器中,质量都会减少 B、浓盐酸、浓硫酸都能使纸张炭化 C、浓盐酸、浓硫酸都可用来干燥二氧化碳 D、稀盐酸和稀硫酸都可用于除铁锈6. 碳酸钠(Na2CO3)俗称纯碱,是一种重要的化工原料。该原料在物质分类中属于( )A、有机物 B、混合物 C、碱 D、盐7. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、③⑤ C、①②③ D、②③④8. 番茄,又名西红柿,在欧洲又叫“爱情果”。某实验室配制番茄的无土栽培的营养液时,要用到KNO3做化肥,化肥KNO3是一种( )A、钾肥 B、磷肥 C、氮肥 D、复合肥料9. 下列属于置换反应的是( )A、H2+CuO Cu+H2O B、2KMnO4 K2MnO4+MnO2+O2↑ C、HCl+NaOH=NaCl+H2O D、2Mg+O2 2MgO10. 实验室中,药品的存放必须符合一定的规则。下列存放药品时所选择的仪器及存放方式正确的是( )A、
4. 2019年我国发行了第五套人民币,伍角硬币材质由钢芯镀铜合金改为钢芯镀镍。选择铸造硬币的材料不需要考虑的因素是( )A、金属的耐腐蚀性 B、金属的导电性 C、金属的硬度 D、金属的耐磨性5. 下列有关酸的性质说法正确的是( )A、浓盐酸和浓硫酸盛放在敞口容器中,质量都会减少 B、浓盐酸、浓硫酸都能使纸张炭化 C、浓盐酸、浓硫酸都可用来干燥二氧化碳 D、稀盐酸和稀硫酸都可用于除铁锈6. 碳酸钠(Na2CO3)俗称纯碱,是一种重要的化工原料。该原料在物质分类中属于( )A、有机物 B、混合物 C、碱 D、盐7. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、③⑤ C、①②③ D、②③④8. 番茄,又名西红柿,在欧洲又叫“爱情果”。某实验室配制番茄的无土栽培的营养液时,要用到KNO3做化肥,化肥KNO3是一种( )A、钾肥 B、磷肥 C、氮肥 D、复合肥料9. 下列属于置换反应的是( )A、H2+CuO Cu+H2O B、2KMnO4 K2MnO4+MnO2+O2↑ C、HCl+NaOH=NaCl+H2O D、2Mg+O2 2MgO10. 实验室中,药品的存放必须符合一定的规则。下列存放药品时所选择的仪器及存放方式正确的是( )A、 B、
B、 C、
C、 D、
D、 11. 人造地球卫星绕地球从近地点向远地点运动时,下列说法正确的是( )
11. 人造地球卫星绕地球从近地点向远地点运动时,下列说法正确的是( ) A、势能变小 B、动能不变 C、动能转化为重力势能 D、机械能变小12. 下列试剂中,不能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是( )A、碳酸钠 B、pH 试纸 C、碳酸钙 D、石蕊溶液13. 下列四个实验中,不能体现碱的通性的是( )A、
A、势能变小 B、动能不变 C、动能转化为重力势能 D、机械能变小12. 下列试剂中,不能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是( )A、碳酸钠 B、pH 试纸 C、碳酸钙 D、石蕊溶液13. 下列四个实验中,不能体现碱的通性的是( )A、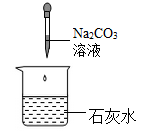 B、
B、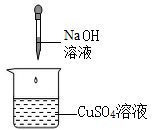 C、
C、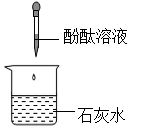 D、
D、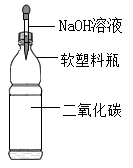 14. 某科学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作。其中可以达到实验目的组合是( )
14. 某科学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作。其中可以达到实验目的组合是( ) A、①③ B、②④ C、④⑤ D、①②15. 下列物质间的转化只有加入酸才能一步实现的是( )A、Zn→ZnSO4 B、CuO→CuCl2 C、CaCO3→CO2 D、BaCl2→BaSO4
A、①③ B、②④ C、④⑤ D、①②15. 下列物质间的转化只有加入酸才能一步实现的是( )A、Zn→ZnSO4 B、CuO→CuCl2 C、CaCO3→CO2 D、BaCl2→BaSO4二、填空题(本大题共有10小题,每小题4分,共40分)
-
16. 某火力发电站附近农作物产量急剧下降。经科技人员检测发现:附近雨水pH约为5.0,土壤pH约为5.4。已知一些主要农作物适宜生长的土壤pH如下:
农作物
玉米
小麦
马铃薯
pH
6~7
6.3~7.5
4.8~5.5
(1)、根据数据,该土壤最适合种植的农作物是。(2)、要改良酸性土壤应选择一种适合的碱,这种碱是(填化学式)。17. 铁与我们的生活息息相关。(1)、铁制锅铲要套上木质手柄,原因是铁具有良好的性。(2)、与纯金属相比,合金具有更多优良性能,例如钢比纯铁的硬度(选填“大”或“小”)。18. 2020年5月5日,我国自主研发的长征5号B型运载火箭圆满完成发射任务。右图为起飞阶段加速上升的火箭,该过程中,内部的新型返回舱的动能(选填“增大”、“减小”或“不变”)。在返回舱返回地面的过程中会与大气摩擦,返回舱的部分机械能转化为能。 19. 室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液的质量而变化的曲线如图所示:
19. 室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液的质量而变化的曲线如图所示: (1)、由图可知,氢氧化钠溶液与盐酸反应是(填“吸热”或“放热”或“无热量变化”)反应。(2)、B到C的过程中溶液的pH逐渐(填“增大”或“减小”或“无变化”)。20. 对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“—”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)、由图可知,氢氧化钠溶液与盐酸反应是(填“吸热”或“放热”或“无热量变化”)反应。(2)、B到C的过程中溶液的pH逐渐(填“增大”或“减小”或“无变化”)。20. 对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“—”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。 (1)、已知X是金属单质,则X可以是 (填一种即可)。(2)、请写出稀硫酸与Y反应的一个化学方程式:。21. 某同学设计了利用废旧电池中的锌皮制取干燥、纯净的氢气,并验证该气体中杂质的实验。请回答下列问题:
(1)、已知X是金属单质,则X可以是 (填一种即可)。(2)、请写出稀硫酸与Y反应的一个化学方程式:。21. 某同学设计了利用废旧电池中的锌皮制取干燥、纯净的氢气,并验证该气体中杂质的实验。请回答下列问题: (1)、若实验中看到现象,可证明产生的气体中含有水蒸气;(2)、除此之外还可能含有其他气体杂质,如果用E装置检验该杂质,则E应连接在上述装置中(填字母)之间。22. 如图所示是“探究物体的动能跟哪些因素有关”的实验装置示意图,让小球A从斜面上某点滚下,撞击在水平面上的木块B,木块B移动一段距离。
(1)、若实验中看到现象,可证明产生的气体中含有水蒸气;(2)、除此之外还可能含有其他气体杂质,如果用E装置检验该杂质,则E应连接在上述装置中(填字母)之间。22. 如图所示是“探究物体的动能跟哪些因素有关”的实验装置示意图,让小球A从斜面上某点滚下,撞击在水平面上的木块B,木块B移动一段距离。 (1)、实验表明,让小球A分别从斜槽不同高度由静止滚下,高度越大,速度越大,木块B被撞得越远。可得结论:质量相同时,小球的速度越大,越大。(2)、若要研究物体动能与质量的关系,应让不同质量的小球A从斜面高度由静止滚下,观察比较木块B被撞移动的距离。23. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。
(1)、实验表明,让小球A分别从斜槽不同高度由静止滚下,高度越大,速度越大,木块B被撞得越远。可得结论:质量相同时,小球的速度越大,越大。(2)、若要研究物体动能与质量的关系,应让不同质量的小球A从斜面高度由静止滚下,观察比较木块B被撞移动的距离。23. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。 24. 为了激发学生学习科学的兴趣,老师在课堂上为大家做了一个“燃烧成铁”的趣味实验。将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液湿润,在酒精灯上烘干后点燃。滤纸变黑、红热,最终生成黑褐色物质。老师告诉大家,黑褐色物质中含有单质铁。小阳同学对此进行了分析验证。(1)、从反应物的组成分析,因为有元素,反应后可能生成单质铁。(2)、将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生,也可初步证明该黑褐色物质中含有单质铁。请写出相关的化学方程式:。
24. 为了激发学生学习科学的兴趣,老师在课堂上为大家做了一个“燃烧成铁”的趣味实验。将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液湿润,在酒精灯上烘干后点燃。滤纸变黑、红热,最终生成黑褐色物质。老师告诉大家,黑褐色物质中含有单质铁。小阳同学对此进行了分析验证。(1)、从反应物的组成分析,因为有元素,反应后可能生成单质铁。(2)、将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生,也可初步证明该黑褐色物质中含有单质铁。请写出相关的化学方程式:。
证明黑褐色物质中有单质铁有多种方法,比如可以用磁铁吸引等。25. 有一包白色固体,可能由BaCl2、NaCl、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,进行如下实验。实验过程中所加试剂均足量,实验过程及现象如图所示。 (1)、白色沉淀A的化学式为。(2)、这包白色固体中肯定有的物质是。
(1)、白色沉淀A的化学式为。(2)、这包白色固体中肯定有的物质是。三、实验探究题(本大题共有5小题,26题7分,28、29题每小题6分,27、30题每小题8分,共35分)
-
26. 某同学为了探究木炭和氧化铜在高温条件下生成的气体产物的成分,提出了如下猜想:
a.可能是二氧化碳;
b.可能是一氧化碳。
并设计如图所示装置进行实验,预期的实验现象及结论如下:

Ⅰ.若澄清的石灰水变浑浊,则气体为二氧化碳;
Ⅱ.若澄清的石灰水不变浑浊,则气体为一氧化碳。请你分析并回答:
(1)、该同学的猜想不够严谨,可以补充猜想c:;(2)、该实验装置存在的缺陷是:;(3)、反应结束时,停止实验的操作步骤是:;(4)、实验后发现试管①内壁上附着不易用试管刷洗净的固体生成物,适合清洗试管①的试剂是:。27. 铜跟浓硫酸的反应原理是Cu+2H2SO4CuSO4+SO2↑+2H2O。某小组同学用下图所示装置制取硫酸铜。请回答以下问题: (1)、图中乙装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,下列导管补画完整的图中,符合要求的是。
(1)、图中乙装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,下列导管补画完整的图中,符合要求的是。 (2)、图中丙装置的作用是防止氢氧化钠溶液倒吸入乙瓶中。装置丁的作用是。(3)、充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、用滤液做了如下实验。
(2)、图中丙装置的作用是防止氢氧化钠溶液倒吸入乙瓶中。装置丁的作用是。(3)、充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、用滤液做了如下实验。实验1:用pH试纸测试滤液pH,其中pH约为1。
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
能说明硫酸有剩余的是。(选填“实验1”或“实验2”)
(4)、以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有。28. 同学们所用的笔,有些在靠近笔端的地方装有一个轻质弹簧(如图所示)。小文和小军各自拿自己装有弹簧的笔玩弹笔游戏。结果发现小军的笔弹得高一些,小文分析:笔弹起的高度与笔内弹簧的弹性势能的大小有关,那么弹簧弹性势能的大小又跟什么因素有关呢?小文猜想:
①弹簧弹性势能的大小可能跟它的材料有关;
②弹簧弹性势能的大小可能跟它弹性形变的程度有关。
(1)、小文利用两个外形完全相同但材料不同的弹簧A和B、一个小钢球、一个轻木块,在同一水平面上进行了如下图所示的实验,此实验是为了验证猜想 , 实验中弹性势能的大小是通过来体现的。 (2)、小文设计了一个实验方案来验证另一个猜想:
(2)、小文设计了一个实验方案来验证另一个猜想:步骤:
a.将小球置于弹簧A右端,使弹簧压缩2cm,放手后小球弹出,与木块相碰,木块推动的距离为s1;
b.将同一个弹簧压缩的程度稍大一些,把小球置于弹簧A右端,观察小球撞击木块后木块移动的距离s2。比较s1、s2得出结论:
若s1s2(选填:>或<)说明弹簧弹性形变的程度越大,弹性势能越大。
29. 一次实验中,小明不小心把硫酸铜溶液滴加到了盛有5%过氧化氢的溶液中,发现立即有大量气泡产生(如图①)。硫酸铜溶液中有三种不同的粒子(H2O,SO42- , Cu2+),小明想知道硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快。请你和小明一起通过如图所示的三个实验完成这次探究活动,并回答有关问题。(查阅资料:Cl-不能使双氧水分解的速率加快) (1)、你认为最不可能的一种粒子是:。(2)、要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③;在实验②中加入稀硫酸后,无明显变化,说明不起催化作用;(3)、在实验③中加入溶液后,会观察到大量气泡,证明起催化作用的是Cu2+。
(1)、你认为最不可能的一种粒子是:。(2)、要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③;在实验②中加入稀硫酸后,无明显变化,说明不起催化作用;(3)、在实验③中加入溶液后,会观察到大量气泡,证明起催化作用的是Cu2+。
小明如果要确定硫酸铜是催化剂,还需通过实验确认它在反应前后化学性质和质量都没有改变。30. 已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳(2NaHCO3Na2CO3+H2O+CO2↑);而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3 , 某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案:
方案一:样品 测定生成CO2的质量。
(1)、本实验采用如图所示的装置,C中盛放的物质是。(2)、若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,(填“能”或“不能”)准确测定样品中NaHCO3的质量分数。方案二:样品测定剩余固体质量。
具体操作步骤如下:
①取一只洁净的坩埚,质量为21.2克。向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(3)、实验时需要重复“加热、冷却、称量”操作多次,其目的是。(4)、根据题意,可计算样品中NaHCO3的质量分数为。四、解答题(本大题共有5小题,每小题8分,共40分)
-
31. 氯气可与氢氧化钠溶液反应,其反应的化学方程式为:2NaOH+Cl2═NaClO+NaCl+H2O,其中生成的次氯酸钠(NaClO)易溶于水,为“84”消毒液的有效成分。现向某100g氢氧化钠溶液中通入一定量氯气,使之与氢氧化钠恰好完全反应,反应后的溶液质量为107.1g。请计算:(1)、参加反应的氯气质量为g。(2)、反应生成次氯酸钠的质量(请写出计算过程)。32. 如图所示,质量为50kg的同学在做仰卧起坐运动。若该同学上半身的质量约为全身质量的35%,她在一分钟内做了40个仰卧起坐,每次上半身重心上升的距离均为0.3m。求:
 (1)、每做一个仰卧起坐,克服重力做的功是多大。(2)、她在这段时间内做功的功率的大小。33. 向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)、每做一个仰卧起坐,克服重力做的功是多大。(2)、她在这段时间内做功的功率的大小。33. 向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求: (1)、此过程中产生氢气的最大质量是克。(2)、锌粉中锌的质量分数为多少。(请写出计算过程)34. 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。科学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
(1)、此过程中产生氢气的最大质量是克。(2)、锌粉中锌的质量分数为多少。(请写出计算过程)34. 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。科学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配置成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
(1)、若该瓶试剂中的Na2CO3质量分数为A,则氢氧化钠的质量分数(选填“大于”“等于”或“小于”)(1—A),原因是。(2)、计算该20g试剂中含有杂质Na2CO3的质量分数(结果精确到0.1%)。35. 查阅资料已知:氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味;
氨气和氯化氢发生反应生成氯化铵为白色固体,氯化铵溶液呈酸性;
相对分子质量越小的分子运动速度越快。

某兴趣小组做了如下实验:将一支约35厘米长的玻璃管水平放置,将一小块浸有无色酚酞试液的滤纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图)。
请你推断该实验中可以观察到的现象,并说明理由。