湖北省宜昌市2021-2022学年高一上学期期中考试化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 下列各组物质中,按单质、化合物、混合物的顺序排列的是( )A、铁、四氧化三铁、冰水混合物 B、氯气、小苏打、纯净的空气 C、水银、纯碱、五水合硫酸铜 D、水蒸气、硫酸、酒精2. 下列物质中,属于酸的是( )A、Na2O B、NaOH C、MgCl2 D、H2SO43. 下列各组物质不互为同素异形体的是( )A、钢和铁 B、金刚石和石墨 C、红磷和白磷 D、氧气和臭氧4. 下列物质中,符合图中阴影部分表示的分类标准的是( )
 A、CO B、SO2 C、SiO2 D、H2O25. 利用交叉分类法可对物质从不同角度进行分类。NaOH、Na2CO3、NaHCO3、NaCl、Na2SO4可按某种标准划分为同一类物质,下列分类标准正确的是( )
A、CO B、SO2 C、SiO2 D、H2O25. 利用交叉分类法可对物质从不同角度进行分类。NaOH、Na2CO3、NaHCO3、NaCl、Na2SO4可按某种标准划分为同一类物质,下列分类标准正确的是( )①钠的化合物 ②能与硝酸反应的物质 ③电解质 ④钠盐 ⑤钠的含氧化合物
A、①④ B、③④ C、②⑤ D、①③6. 下列物质中,属于电解质是( )A、Cu丝 B、盐酸 C、NaCl D、蔗糖7. 配制一定体积的1.00 mol/LNaCl溶液,不需要使用的仪器是( )A、 B、
B、 C、
C、 D、
D、 8. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、Fe(OH)3胶体 C、NaOH溶液 D、CuSO4溶液9. 根据离子反应发生的条件,判断下列各组物质中不能发生离子反应的是( )A、H2SO4溶液与BaCl2溶液 B、NaOH溶液与CuSO4溶液 C、Na2CO3溶液与HNO3溶液 D、NaOH溶液与KCl溶液10. 能用H++OH-=H2O来表示的化学反应是( )A、氢氧化镁和稀盐酸反应 B、Ba(OH)2溶液滴入稀硫酸中 C、澄清石灰水和稀硝酸反应 D、二氧化碳通入澄清石灰水中11. 下列离子方程式正确的是( )A、氢氧化钡溶液与盐酸反应:OH-+H+=H2O B、铁投入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ C、氯气与水反应:Cl2 + H2O = 2H+ + Cl-+ ClO- D、铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag12. 下列反应中,属于氧化还原反应的是( )A、NH3+HCl=NH4Cl B、Cu+2FeCl3=CuCl2+2FeCl2 C、2NaHCO3Na2CO3+CO2↑+H2O D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO413. 下列变化中需要加入氧化剂才能实现的是。( )A、 B、 C、 D、14. 下列各组离子能在溶液中大量共存的是( )A、Na+、Mg2+、Cl-、OH- B、H+、Ca2+、CO、NO C、Cu2+、K+、SO、NO D、Na+、HCO、OH-、Ca2+15. 下列关于氧化还原反应与四种基本反应类型的关系,说法正确的是( )A、化合反应都是氧化还原反应 B、有单质生成的分解反应一定是氧化还原反应 C、有一些置换反应不是氧化还原反应 D、有氧元素参与的复分解反应是氧化还原反应16. 对于反应,下列说法错误的是( )A、Fe是还原剂,被氧化 B、HCl是氧化剂,发生了还原反应 C、−1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂 D、此反应既是置换反应又是氧化还原反应17. 将绿豆大小的钠投入CuSO4溶液中,下列有关现象的描述错误的是( )A、Na浮在水面,四处游动 B、有红色固体生成 C、有蓝色沉淀生成 D、溶液颜色变浅18. 下列关于金属钠的叙述,正确的是( )。A、钠在空气中燃烧,发出黄色火焰 B、钠在空气中燃烧,产物是 C、钠是银白色金属,硬度大,熔点高 D、钠的化学性质比铁、铝活泼得多,但没有镁活泼19. 下列实验方案中,能鉴别固体Na2CO3和NaHCO3的是( )A、分别进行焰色试验,观察火焰的颜色 B、取少量固体分别装入试管后充分加热,称量反应前后质量变化 C、取少量固体分别加入足量的稀硫酸中,观察是否有气体生成 D、取少量固体分别加水溶解后,滴入澄清石灰水,观察是否有沉淀生成20. 下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )A、CuCl2 B、FeCl2 C、MgCl2 D、FeCl321. 将100mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后,溶液中NaOH的物质的量浓度为( )A、0.3 mol/L B、0.03 mol/L C、0.05mol/L D、0.1mol/L22. 下列关于胶体的叙述中,错误的是( )A、胶体能吸附水中的悬浮颗粒并沉降,常用于净水 B、浊液、胶体、溶液的本质区别是分散质粒子的直径大小 C、用激光笔照射溶液和胶体时,产生的现象相同 D、胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径在之间23. 下列叙述中,正确的是( )A、1 molH2O2中含有1 mol H2和1 mol O2 B、CaCO3的摩尔质量是100 g C、等质量的CO与N2中所含原子数之比为1:1 D、1L 1 mol·L-1MgCl2溶液中Cl- 的物质的量为1 mol24. 下列各组物质中,所含分子数不相同的是( )A、8gO2和8gH2 B、5.6LN2(标准状况)和11gCO2 C、9gH2O和0.5molBr2 D、2.24LH2(标准状况)和0.1molN225. 0.5L1 mol∙L−1FeCl3溶液与0.2L1 mol∙L−1KCl溶液中的Cl-数目之比( )A、5∶2 B、15∶2 C、3∶1 D、1∶126. 根据反应:①2Fe2+ +Br2 =2Fe3+ +2Br- , ②2Br- +Cl2=Br2 + 2Cl- , ③2Fe3++2I- =2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是( )A、Cl2>Br2>Fe3+>I2 B、Br2>Fe3+>Cl2>I2 C、Cl2>Br2>I2>Fe3+ D、I2>Fe3+> Br2>Cl227. 下列说法错误的是( )A、液氯是纯净物而氯水是混合物 B、氯水久置后颜色变浅,酸性增强 C、新制氯水可使红色石蕊试纸先变蓝后褪色 D、氯水宜现配现用,不适宜久置,主要是因为次氯酸不稳定,见光易分解28. 宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2=2X+2H2O,下列说法错误的是( )A、X的化学式为Ag2S B、银针验毒时,空气中氧气得到电子 C、反应中Ag和H2S均是还原剂 D、每生成1 mol X,反应转移2 mol e-
8. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、Fe(OH)3胶体 C、NaOH溶液 D、CuSO4溶液9. 根据离子反应发生的条件,判断下列各组物质中不能发生离子反应的是( )A、H2SO4溶液与BaCl2溶液 B、NaOH溶液与CuSO4溶液 C、Na2CO3溶液与HNO3溶液 D、NaOH溶液与KCl溶液10. 能用H++OH-=H2O来表示的化学反应是( )A、氢氧化镁和稀盐酸反应 B、Ba(OH)2溶液滴入稀硫酸中 C、澄清石灰水和稀硝酸反应 D、二氧化碳通入澄清石灰水中11. 下列离子方程式正确的是( )A、氢氧化钡溶液与盐酸反应:OH-+H+=H2O B、铁投入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ C、氯气与水反应:Cl2 + H2O = 2H+ + Cl-+ ClO- D、铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag12. 下列反应中,属于氧化还原反应的是( )A、NH3+HCl=NH4Cl B、Cu+2FeCl3=CuCl2+2FeCl2 C、2NaHCO3Na2CO3+CO2↑+H2O D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO413. 下列变化中需要加入氧化剂才能实现的是。( )A、 B、 C、 D、14. 下列各组离子能在溶液中大量共存的是( )A、Na+、Mg2+、Cl-、OH- B、H+、Ca2+、CO、NO C、Cu2+、K+、SO、NO D、Na+、HCO、OH-、Ca2+15. 下列关于氧化还原反应与四种基本反应类型的关系,说法正确的是( )A、化合反应都是氧化还原反应 B、有单质生成的分解反应一定是氧化还原反应 C、有一些置换反应不是氧化还原反应 D、有氧元素参与的复分解反应是氧化还原反应16. 对于反应,下列说法错误的是( )A、Fe是还原剂,被氧化 B、HCl是氧化剂,发生了还原反应 C、−1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂 D、此反应既是置换反应又是氧化还原反应17. 将绿豆大小的钠投入CuSO4溶液中,下列有关现象的描述错误的是( )A、Na浮在水面,四处游动 B、有红色固体生成 C、有蓝色沉淀生成 D、溶液颜色变浅18. 下列关于金属钠的叙述,正确的是( )。A、钠在空气中燃烧,发出黄色火焰 B、钠在空气中燃烧,产物是 C、钠是银白色金属,硬度大,熔点高 D、钠的化学性质比铁、铝活泼得多,但没有镁活泼19. 下列实验方案中,能鉴别固体Na2CO3和NaHCO3的是( )A、分别进行焰色试验,观察火焰的颜色 B、取少量固体分别装入试管后充分加热,称量反应前后质量变化 C、取少量固体分别加入足量的稀硫酸中,观察是否有气体生成 D、取少量固体分别加水溶解后,滴入澄清石灰水,观察是否有沉淀生成20. 下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )A、CuCl2 B、FeCl2 C、MgCl2 D、FeCl321. 将100mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后,溶液中NaOH的物质的量浓度为( )A、0.3 mol/L B、0.03 mol/L C、0.05mol/L D、0.1mol/L22. 下列关于胶体的叙述中,错误的是( )A、胶体能吸附水中的悬浮颗粒并沉降,常用于净水 B、浊液、胶体、溶液的本质区别是分散质粒子的直径大小 C、用激光笔照射溶液和胶体时,产生的现象相同 D、胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径在之间23. 下列叙述中,正确的是( )A、1 molH2O2中含有1 mol H2和1 mol O2 B、CaCO3的摩尔质量是100 g C、等质量的CO与N2中所含原子数之比为1:1 D、1L 1 mol·L-1MgCl2溶液中Cl- 的物质的量为1 mol24. 下列各组物质中,所含分子数不相同的是( )A、8gO2和8gH2 B、5.6LN2(标准状况)和11gCO2 C、9gH2O和0.5molBr2 D、2.24LH2(标准状况)和0.1molN225. 0.5L1 mol∙L−1FeCl3溶液与0.2L1 mol∙L−1KCl溶液中的Cl-数目之比( )A、5∶2 B、15∶2 C、3∶1 D、1∶126. 根据反应:①2Fe2+ +Br2 =2Fe3+ +2Br- , ②2Br- +Cl2=Br2 + 2Cl- , ③2Fe3++2I- =2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是( )A、Cl2>Br2>Fe3+>I2 B、Br2>Fe3+>Cl2>I2 C、Cl2>Br2>I2>Fe3+ D、I2>Fe3+> Br2>Cl227. 下列说法错误的是( )A、液氯是纯净物而氯水是混合物 B、氯水久置后颜色变浅,酸性增强 C、新制氯水可使红色石蕊试纸先变蓝后褪色 D、氯水宜现配现用,不适宜久置,主要是因为次氯酸不稳定,见光易分解28. 宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2=2X+2H2O,下列说法错误的是( )A、X的化学式为Ag2S B、银针验毒时,空气中氧气得到电子 C、反应中Ag和H2S均是还原剂 D、每生成1 mol X,反应转移2 mol e-二、填空题
-
29. 钠元素在自然界都以化合物的形式存在。(1)、过氧化钠中氧元素的化合价为价,焰色试验为色。(2)、过氧化钠用于呼吸面具的反应方程式为 , , 若有2mol的过氧化钠参与反应,转移的电子的物质的量为mol。30. 回答下列问题。(1)、现有下列物质:①②液态氯化氢③④熔融NaOH⑤固体⑥氨水
请用序号回答下列问题:能导电的是 , 属于电解质的是 , 属于非电解质的是。
(2)、个分子的物质的量为mol,共含个氢原子。将上述溶于水配成600mL溶液,再加水稀释到1000mL,稀释后溶液的物质的量浓度为mol/L。(3)、标准状况下,1.7g的体积为L。(4)、15.6g中含0.4mol的 , 则R的相对原子质量是。31. 某学习小组用如图所示装置制备氯水并对其成分进行探究,请回答下列问题: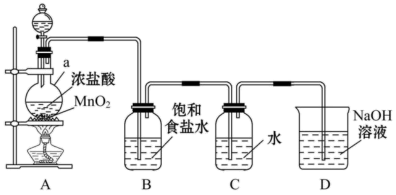 (1)、仪器a的名称是。(2)、实验室制取氯气的化学方程式是 , 该反应中氧化剂是 , 装置B的作用是除去氯气中混有的。(3)、装置D的作用是 , 反应的离子方程式为。32. 某同学欲用固体配制100mL 0.5的溶液。回答下列问题:(1)、配制溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、。(2)、应用托盘天平称取固体质量为。(3)、不规范的操作会引起误差,下列操作会导致实验结果偏高的是____(填序号)。A、溶解过程中有少量液体溅出烧杯外 B、实验过程中未洗涤烧杯和玻璃棒 C、加水定容时俯视容量瓶的刻度线 D、容量瓶内壁附有水珠而未干燥处理
(1)、仪器a的名称是。(2)、实验室制取氯气的化学方程式是 , 该反应中氧化剂是 , 装置B的作用是除去氯气中混有的。(3)、装置D的作用是 , 反应的离子方程式为。32. 某同学欲用固体配制100mL 0.5的溶液。回答下列问题:(1)、配制溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、。(2)、应用托盘天平称取固体质量为。(3)、不规范的操作会引起误差,下列操作会导致实验结果偏高的是____(填序号)。A、溶解过程中有少量液体溅出烧杯外 B、实验过程中未洗涤烧杯和玻璃棒 C、加水定容时俯视容量瓶的刻度线 D、容量瓶内壁附有水珠而未干燥处理