湖北省石首市2021-2022学年高一上学期期中考试化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 钠元素广泛存在于自然界,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列关于含钠元素物质的说法错误的是( )A、“稻草变黄金”的过程中元素种类没有改变 B、NaCl与Na2CO3灼烧时火焰颜色相同 C、治疗胃酸过多可以用NaHCO3 , 糕点生产也可以用NaHCO3 D、金属钠放置空气中,最终会变成Na2O22. “分类”始出《书·舜典》附亡《书》序:"帝厘下土,方设居方,别生分.类.,作《汩作》。面对纷繁复杂的物质世界,分类是一种行之有效的方法。下列物质分类的正确组合是( )
碱
酸
盐
碱性氧化物
强电解质
A
Cu2(OH)2CO3
H2SO4
NaHCO3
CuO
CO2
B
NaOH
HCl
NaCl
Na2O
食盐水
C
NaOH
NH3
CaCl2
MgO
酒精
D
KOH
HNO3
胆矾
CaO
熔融硝酸钾
A、A B、B C、C D、D3. 下列除杂所用试剂或操作不合理的是( )选项
物质(括号中为杂质)
除杂试剂
操作
A
Cl2(HCl)
饱和食盐水
洗气
B
BaSO4(BaCO3)
稀盐酸
溶解、过滤、洗涤、干燥
C
CO2(HCl)
NaOH溶液
洗气
D
Na2CO3(NaHCO3)
/
加热
A、A B、B C、C D、D4. 分类方法在化学学科的发展中起到了非常重要的作用,下列4种分类标准中合理的是( )A、根据物质在水溶液里或熔融状态下能否导电,将物质分为电解质和非电解质 B、根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物 C、根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应 D、根据酸中含有的氢原子个数将酸分为一元酸、二元酸和多元酸等5. 下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量共存的是( )A、K+、Na+、Cl-、SO B、Ca2+、Fe3+、NO、Cl- C、Ba2+、Na+、I-、NO D、NH、Fe2+、Cl-、NO6. 从矿物学资料查得,一定条件下自然界中存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是( )A、Cu2S既是氧化产物又是还原产物 B、参与反应的FeS2与转移电子数之比为1:2 C、FeS2只作还原剂 D、产物中的有一部分是氧化产物7. 下列关于离子方程式书写正确的是( )A、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ B、向氢氧化钡溶液中加入过量硫酸:Ba2++OH-+H++SO=BaSO4↓+H2O C、向NaClO溶液中通入少量二氧化碳的离子方程式2ClO-+CO2+H2O=2HClO+CO D、向澄清石灰水中加入过量的小苏打溶液:Ca2++2OH-+2HCO=CaCO3↓+CO+2H2O8. 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl- , 则下列反应不可能发生的是( )A、 B、 C、 D、9. 科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠 (NaAuCl4)溶液与泪液中的葡萄糖发生反应,生成纳米金单质颗粒(直径为)。下列有关说法错误的是( )A、氯金酸钠中金元素的化合价为 B、检测时,葡萄糖发生了还原反应 C、在反应中体现氧化性 D、纳米金单质颗粒分散在水中所得的分散系属于胶体10. 如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )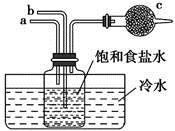 A、a通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉11. 在2020年抗击新型冠状病毒的战役中,与氯元素有关的化学品发挥了重要作用。下列有关说法正确的是( )A、84消毒液和洁厕灵混用会生成有毒有害的物质 B、氢气在氯气中燃烧产生苍白色的烟 C、Cl2以液态形式存在时可称为氯水或液氯 D、氯元素有毒,应禁入口中12. 人体血液中葡萄糖()浓度的正常参考值是()。下列说法正确的是( )A、葡萄糖的摩尔质量为180 B、标准状况下,葡萄糖中含有的分子数约为 C、葡萄糖水溶液中含有的碳原子数约为 D、若某人血液中葡萄糖检查结果为 , 可诊断为低血糖13. 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2 , 右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A、a通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉11. 在2020年抗击新型冠状病毒的战役中,与氯元素有关的化学品发挥了重要作用。下列有关说法正确的是( )A、84消毒液和洁厕灵混用会生成有毒有害的物质 B、氢气在氯气中燃烧产生苍白色的烟 C、Cl2以液态形式存在时可称为氯水或液氯 D、氯元素有毒,应禁入口中12. 人体血液中葡萄糖()浓度的正常参考值是()。下列说法正确的是( )A、葡萄糖的摩尔质量为180 B、标准状况下,葡萄糖中含有的分子数约为 C、葡萄糖水溶液中含有的碳原子数约为 D、若某人血液中葡萄糖检查结果为 , 可诊断为低血糖13. 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2 , 右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( ) A、右边CO和CO2分子数之比为1:3 B、右边CO的质量为14g C、右边气体密度是相同条件下氧气密度的2倍 D、若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:614. 向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液。分别向四瓶溶液中逐滴加入等浓度的盐酸,产生的气体体积V(CO2)与所加盐酸体积V(HCl)的关系如图所示,且图②③④中分别有OA<AB、OA=AB、OA>AB则下列分析与判断正确的是(忽略CO2的溶解)( )
A、右边CO和CO2分子数之比为1:3 B、右边CO的质量为14g C、右边气体密度是相同条件下氧气密度的2倍 D、若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:614. 向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液。分别向四瓶溶液中逐滴加入等浓度的盐酸,产生的气体体积V(CO2)与所加盐酸体积V(HCl)的关系如图所示,且图②③④中分别有OA<AB、OA=AB、OA>AB则下列分析与判断正确的是(忽略CO2的溶解)( ) A、①中通入的CO2最少 B、③中的溶质只有Na2CO3 C、有两种溶质的是②和③ D、④中OA段只发生中和反应15. 某结晶水合物的化学式为 R•nH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中错误的是( )A、该溶液中溶质的质量分数为 w= B、该溶液的物质的量浓度为 c= C、25 ℃时 R 的溶解度为 S= g D、该溶液的密度为 ρ=g/mL
A、①中通入的CO2最少 B、③中的溶质只有Na2CO3 C、有两种溶质的是②和③ D、④中OA段只发生中和反应15. 某结晶水合物的化学式为 R•nH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中错误的是( )A、该溶液中溶质的质量分数为 w= B、该溶液的物质的量浓度为 c= C、25 ℃时 R 的溶解度为 S= g D、该溶液的密度为 ρ=g/mL二、综合题
-
16. 图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。
 (1)、B的化学式中阳离子和阴离子的个数比为。(2)、以上6个反应中属于氧化还原反应的有(填写编号)。(3)、写出B→D反应的化学方程式 , C溶液→E反应的离子方程式。(4)、若用所示装置验证D和E的稳定性,则试管乙中装入的固体最好是(填化学式)。
(1)、B的化学式中阳离子和阴离子的个数比为。(2)、以上6个反应中属于氧化还原反应的有(填写编号)。(3)、写出B→D反应的化学方程式 , C溶液→E反应的离子方程式。(4)、若用所示装置验证D和E的稳定性,则试管乙中装入的固体最好是(填化学式)。 (5)、将一定量的B投入到含有下列离子的溶液中:NO、HCO、CO、Na+ , 反应完毕后溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)(填离子符号)。17. 计算题:(1)、相同物质的量的SO2、SO3的氧原子的个数之比为;(2)、标准状况下,56 g的C2H4气体其体积为;(3)、同温同压下,同体积的甲烷CH4气体和CO气体物质的量之比为 , 质子数之比;(4)、已知个X气体分子的质量是6.4 g,则X气体的摩尔质量是:;(5)、溶液中含Al3+ a mol,该溶液的物质的量浓度为 , 取出0.5V L再加入水稀释到4V L,则稀释后的溶液中的物质的量浓度为。18. 碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O(1)、用双线桥表示该反应中电子转移的方向和数目 , 该反应中还原产物与氧化产物的质量之比是 , 0.2mol KIO3参加反应时,转移的电子为mol。(2)、上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有(填选项),需用18.0mol/L 浓硫酸mL。
(5)、将一定量的B投入到含有下列离子的溶液中:NO、HCO、CO、Na+ , 反应完毕后溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)(填离子符号)。17. 计算题:(1)、相同物质的量的SO2、SO3的氧原子的个数之比为;(2)、标准状况下,56 g的C2H4气体其体积为;(3)、同温同压下,同体积的甲烷CH4气体和CO气体物质的量之比为 , 质子数之比;(4)、已知个X气体分子的质量是6.4 g,则X气体的摩尔质量是:;(5)、溶液中含Al3+ a mol,该溶液的物质的量浓度为 , 取出0.5V L再加入水稀释到4V L,则稀释后的溶液中的物质的量浓度为。18. 碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O(1)、用双线桥表示该反应中电子转移的方向和数目 , 该反应中还原产物与氧化产物的质量之比是 , 0.2mol KIO3参加反应时,转移的电子为mol。(2)、上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有(填选项),需用18.0mol/L 浓硫酸mL。a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)、下面操作造成所配稀硫酸溶液浓度偏高的有(填选项)。a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
19. 氯是一种重要的“成盐元素”,实验室中常用MnO2和浓盐酸反应制取氯气,实验装置如图1所示。 (1)、用此法制得的氯气中含有HCl和水蒸气,通常通过盛有、(填名称)的洗气瓶,得到纯净干燥的氯气。(2)、圆底烧瓶中发生反应的离子方程式为。(3)、Cl2是有毒气体,为了便于判断氯气是否吸收完全,可将尾气处理装置进行如图2所示的改进,实验中尾气吸收不完全的现象是。若要吸收标准状况下224mLCl2 , 至少需要1mol·L-1的NaOH溶液mL。(4)、①工业上制取漂白粉的化学方程式为。
(1)、用此法制得的氯气中含有HCl和水蒸气,通常通过盛有、(填名称)的洗气瓶,得到纯净干燥的氯气。(2)、圆底烧瓶中发生反应的离子方程式为。(3)、Cl2是有毒气体,为了便于判断氯气是否吸收完全,可将尾气处理装置进行如图2所示的改进,实验中尾气吸收不完全的现象是。若要吸收标准状况下224mLCl2 , 至少需要1mol·L-1的NaOH溶液mL。(4)、①工业上制取漂白粉的化学方程式为。②瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式解释漂白粉在空气中易失效的原因:。
③氯水具有漂白性,将氯水制成漂白粉的主要目的是(填标号)。
A.增强漂白能力和消毒能力
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白消毒