四川省成都市蓉城名校联盟2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 下列关于化学与能源的说法错误的是( )A、柴草及化石燃料转化成能源时一定发生化学反应 B、在多能源结构时期,氢能、生物质能等的核心仍然是化学反应 C、核能、太阳能等的利用取决于新型材料的合成与开发 D、过去和现在,能源的开发与利用离不开化学,将来能源的开发与利用不需要化学2. 催化剂又称触媒,下列关于催化剂的说法正确的是( )A、催化剂能加快反应速率是因为能改变反应热 B、对可逆反应使用合适的催化剂能同等程度改变正、逆反应速率 C、催化剂反应前后的质量和性质不变 D、催化剂通过参与化学反应并改变化学反应路径来起催化作用,但反应的活化能不变3. 下列关于活化分子和活化能的说法错误的是( )A、普通分子获得活化能后就成为了活化分子 B、能够发生有效碰撞的分子称为活化分子 C、活化分子间发生的碰撞一定是有效碰撞 D、活化能的作用在于使反应物活化来启动反应4. 下列变化过程中有能(热)量释放的是( )A、原子变成分子 B、晶体研细后与晶体一起放入烧杯中并搅拌 C、分子变成原子 D、高温下与C反应转化成5. 对于化学反应 , 下列反应速率关系正确的是( )A、 B、 C、 D、6. 下列事实不能用平衡移动原理解释的是( )A、对于反应 , 降低温度有利于的转化 B、增大压强,有利于工业上氨的合成 C、工业上二氧化硫与氧气合成三氧化硫时加入催化剂 D、乙醇与乙酸生成乙酸乙酯时常加入稍过量的乙醇7. 等质量的FeS固体与过量的稀硫酸在不同的实验条件下进行反应,测定在不同时间(t)产生的硫化氢气体的体积(V)的数据如下表,根据数据绘制出下图,则曲线a、b、c、d分别对应的实验组别是( )
实验组别
温度/℃
状态
Ⅰ
1.0
25
块状
Ⅱ
1.5
30
块状
Ⅲ
1.5
40
粉末状
Ⅳ
1.5
30
粉末状

选项
a
b
c
d
A
Ⅲ
Ⅳ
Ⅱ
Ⅰ
B
Ⅳ
Ⅲ
Ⅱ
Ⅰ
C
Ⅰ
Ⅱ
Ⅲ
Ⅳ
D
Ⅰ
Ⅲ
Ⅳ
Ⅱ
A、A B、B C、C D、D8. 在一定温度下,反应在密闭容器中进行,下列措施不会改变其化学反应速率的是( )A、容器体积不变,充入少量气体 B、容器体积不变,充入少量氢气 C、增大压强使容器体积变小 D、容器体积不变,充入少量气体9. 在体积固定的2L密闭容器中进行反应: , 已知某一反应时刻SO2、O2、SO3的物质的量分别为 , 则达到平衡时物质的量浓度可能正确的是( )A、SO2、O2、SO3的物质的量浓度分别为0.1 mol·L-1、0.1mol·L-1、0.5 mol·L-1 B、SO2、SO3的物质的量浓度均为0.3 mol·L-1 C、SO2、O2的物质的量浓度分别为0.1 mol·L-1、0.075 mol·L-1 D、SO3的物质的量浓度的取值范围是:0≤c(SO3)≤0.15mol·L-110. 在一定温度下的恒容密闭容器中,发生反应 , 下列能判断该反应已达到化学平衡状态的标志是( )A、和的物质的量浓度之和不再变化 B、混合气体的分子总数不再变化 C、混合气体的密度不再变化 D、和的物质的量之比不再变化11. 一定温度下,在的密闭容器中充入和发生反应:后达平衡,测得容器内压强是反应前的 . 下列说法错误的是( )
A、该温度下反应的平衡常数 B、平衡时,的转化率为 C、内,生成的反应速率为 D、平衡后向容器中再充入和各 , 平衡向逆反应方向移动12. 对于反应CO2(g)+2NH3(g) CO(NH2)2(s)+H2O , 在不同条件的影响下,水蒸气含量随反应时间变化的趋势如下图:
下列判断正确的是( )
A、 B、 C、 D、13. 在密闭容器中进行反应: , . 下图是某次实验的化学反应速率随时间变化的图像,推断t时刻突然改变的条件可能是( ) A、增大的浓度 B、升高反应体系的温度 C、增大压强(缩小容器体积) D、添加了合适的催化剂14. 下列物质中,既能导电又属于强电解质的是( )A、熔融 B、液氨 C、硅 D、盐酸15. 常温下,下列关于甲酸溶液的说法正确的是( )A、溶液中甲酸电离出的和的物质的量浓度相等时达到电离平衡 B、的电离方程式为: C、溶液与溶液中,电离平衡常数前者小 D、溶液与溶液中和的能力相同16. 在一定温度下,用水逐渐稀释溶液的过程中,溶液中随着水量的加入而减小的是( )A、 B、 C、 D、17. 下列关于焓变和熵变的说法正确的是( )A、的反应一定能自发进行 B、的反应一定能自发进行 C、的反应能自发进行 D、的反应一定没有进行18. 下列能表示物质燃烧热(燃烧热数值正确)的热化学方程式是( )A、 B、 C、 D、19. 已知在溶液中存在着如下平衡:
A、增大的浓度 B、升高反应体系的温度 C、增大压强(缩小容器体积) D、添加了合适的催化剂14. 下列物质中,既能导电又属于强电解质的是( )A、熔融 B、液氨 C、硅 D、盐酸15. 常温下,下列关于甲酸溶液的说法正确的是( )A、溶液中甲酸电离出的和的物质的量浓度相等时达到电离平衡 B、的电离方程式为: C、溶液与溶液中,电离平衡常数前者小 D、溶液与溶液中和的能力相同16. 在一定温度下,用水逐渐稀释溶液的过程中,溶液中随着水量的加入而减小的是( )A、 B、 C、 D、17. 下列关于焓变和熵变的说法正确的是( )A、的反应一定能自发进行 B、的反应一定能自发进行 C、的反应能自发进行 D、的反应一定没有进行18. 下列能表示物质燃烧热(燃烧热数值正确)的热化学方程式是( )A、 B、 C、 D、19. 已知在溶液中存在着如下平衡:橙色黄色在试管中加入溶液.下列说法正确的是( )
A、向试管中加入几粒氢氧化钠固体,开始时观察到溶液由橙色变为黄色不明显,过段时间溶液呈黄色 B、向试管中滴加10滴浓硫酸,溶液由橙色变为黄色 C、向试管中加入适量硫酸钾溶液,溶液颜色一定不会发生变化 D、橙色与黄色相互转化的过程中发生了氧化还原反应20. 中和热是指在稀溶液中,强酸、强碱发生中和反应生成可溶性盐和液态水时放出的热量.科学实验测定,中和热为 . 下列表达正确的是( )A、 B、在中和反应反应热的测定过程中,可让酸(或碱)稍稍过量,使碱(或酸)被完全中和 C、 D、在中和反应反应热的测定过程中可用温度计代替环形玻璃搅拌棒二、填空题
-
21. 在密闭容器中进行如下反应

达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)、增加C的含量,平衡 , c(H2O)。(2)、保持反应容器体积和温度不变,通入He,平衡 , c(H2)。(3)、在一定温度下,缩小反应容器体积,平衡向方向移动,c(CO) , H2O(g)的转化率。(4)、保持反应容器体积不变,升高温度,平衡向方向移动,c(H2)。(5)、保持反应容器体积和温度不变,再通入H2O(g),平衡向方向移动,H2O(g)的转化率 , c(CO)。22. 某温度下,将体积分别为且相同的和加水稀释,溶液中随着加水量的变化曲线如图所示: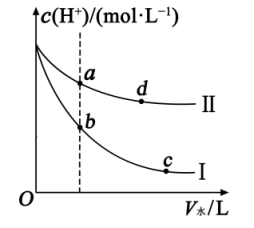
回答下列问题
(1)、Ⅱ表示的是(填化学式)的变化曲线.(2)、a点溶液的导电性b点溶液的导电性(填“<”“>”或“=”,下同),a点酸的电离程度d点酸的电离程度,a点对应酸的总浓度b点对应酸的总浓度.(3)、取等体积的b、c两点对应的溶液与相同浓度的溶液反应,消耗溶液的体积关系是(填“<”“>”或“=”).23. 甲烷(CH4)是自然界储量丰富的天然气的主要组分,可用作清洁能源和廉价的化工原料,将甲烷催化转化为具有更高价值的化学物质是一个广受关注的课题.哈尔滨工业大学的科研人员研究了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程(催化剂是),共分为甲烷活化、二氧化碳进入和H转移(夺氢)三个阶段.该反应历程的示意图如下: (1)、在研究初期,科研人员提出先将CH4转化成CO和H2 , 再转化成CH3COOH。
(1)、在研究初期,科研人员提出先将CH4转化成CO和H2 , 再转化成CH3COOH。已知:
①
②
③
则混合气体CO和H2转化成CH3COOH(g)的热化学方程式为 .
(2)、催化剂有以下四种形态:、、、 .图甲、图乙分别表示反应在催化剂的形态时的势能变化:

图甲 中与直接转化的反应过程的势能曲线

图乙 CH4与CO2在中同时发生活化的反应路线的势能曲线
由图甲、图乙可知0(填“>”“<”或“=”);不同形态的对(填“有”或“无”)影响.
(3)、从CH4到过渡态Ⅰ断裂的是键(填“碳氢”“碳碳”“氧氢”或“碳氧”,下同),最后一步“夺氢”过程中有键形成.三、综合题
-
24. 某探究小组用草酸溶液与酸性高锰酸钾溶液反应,并通过溶液颜色消失快慢的方法来研究反应速率的影响因素.设计实验方案如下表:
实验编号
催化剂/g
溶液
溶液
记录褪色时间
浓度
体积
浓度
体积
①
298
0.2
2
0.01
10
0.1
8
18
②
298
0.2
2
0.01
10
0.2
8
10
③
323
0.2
2
0.01
10
0.1
8
8
④
298
0.0
2
0.01
10
0.1
8
29
⑤
298
0.2
2
0.05
18
0.1
10
⑥
298
0.2
2
0.05
18
0.2
10
结合以上数据和所学知识回答下列问题:
(1)、写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式 .(2)、实验①和②是探究对反应速率的影响,实验②中用的浓度变化表示的平均反应速率是 . 实验①和③是探究对反应速率的影响.(3)、实验①和④是探究对反应速率的影响.有同学观察到实验④开始反应较慢,后来突然加快,但试管内温度变化不明显,可能的原因是 .(4)、实验⑤和⑥不能达到实验目的,其理由是 .25. 工业上利用和合成甲烷的反应(甲烷化反应)如下: (1)、Ⅰ.、时,平衡常数K的自然对数与温度的关系如图甲所示:
(1)、Ⅰ.、时,平衡常数K的自然对数与温度的关系如图甲所示:
图甲温度与反应的关系
甲烷化反应的浓度平衡常数表达式为 .
(2)、甲烷化反应的正反应是(填“放热”或“吸热”)反应.(3)、Ⅱ.在体积可变的密闭容器中充入和 , 发生如下反应:
的平衡转化率随着温度、压强的变化如图乙所示:

图乙的转化率与X、Y的关系
判断图中表示的物理量是 , 且(填“>”“<”或“=”,下同);A、B两点对应的化学反应速率大小关系是 .
(4)、A、B、C三点的平衡常数的大小关系为 .(5)、若达到化学平衡状态C时,容器的体积为 , 则达到化学平衡状态A时,容器的体积为 .