湖南省天壹名校联盟2021-2022学年高二上学期第一次期中联考化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 中华民族历史悠久,有着优秀的传统文化。古诗词的意蕴含蓄,意境深远。下列有关说法错误的是( )A、“落红不是无情物,化作春泥更护花”中包含了复杂的化学变化过程 B、“零落成泥碾作尘,只有香如故”中的“香”体现了分子是在不断运动的 C、“日照香炉生紫烟,遥看瀑布挂前川”中的“烟”是弥散在空气中的固体颗粒 D、“榆荚只能随柳絮,等闲撩乱走空园”中的“柳絮”和棉花的成分均含有纤维素2. 设表示阿伏加德罗常数的值,下列叙述正确的是( )A、在标准状况下,分子中含氯原子数目为 B、中含有的阴离子数为 C、标准状况下,与混合后的气体分子数为 D、分子式为的链烃中含有的键的数目为3. 下列装置或原理能达到实验目的的是( )A、制取
 B、净化
B、净化 C、分离乙醇与乙酸
C、分离乙醇与乙酸 D、测氯水的
D、测氯水的 4. 下列有关物质性质与用途具有对应关系的是( )A、具有还原性,可用作制冷剂 B、浓硫酸具有脱水性,可用于气体的干燥 C、二氧化硫具有氧化性,可用于纸浆的漂白 D、溶液能与反应,可用作铜制线路板的蚀刻剂5. 下列微粒对一水合氨()的电离平衡几乎不产生影响的是( )A、
4. 下列有关物质性质与用途具有对应关系的是( )A、具有还原性,可用作制冷剂 B、浓硫酸具有脱水性,可用于气体的干燥 C、二氧化硫具有氧化性,可用于纸浆的漂白 D、溶液能与反应,可用作铜制线路板的蚀刻剂5. 下列微粒对一水合氨()的电离平衡几乎不产生影响的是( )A、 B、
B、 C、
C、 D、
6. X、Y、Z、W为原子序数依次递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系,图中“—”相连的两种物质能发生反应。下列判断一定正确的是( )
D、
6. X、Y、Z、W为原子序数依次递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系,图中“—”相连的两种物质能发生反应。下列判断一定正确的是( ) A、简单离子半径:Y>Z B、W位于元素周期表第三周期ⅦA族 C、X、Y、Z、W中,X的原子半径最大 D、X的简单气态氢化物能使蓝色石蕊试纸变红7. 下列有关中和热的说法正确的是( )A、玻璃搅拌器材料若用铜代替,则测量出的中和热数值偏小 B、做中和热的测定实验时应分多次将溶液倒入量热计中 C、中和热的热化学方程式: D、若稀酸溶液中与稀碱溶液中的物质的量相等,则所测中和热数值更准确8. 常温下,下列各组离子在相应的条件下可能大量共存的是( )A、能使试纸变红的溶液中:、、、 B、在的溶液中:、、、 C、的溶液中:、、、 D、由水电离产生的的溶液中:、、、9. 下列事实不能用勒夏特列原理解释的是( )A、新制的氯水在光照下颜色变浅 B、合成氨时,加催化剂,使和在一定条件下转化为 C、由和组成的平衡体系加压后颜色先变深、后变浅 D、增大压强,有利于与反应生成10. 在某恒温密闭容器中,投入一定量的发生可逆反应 达到平衡。缩小容器体积,重新达到平衡。以下分析错误的是( )A、与缩小体积前的平衡浓度相等 B、平衡时,单位时间内 C、保持体积不变,向平衡体系中加入少量的 , 平衡不移动 D、若开始时向容器中加入和 , 达到平衡时吸收热量11. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
A、简单离子半径:Y>Z B、W位于元素周期表第三周期ⅦA族 C、X、Y、Z、W中,X的原子半径最大 D、X的简单气态氢化物能使蓝色石蕊试纸变红7. 下列有关中和热的说法正确的是( )A、玻璃搅拌器材料若用铜代替,则测量出的中和热数值偏小 B、做中和热的测定实验时应分多次将溶液倒入量热计中 C、中和热的热化学方程式: D、若稀酸溶液中与稀碱溶液中的物质的量相等,则所测中和热数值更准确8. 常温下,下列各组离子在相应的条件下可能大量共存的是( )A、能使试纸变红的溶液中:、、、 B、在的溶液中:、、、 C、的溶液中:、、、 D、由水电离产生的的溶液中:、、、9. 下列事实不能用勒夏特列原理解释的是( )A、新制的氯水在光照下颜色变浅 B、合成氨时,加催化剂,使和在一定条件下转化为 C、由和组成的平衡体系加压后颜色先变深、后变浅 D、增大压强,有利于与反应生成10. 在某恒温密闭容器中,投入一定量的发生可逆反应 达到平衡。缩小容器体积,重新达到平衡。以下分析错误的是( )A、与缩小体积前的平衡浓度相等 B、平衡时,单位时间内 C、保持体积不变,向平衡体系中加入少量的 , 平衡不移动 D、若开始时向容器中加入和 , 达到平衡时吸收热量11. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:①
②
下列说法正确的是( )
 A、①中的能量变化如图所示 B、由②可知的燃烧热为 C、转变成的过程一定是放出能量 D、根据①推知反应的12. 室温下,用溶液分别滴定的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
A、①中的能量变化如图所示 B、由②可知的燃烧热为 C、转变成的过程一定是放出能量 D、根据①推知反应的12. 室温下,用溶液分别滴定的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( ) A、滴定醋酸溶液、盐酸时,均可选择甲基橙溶液作指示剂 B、I表示的是滴定醋酸的曲线 C、时,滴定醋酸消耗的大于 D、时,滴定醋酸溶液所得溶液中:
A、滴定醋酸溶液、盐酸时,均可选择甲基橙溶液作指示剂 B、I表示的是滴定醋酸的曲线 C、时,滴定醋酸消耗的大于 D、时,滴定醋酸溶液所得溶液中:二、多选题
-
13. 一氧化碳甲烷化反应为 。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。下列说法错误的是( )
 A、步骤①只有非极性键断裂 B、该反应的 C、过渡态II能量最高,因此其对应的步骤③反应速率最慢 D、该方法可以清除剧毒气体 , 从而保护环境14. 以、为原料合成涉及的主要反应如下:
A、步骤①只有非极性键断裂 B、该反应的 C、过渡态II能量最高,因此其对应的步骤③反应速率最慢 D、该方法可以清除剧毒气体 , 从而保护环境14. 以、为原料合成涉及的主要反应如下:①
②
③
不同压强下,按照投料,平衡转化率随温度变化关系如图所示。下列说法正确的是( )
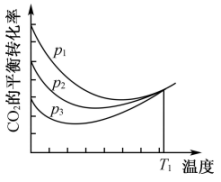 A、根据盖斯定律计算 B、选择合适的催化剂可以提高反应①的选择性,从而提高的平衡转化率 C、为同时提高的平衡转化率和的平衡产率,反应条件应选择高温、高压 D、温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③
A、根据盖斯定律计算 B、选择合适的催化剂可以提高反应①的选择性,从而提高的平衡转化率 C、为同时提高的平衡转化率和的平衡产率,反应条件应选择高温、高压 D、温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③三、综合题
-
15. 化学兴趣小组利用下图装置进行铁与水反应的实验,并利用产物制取晶体。(图中的部分装置略去)
 (1)、装置A的作用是 , 请写出装置B中发生的反应的化学方程式: , 该反应(填“是”或“不是”)氧化还原反应。(2)、该实验中存在两个酒精灯,实验室应先点燃A处的酒精灯,再点燃B处的酒精喷灯,原因是。(3)、反应一段时间后,冷却并取出B中固体,与过量的稀盐酸充分反应后____(填字母)。A、一定存在 B、一定存在 C、和中只存在一种 D、一定存在和(4)、取(3)反应后的溶液过滤:。步骤①通入的作用是 , 对应反应的离子方程式为。16. 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:(1)、25℃、时,氨气完全燃烧放出的热量,则 。(2)、反应过程的能量变化如图所示。
(1)、装置A的作用是 , 请写出装置B中发生的反应的化学方程式: , 该反应(填“是”或“不是”)氧化还原反应。(2)、该实验中存在两个酒精灯,实验室应先点燃A处的酒精灯,再点燃B处的酒精喷灯,原因是。(3)、反应一段时间后,冷却并取出B中固体,与过量的稀盐酸充分反应后____(填字母)。A、一定存在 B、一定存在 C、和中只存在一种 D、一定存在和(4)、取(3)反应后的溶液过滤:。步骤①通入的作用是 , 对应反应的离子方程式为。16. 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:(1)、25℃、时,氨气完全燃烧放出的热量,则 。(2)、反应过程的能量变化如图所示。
已知:被氧化为的。则:
①E的大小对该反应的反应热(填“有”或“无”)影响;该反应通常用作催化剂,加会使图中B点(填“升高”或“降低”)。
②氧化为的热化学方程式为。
(3)、已知拆开键、、键分别需要吸收的能量为、、。则由氢气和碘反应生成需要(填“放出”或“吸收”)的热量。(4)、发射卫星时可用肼()为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①
②
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:。
17. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。 (1)、a、b、c三点溶液的pH从大到小顺序为。(2)、a、b、c三点溶液用溶液中和,消耗溶液的体积大小关系为。(3)、用蒸馏水稀释c点的醋酸,则下列各式表示的数值随水量的增加而增大的是____(填字母)。A、 B、电离度 C、 D、(4)、已知的电离平衡常数 , 中约为。(5)、体积为 , 的醋酸溶液与 , 的一元酸分别加水稀释至 , 稀释过程变化如图,若将相同表面积的分别加入等浓度的醋酸和溶液中,初始反应速率为(填“<”“>”或“=”)。
(1)、a、b、c三点溶液的pH从大到小顺序为。(2)、a、b、c三点溶液用溶液中和,消耗溶液的体积大小关系为。(3)、用蒸馏水稀释c点的醋酸,则下列各式表示的数值随水量的增加而增大的是____(填字母)。A、 B、电离度 C、 D、(4)、已知的电离平衡常数 , 中约为。(5)、体积为 , 的醋酸溶液与 , 的一元酸分别加水稀释至 , 稀释过程变化如图,若将相同表面积的分别加入等浓度的醋酸和溶液中,初始反应速率为(填“<”“>”或“=”)。 18. 氯气是一种重要的化工原料。(1)、工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为)为原料生产。
18. 氯气是一种重要的化工原料。(1)、工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为)为原料生产。已知: ;
。
沸腾炉中“加碳氯化”生成和的热化学方程式:。
(2)、合成有机物时会产生副产物。利用反应可实现氯的循环利用。①该反应的0(填“>”“<”或“=”)。
②若反应物按物质的量()在体积不变的密闭容器中发生该反应,下列叙述正确的是(填字母)。
A.当不变时,说明反应已达到平衡状态
B.当时,说明反应已达到平衡状态
C.平衡后,继续按的物质的量之比投入和 , 再次达到新平衡时,的转化率增大
D.平衡后,分离出 , 可以提高的平衡产率,并加快正反应速率
③下图是在两个不同温度和下,改变时在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是(填字母)。

A.a点未达到平衡,c点一定已经平衡
B.平衡常数:
C.达到平衡时的转化率大小为a>b>c
D.若平衡常数K值变大,达新平衡前始终减小
(3)、在一定温度下,以为催化剂,氯苯()和在中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:i.
ii.
向盛有含有的的容器中加入和发生反应,忽略溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。

①该温度下,反应ii的化学平衡常数。
②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的。