湖南省百所名校大联考2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是( )A、蓝矾可用于饮用水的杀菌消毒 B、纯碱能除去物品表面的油污 C、回收处理废旧电池,主要是为了变废为宝 D、燃煤时加入生石灰可以减少酸雨的形成及温室气体的排放2. 下列物质的电离方程式或水解方程式书写正确的是( )A、HCN=H++CN- B、+H2O⇌H3O++ C、+2H2O⇌H2SO3+2OH- D、Al2(SO4)3⇌2Al3++33. 在一密闭容器中,存在可逆反应 , 该反应的平衡常数表达式为( )A、 B、 C、 D、4. 下列物质溶于水能促进水的电离的是( )A、 B、 C、 D、5. 下列溶液一定呈酸性的是( )A、的某电解质溶液 B、含有的溶液 C、的溶液 D、NaHS溶液6. 下列有关沉淀溶解平衡的说法中错误的是( )A、的溶度积常数表达式 B、难溶于水,溶液中没有和SO C、升高温度,的溶解度增大 D、向悬浊液中加入固体,溶解的量减少7. 升高温度,下列物理量不一定增大的是( )A、化学反应平衡常数K B、水的离子积常数Kw C、化学反应速率v D、的溶解度S8. 室温下,向溶液中逐滴加入0.1mol/L的NaOH溶液的过程中[忽略溶液体积和温度的变化,]。下列说法错误的是( )A、室温下,的水解常数 B、当滴入NaOH溶液的体积为5mL时, C、当混合溶液的pH=7时,溶液中各离子浓度之间的大小关系为 D、当滴入NaOH溶液的体积为20mL时,9. 相同温度下,等物质的量浓度的下列溶液中,pH最小的是( )A、 B、 C、 D、10. 在一恒容密闭容器中发生反应:。起始时,、、。在一定条件下,当反应达到平衡时,下列各物质的物质的量浓度关系可能正确的是( )A、 B、 C、 D、11. 下列图示与对应的叙述相符的是( )
 A、图1:用硝酸铝溶液直接蒸发结晶获得无水硝酸铝 B、图2:验证氯化锰对过氧化氢的分解有催化作用 C、图3:读取滴定管中液体体积 D、图4:探究温度对化学平衡的影响
A、图1:用硝酸铝溶液直接蒸发结晶获得无水硝酸铝 B、图2:验证氯化锰对过氧化氢的分解有催化作用 C、图3:读取滴定管中液体体积 D、图4:探究温度对化学平衡的影响二、多选题
-
12. 室温下,在由水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液中,一定不能大量共存的离子组是( )A、F-、Cl-、Na+、K+ B、、、Fe2+、Mg2+ C、I-、、Ca2+、Ba2+ D、、、Na+、K+13. 湿法烟气脱氮工艺中常用到尿素,其反应原理为 , 反应达到平衡后仅改变某一条件,反应速率v与时间t的关系如图所示,下列说法错误的是( )
 A、t2时刻,改变的某一条件可能是充入少量的N2 B、t4时刻,改变的某一条件可能是增大压强 C、t6时刻,改变的某一条件可能是加入合适的催化剂 D、反应达到平衡的各时间段内,时间段内的含量最低14. 室温下,用NaOH溶液滴定溶液,溶液中和[或和]的关系如图所示,下列说法正确的是(忽略混合溶液体积和温度的变化)( )
A、t2时刻,改变的某一条件可能是充入少量的N2 B、t4时刻,改变的某一条件可能是增大压强 C、t6时刻,改变的某一条件可能是加入合适的催化剂 D、反应达到平衡的各时间段内,时间段内的含量最低14. 室温下,用NaOH溶液滴定溶液,溶液中和[或和]的关系如图所示,下列说法正确的是(忽略混合溶液体积和温度的变化)( ) A、原溶液中 B、当溶液中时,溶液的 C、当滴定至时,溶液中微粒之间的关系为 D、当滴定至恰好完全反应时,溶液中存在
A、原溶液中 B、当溶液中时,溶液的 C、当滴定至时,溶液中微粒之间的关系为 D、当滴定至恰好完全反应时,溶液中存在三、综合题
-
15. 氨在国防、工农业等领域发挥着重要作用。某实验兴趣小组在实验室模拟工业制氨气,在400℃、2.8MPa时,将一定量N2和H2的混合气体充入一密闭容器中,发生反应。
回答下列问题:
(1)、该反应的反应物的键能总和(填“大于”或“小于”)生成物的键能总和。(2)、为了提高的产率,可采用(填一种即可)的方法。(3)、下列说法正确的是____ (填标号)。A、升高温度,该反应的反应速率加快,平衡常数减小 B、加入合适的催化剂,N2的转化率保持不变 C、时,该反应达到平衡状态(4)、每断裂键,同时形成键,转移的电子数为NA。16. 国家标准规定葡萄酒中SO2的最大使用量为0.25g/L。某兴趣小组用如图1所示装置(夹持装置已略去)收集某葡萄酒中的SO2 , 并对其含量进行测定。 (1)、仪器B的名称为 , 仪器A的作用是。(2)、向B中加入300.00mL葡萄酒和适量稀硫酸,加热使SO2全部逸出,并与C中完全反应,C中发生反应的离子方程式为。(3)、除去C中剩余的 , 然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的(填“①”或“②”)中,理由是。(4)、滴定前,先在锥形瓶中滴入几滴无色酚酞。滴定过程中,眼睛应注意的变化,达到滴定终点的标志是。(5)、滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为g/L。17. 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4L的恒容密闭容器中,充入和 , 发生反应:。回答下列问题:(1)、每消耗 , 该反应放出的热量为kJ。(2)、下列能用来判断该反应达到平衡状态的标志是____(填标号)。A、混合气体的密度不再随时间改变 B、混合气体的平均相对分子质量不再随时间改变 C、不再随时间改变 D、混合气体的质量不再随时间改变(3)、3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。
(1)、仪器B的名称为 , 仪器A的作用是。(2)、向B中加入300.00mL葡萄酒和适量稀硫酸,加热使SO2全部逸出,并与C中完全反应,C中发生反应的离子方程式为。(3)、除去C中剩余的 , 然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的(填“①”或“②”)中,理由是。(4)、滴定前,先在锥形瓶中滴入几滴无色酚酞。滴定过程中,眼睛应注意的变化,达到滴定终点的标志是。(5)、滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为g/L。17. 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4L的恒容密闭容器中,充入和 , 发生反应:。回答下列问题:(1)、每消耗 , 该反应放出的热量为kJ。(2)、下列能用来判断该反应达到平衡状态的标志是____(填标号)。A、混合气体的密度不再随时间改变 B、混合气体的平均相对分子质量不再随时间改变 C、不再随时间改变 D、混合气体的质量不再随时间改变(3)、3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。①mol/L,的转化率为%。
②。
③该反应达到平衡时的平衡常数K=(列出计算式即可)。
(4)、在一定条件下,体系中的CO2的平衡转化率()与温度(T)和压强(p)的关系如图所示。则T1(填“>”或“<”)T2 , 判断的理由是。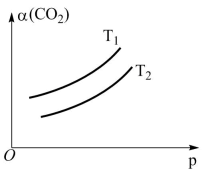 18. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)(1)、现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5 , Kb(NH3·H2O)=1.6×10-5 , lg2=0.3]
18. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)(1)、现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5 , Kb(NH3·H2O)=1.6×10-5 , lg2=0.3]①NH3·H2O的电离方程式为。
②0.01 mol·L-1的NH3·H2O的pH=。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为。
(2)、甲酸钠(HCOONa)属于(填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是(用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=mol·L-1。