湖北省新高考联考协作体2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2022-09-02 类型:期中考试
一、单选题
-
1. 化学与生产、生活密切相关。下列说法错误的是( )A、我国“蛟龙”号载人潜水器供人活动的耐压球壳是用钛合金制造的,钛合金球壳直径2米,壁厚105毫米,可承受万米深海压强 B、风能发电有利于实现“碳达峰、碳中和” C、蒸馒头时,在发酵的面团里加入一些小苏打可使馒头发泡 D、“天问一号”火星探测器装有太阳能电池板,其主要材料是二氧化硅2. 学习百年党史话化学,化学的发展离不开许多化学家的不懈努力,下列说法错误的是( )A、我国科学院院士徐光宪教授为相对原子质量的测定做出了卓越贡献 B、我国化学家侯德榜提出了“联合制碱法”,完成了世界上第一部纯碱工业专著《制碱》 C、我国科学家于1965年在世界上首次完成了具有生命活力的蛋白质—结晶牛胰岛素的合成,对蛋白质的研究作出了重要贡献 D、我国化学家屠呦呦研究合成抗疟疾新药青蒿素和双氢青蒿素,这一研究成果挽救了数以百万计的生命3. 化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是( )A、将稀硫酸滴在铜片上: B、向NaHSO4溶液中滴入Ba(OH)2溶液至恰好使溶液pH=7: C、1gH2在O2中完全燃烧生成液态水,放出142.9kJ的热量,则H2燃烧的热化学方程式为 D、明矾[化学式为KAl(SO4)2•12H2O]溶液呈酸性的原因:4. 用NA代表阿伏加德罗常数的值,下列说法错误的是( )A、0.1mo/LHCl溶液中含0.1NAHCl分子 B、28g正丁烷和30g异丁烷的混合物中共价键数目为13NA C、将0.1molFeCl3滴入沸水中,形成的胶体粒子数目小于0.1NA D、22gT2O中含有的中子数为12NA5. 一定温度下,某容积为1L的恒容密闭容器中通入2molSO2和1molO2 , 发生反应: (Q>0)。下列有关说法正确的是( )A、该反应在高温下才能自发进行 B、充入少量He使体系压强增大,v正、v逆均不变 C、若该反应的活化能为aKJ/mol,则其逆反应的活化能为(Q-a)kJ/mol D、当SO2和O2转化率相等时,该反应达到化学平衡状态6. 下列说法正确的是( )A、25℃时,pH=9的CH3COONa溶液中,由水电离出来的为 B、若 , 则 C、在0.1mol/L的NH4Al(SO4)2溶液中:K+、Na+、CO、一定能大量共存 D、铜片和锌片用导线连接浸入CuSO4溶液中,若两极都有红色固体析出,测得锌片质量减少了3.92g,铜片质量增加了3.84g,则参加原电池反应的锌占反应总量的百分率为75%7. 学校研究性学习小组欲用下图所示的装置证明H2SO3和HClO的酸性强弱(已知:H2SO3的酸性强于H2CO3)。下列有关说法错误的是( )
 A、装置C的作用是制备CO2气体 B、通过本实验可以得出Cl元素的非金属性比S元素强 C、直接将SO2气体通入Ca(ClO)2溶液中无法证明H2SO3和HClO的酸性强弱 D、装置D颜色变浅但不褪色,且E中产生白色沉淀即可证明H2SO3酸性强于HClO8. 在一定温度下的密闭容器中发生反应: , 平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20mol/L。下列有关判断错误的是( )A、x+y<z B、平衡向正反应方向移动 C、B的转化率降低 D、C的体积分数增大9. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子无中子,常温下,Y的单质能溶于某强氧化性酸的稀溶液,却不溶于其浓溶液,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y三种原子的电子数之和。下列说法错误的是( )A、X常用来制作电池 B、Y、Z形成的化合物熔融状态下可以导电 C、W的简单阴离子半径大于X的简单阳离子半径 D、Z的单质的水溶液需保存在棕色试剂瓶中10. 下列实验操作、现象和结论均正确的是( )
A、装置C的作用是制备CO2气体 B、通过本实验可以得出Cl元素的非金属性比S元素强 C、直接将SO2气体通入Ca(ClO)2溶液中无法证明H2SO3和HClO的酸性强弱 D、装置D颜色变浅但不褪色,且E中产生白色沉淀即可证明H2SO3酸性强于HClO8. 在一定温度下的密闭容器中发生反应: , 平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20mol/L。下列有关判断错误的是( )A、x+y<z B、平衡向正反应方向移动 C、B的转化率降低 D、C的体积分数增大9. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子无中子,常温下,Y的单质能溶于某强氧化性酸的稀溶液,却不溶于其浓溶液,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y三种原子的电子数之和。下列说法错误的是( )A、X常用来制作电池 B、Y、Z形成的化合物熔融状态下可以导电 C、W的简单阴离子半径大于X的简单阳离子半径 D、Z的单质的水溶液需保存在棕色试剂瓶中10. 下列实验操作、现象和结论均正确的是( )选项
实验操作
现象
结论
A
等体积pH=2的HA和HB两种酸分别与足量的铁粉反应,用排水法收集气体
HA放出的氢气多且反应速率快
酸的强弱:HA<HB
B
向2mL0.1mol/LAgNO3溶液中滴2滴0.1mol/LNaCl溶液,再滴2滴0.1mol/LKI溶液
先生成白色沉淀,后生成黄色沉淀
溶度积(Ksp);AgCl>AgI
C
向新制氯水中滴加紫色石蕊试液
溶液变为红色且保持不变
新制氯水具有酸性
D
常温下,用pH计分别测定饱和NaX溶液和饱和NaY溶液的pH
pH:NaX>NaY
常温下酸性:HX<HY
A、A B、B C、C D、D11. 已知25℃时,几种弱酸或弱碱测得的电离平衡常数如下:HNO2(亚硝酸): , HCN(氢氰酸): , HF: , NH3·H2O:。下列说法错误的是( )A、25℃时,NH4F水溶液的pH<7 B、一定条件下,反应可以发生 C、25℃时,等物质的量浓度的NaNO2和NaF混合溶液中: D、等体积、等物质的量浓度的NaCN和NaNO2溶液中所含阴离子总数前者小于后者12. 已知:。以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水制H2的过程如下:过程I:
过程II:……
下列说法错误的是( )
 A、过程I中每生成1molFeO转移mol电子 B、过程II热化学方程式为: C、过程I、II中能量转化的形式依次是:太阳能→化学能→热能 D、铁氧化合物循环制H2具有成本低、产物易分离等优点13. AlPO4的沉淀溶解平衡曲线如图所示()。则下列说法正确的是( )
A、过程I中每生成1molFeO转移mol电子 B、过程II热化学方程式为: C、过程I、II中能量转化的形式依次是:太阳能→化学能→热能 D、铁氧化合物循环制H2具有成本低、产物易分离等优点13. AlPO4的沉淀溶解平衡曲线如图所示()。则下列说法正确的是( ) A、AlPO4在b点对应的溶解度小于c点 B、AlPO4沉淀溶解是放热的过程 C、图中四个点的Ksp: D、T1温度下,在AlPO4饱和溶液中加入AlCl3固体可使溶液由c点变到a点14. 室温时,的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是( )
A、AlPO4在b点对应的溶解度小于c点 B、AlPO4沉淀溶解是放热的过程 C、图中四个点的Ksp: D、T1温度下,在AlPO4饱和溶液中加入AlCl3固体可使溶液由c点变到a点14. 室温时,的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是( ) A、的数量级为 B、pH=4的溶液中, C、pH=7的溶液中, D、的溶液中,15. 温度为T1时,在三个容积均为1L的恒容密闭容器中均发生反应:(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2) 消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
A、的数量级为 B、pH=4的溶液中, C、pH=7的溶液中, D、的溶液中,15. 温度为T1时,在三个容积均为1L的恒容密闭容器中均发生反应:(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2) 消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。容器编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO2)
c(NO)
c(O2)
c(O2)
I
0.6
0
0
0.2
II
0.3
0.5
0.2
III
0
0.6
0.35
下列说法正确的是( )
A、容器II达到平衡前v正>v逆 B、达到平衡时,容器III中NO的体积分数大于50% C、设K为该反应的化学平衡常数,则有 D、当温度改变为T2时,若 , 则>1.25二、综合题
-
16. 25℃时,四种酸的电离平衡常数如表所示:
化学式
CH3COOH
HClO
H3PO3
H2CO3
名称
醋酸
次氯酸
亚磷酸
碳酸
电离平衡常数
回答下列问题:
(1)、25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:a. Na2CO3 , b. NaClO,c. CH3COONa,d. NaHCO3 , pH由大到小的顺序是(填编号)。(2)、亚磷酸(H3PO3)为二元酸,具有较强的还原性。Na2HPO3是 (填“酸式盐”“碱式盐”或“正盐”)。H3PO3的第二级电离平衡常数表达式K=。(3)、将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:。(4)、常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据变小的是____ (填字母)。A、 B、 C、 D、 E、(5)、体积均为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程的pH变化如图所示,则相同条件下HX的电离平衡常数醋酸的电离平衡常数(填“大于”“等于”或“小于”,下同)。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况下的体积大小关系为:CH3COOHHX。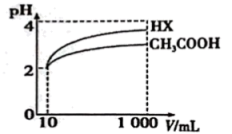 17. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用反应: , 可减少CO2排放,并合成清洁能源。(1)、该反应一般认为通过如下步骤来实现:
17. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用反应: , 可减少CO2排放,并合成清洁能源。(1)、该反应一般认为通过如下步骤来实现:①
②
总反应的=kJ/mol;原料CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是 (填标号)。
a. NaOH溶液 B.浓氨水 C. CH3CH2OH D. NH4Cl溶液
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 (填标号)。
A.
 B.
B.
C.
 D.
D. (2)、向恒温恒容的密闭容器中充入一定量的CO2和H2 , 发生反应: , 下列叙述能说明此反应一定达到平衡状态的是____A、混合气体的平均相对分子质量保持不变 B、CO2和H2的转化率相等 C、混合气体的密度保持不变 D、1molCO2生成的同时有3molH-H键断裂(3)、350℃时,在容积为2L的密闭容器中充入6molCO2和8molH2 , 发生反应: , 测得t=10min时,反应达到平衡,此时。从反应开始到平衡,H2的平均反应速率v(H2)= ;该可逆反应的平衡常数为;达到平衡时,若再向容器中加入CO2(g)和CH3OH(g)各2mol,则平衡移动。(填“正向”、“逆向”或“不”)。18. 乙二酸俗名草酸,易溶于水,其水溶液与酸性KMnO4溶液反应的离子方程式为: , 化学学习小组进行如下实验。(1)、I.探究反应速率的影响因素
(2)、向恒温恒容的密闭容器中充入一定量的CO2和H2 , 发生反应: , 下列叙述能说明此反应一定达到平衡状态的是____A、混合气体的平均相对分子质量保持不变 B、CO2和H2的转化率相等 C、混合气体的密度保持不变 D、1molCO2生成的同时有3molH-H键断裂(3)、350℃时,在容积为2L的密闭容器中充入6molCO2和8molH2 , 发生反应: , 测得t=10min时,反应达到平衡,此时。从反应开始到平衡,H2的平均反应速率v(H2)= ;该可逆反应的平衡常数为;达到平衡时,若再向容器中加入CO2(g)和CH3OH(g)各2mol,则平衡移动。(填“正向”、“逆向”或“不”)。18. 乙二酸俗名草酸,易溶于水,其水溶液与酸性KMnO4溶液反应的离子方程式为: , 化学学习小组进行如下实验。(1)、I.探究反应速率的影响因素设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量
V(H2C2O4)/mL
V(蒸馏水)mL
V(KMnO4)/mL
T/℃
乙
①
3.0
0
5.0
50
②
3.0
0
5.0
25
③
1.0
a
5.0
25
上述实验是探究温度对化学反应速率的影响:若上述实验②、③是探究浓度对化学反应速率的影响,则a为;乙是实验需要测量的物理量,则表格中“乙”应填写。
(2)、II.测定H2C2O4•xH2O中x值为了测定草酸晶体H2C2O4•xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号
V(KMnO4溶液)
滴定前刻度/mL
滴定后刻度/mL
1
0.10
10.00
2
1.10
11.10
3
1.50
13.50
4
0.70
10.80
回答下列问题:
步骤③滴定过程中,盛装KMnO4溶液的仪器为 (填名称)。
(3)、本实验滴定达到终点的标志是。(4)、根据数据,计算x=。(5)、下列滴定操作会使测得的x值偏大的是____。A、滴定开始时仰视滴定管刻度,滴定终点时俯视滴定管刻度 B、滴定时所用的KMnO4溶液因久置而导致浓度变小 C、滴定管尖嘴内在滴定前有气泡,滴定后气泡消失19. 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时的pH (c=0.01mol/L)
7.2
3.7
2.2
7.5
沉淀完全时的pH (c=1.0×10-5mol/L)
8.7
4.7
3.2
9.0
回答下列问题:
(1)、Fe元素位于元素周期表第周期族;提高“碱浸”速率的措施是 (任写一点即可)。(2)、H2O2的电子式为;“转化”步骤中加入H2O2的目的是(用离子方程式表示) 。(3)、利用上述表格数据,计算Ni(OH)2的Ksp=;如果“转化”后的溶液中Ni2+浓度为0.1mol/L,则“调pH”应控制的pH范围是。(4)、资料显示,硫酸镍结晶水合物的形态与温度有如表关系。温度
低于30.8℃
30.8℃~53.8℃
53.8℃~280℃
高于280℃
晶体形态
NiSO4•7H2O
NiSO4•6H2O
多种结晶水合物
NiSO4
从NiSO4溶液获得稳定的NiSO4•7H2O晶体的操作依次是蒸发浓缩、、过滤、洗涤、干燥。