湖北省武汉市洪山区2022年中考模拟化学试题
试卷更新日期:2022-08-31 类型:中考模拟
一、单选题
-
1. 2022冬奥火炬在神州传递,下列情景中蕴含着化学变化的是( )A、彩旗飘扬 B、气球升空 C、火炬燃烧 D、歌声嘹亮2. 下列实验基本操作,错误的是( )




A.取用药品
B.收集气体
C.称量质量
D.洗涤试管
A、A B、B C、C D、D3. 从化学角度看,下列叙述错误的是( )A、米饭、面包主要为人体提供蛋白质 B、铁、锌、硒都是人体必需的微量元素 C、垃圾分类有利于资源的有效利用 D、开发清洁新能源可以有效减少和防止酸雨的形成4. 关于下列符号或图示的说法正确的是( )①2H ②Al3+ ③
 ④
④  A、①表示2个氢分子 B、②表示铝元素的化合价为+3价 C、③表示镁原子的结构示意图 D、由④可知铕的原子序数为635. 清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,有利于今年政府工作报告中提出的实现“碳达峰”和“碳中和”目标。其微观示意图如下图。下列说法正确的是( )
A、①表示2个氢分子 B、②表示铝元素的化合价为+3价 C、③表示镁原子的结构示意图 D、由④可知铕的原子序数为635. 清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,有利于今年政府工作报告中提出的实现“碳达峰”和“碳中和”目标。其微观示意图如下图。下列说法正确的是( ) A、该反应基本反应类型属于置换反应 B、甲、丙、丁均为氧化物 C、参加反应的甲和乙分子个数比为1:1 D、生成丙和丁的质量比为16:96. A、B、C三种初中化学常见物质中都含有同一种金属元素,它们之间的一步反应转化关系如图所示(部分反应物、生成物未标出)。其中,A是氯化钠,在工业上通过电解氯化钠的饱和溶液来生产B和氯气(Cl2)等;C俗称纯碱,C的溶液与石灰水反应可制取B。下列说法正确的是( )
A、该反应基本反应类型属于置换反应 B、甲、丙、丁均为氧化物 C、参加反应的甲和乙分子个数比为1:1 D、生成丙和丁的质量比为16:96. A、B、C三种初中化学常见物质中都含有同一种金属元素,它们之间的一步反应转化关系如图所示(部分反应物、生成物未标出)。其中,A是氯化钠,在工业上通过电解氯化钠的饱和溶液来生产B和氯气(Cl2)等;C俗称纯碱,C的溶液与石灰水反应可制取B。下列说法正确的是( )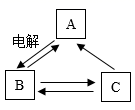 A、在海水里含量最多的物质是A B、物质B的固体必须密封保存 C、用石蕊试液或稀硝酸均不能将A,C的溶液区分开来 D、图示中物质之间的转化反应都属于复分解反应7. 利用数字化实验可以准确地了解反应进行的程度。如图为常温下,硫酸溶液与氢氧化钠溶液反应过程中溶液pH的变化情况,下列有关列断错误的是( )
A、在海水里含量最多的物质是A B、物质B的固体必须密封保存 C、用石蕊试液或稀硝酸均不能将A,C的溶液区分开来 D、图示中物质之间的转化反应都属于复分解反应7. 利用数字化实验可以准确地了解反应进行的程度。如图为常温下,硫酸溶液与氢氧化钠溶液反应过程中溶液pH的变化情况,下列有关列断错误的是( ) A、当加入甲溶液5g时,加入无色酞溶液变红色 B、根据图示可知,甲溶液是氢氧化钠溶液 C、加入甲溶液10g时,所消耗的甲溶液的溶质质量为1.96g D、现代化实验技术让无现象的实验变得数字化、显性化8. 将a g 的锌粉投入到Fe(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤渣a g 和滤液。关于该实验有以下说法,其中说法正确的是( )A、滤液中一定有锌离子,可能有亚铁离子、铜离子和银离子 B、向滤渣中加稀盐酸,有气泡冒出,滤液中一定没有硝酸亚铁 C、滤渣中最多能有四种金属单质 D、若滤液呈浅绿色,向滤液中滴加稀盐酸可能有白色沉淀产生
A、当加入甲溶液5g时,加入无色酞溶液变红色 B、根据图示可知,甲溶液是氢氧化钠溶液 C、加入甲溶液10g时,所消耗的甲溶液的溶质质量为1.96g D、现代化实验技术让无现象的实验变得数字化、显性化8. 将a g 的锌粉投入到Fe(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤渣a g 和滤液。关于该实验有以下说法,其中说法正确的是( )A、滤液中一定有锌离子,可能有亚铁离子、铜离子和银离子 B、向滤渣中加稀盐酸,有气泡冒出,滤液中一定没有硝酸亚铁 C、滤渣中最多能有四种金属单质 D、若滤液呈浅绿色,向滤液中滴加稀盐酸可能有白色沉淀产生二、填空题
-
9. 水是实验室中最常见的试剂,实验室常利用水来实现安全防护。
 (1)、白磷的着火点为40℃。实验室常将少量白磷保存在盛有水的广口瓶中,由图①可知,白磷不与水反应,不溶于水且(填一物理性质)。(2)、图②所示实验中,水的作用是。(3)、图③所示实验中,硫燃烧的化学方程式为 , 生成的有害气体被水吸收,既可防止被实验者吸入也可防止空气污染。10. 甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)、白磷的着火点为40℃。实验室常将少量白磷保存在盛有水的广口瓶中,由图①可知,白磷不与水反应,不溶于水且(填一物理性质)。(2)、图②所示实验中,水的作用是。(3)、图③所示实验中,硫燃烧的化学方程式为 , 生成的有害气体被水吸收,既可防止被实验者吸入也可防止空气污染。10. 甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题: (1)、t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是。(2)、t3℃时,将20 g物质丙加入50 g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为。(结果保留到0.1%)(3)、在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是。(4)、下列说法错误的是(填字母序号)。
(1)、t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是。(2)、t3℃时,将20 g物质丙加入50 g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为。(结果保留到0.1%)(3)、在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是。(4)、下列说法错误的是(填字母序号)。a.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
b.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
c.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
d.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙
三、综合题
-
11. 国家对化学实验室废弃药品的处理有严格要求,处理关键是确定其成分。某校化学实验室有一包固体废弃物,可能由铁粉、碳粉、碳酸钾、氧化铜、氯化钠、氢氧化钠中的一种或几种组成。为确定其成分,同学们取样进行了如下实验:(1)、 [实验一]

向固体A中加入足量稀盐酸充分反应,无气泡产生,溶液由无色变成蓝色,有固体剩余,说明原废弃物中一定有 , 写出溶液变成蓝色的化学方程式。
(2)、[实验二]
混合物D中有白色沉淀,加入酚酞溶液后上层清液为红色,说明原废弃物中一定含有。加入过量稀硝酸可观察到的现象是:。
(3)、混合物F中有白色沉淀,其上层清液中一定含有的离子是(酚酞除外)。12. 某实验小组在实验室制得的CaSO4•2H2O固体中含有少量的CaCO3 , 该小组的同学对所得固体进行如下探究:(1)、探究一:测定固体中CaSO4•2H2O和CaCO3的质量比x:y实验小组利用如图所示的装置进行实验。(碱石灰是CaO和NaOH的混合物,夹持仪器省略,药品足量)

实验前首先要检查装置气密性,再装入样品,并通入一段时间的空气后,再给样品加热。装置A的作用是。
(2)、已知CaSO4•2H2O在160℃生成CaSO4 , 1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将(填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的(选填序号)两个数据组合也可求出x:y的值。
(3)、探究二:研究CaSO4•2H2O加热分解的产物。查阅资料:CaSO4•2H2O受热会逐步失去结晶水;SO2气体能使酸性KMnO4溶液褪色。
分离所得的CaSO4•2H2O含有CaCO3 , 可用盐酸除去,该的化学反应方程式:。
(4)、将实验一所用装置中的D换成盛有酸性高锰酸钾溶液的洗气瓶,其余装置不变。取纯净CaSO4•2H2O固体3.44g,放在实验装置B中进行加热,测定固体质量随温度的变化情况,并用带火星的木条在E装置右侧导管口检验,记录数据和实验现象如下:

F点
G点
H点
I点
酸性KMnO4溶液
不褪色
不褪色
不褪色
褪色
带火星的木条
不复燃
不复燃
不复燃
复燃
G点固体的化学式是。
四、计算题
-
13. 某同学用50.0 g 的过氧化氢溶液和少量的二氧化锰来制取氧气,最后所得气体质量与实践的关系如下图所示。

(1)、用过氧化氢溶液和二氧化锰制氧气,应选用下图中的装置。
(2)、计算所用过氧化氢溶液中溶质的质量分数为。