湖北省武汉市汉阳区2022年九年级五月调考化学试题
试卷更新日期:2022-08-31 类型:中考模拟
一、单选题
-
1. 下列叙述属于化学变化的是( )A、浓盐酸稀释 B、水力发电 C、钢铁生锈 D、碘的升华2. 为提高身体抵抗力,医学专家建议早餐应包含一定量的鸡蛋、牛奶等食物。这两种食物提供的主要基本营养素是( )A、糖类 B、油脂 C、蛋白质 D、维生素3. 根据如图所示实验,下端装水(滴入数滴红墨水),从上端倒入酒精后再加水,并立即用橡皮塞塞紧,下列说法错误的是( )
 A、酒精是一种由分子构成的有机物 B、酒精是易燃物,实验时应远离火源 C、混合后整个溶液变为红色说明分子在运动 D、混合后体积减小说明水和酒精分子体积变小4. 如图是氢氧化钠溶液与稀盐酸反应的微观示意图,下列有关该图示的说法正确的是( )
A、酒精是一种由分子构成的有机物 B、酒精是易燃物,实验时应远离火源 C、混合后整个溶液变为红色说明分子在运动 D、混合后体积减小说明水和酒精分子体积变小4. 如图是氢氧化钠溶液与稀盐酸反应的微观示意图,下列有关该图示的说法正确的是( ) A、反应前后,溶液的pH不变 B、向反应后溶液中滴加酚酞,溶液呈红色 C、该图表示氢氧化钠和盐酸恰好完全反应 D、该反应实质是Na+和Cl-结合生成NaCl5. 课堂上教师演示了下图甲、乙两个实验,已知白磷的着火点为40℃,红磷的着火点为240℃,下列说法错误的是( )
A、反应前后,溶液的pH不变 B、向反应后溶液中滴加酚酞,溶液呈红色 C、该图表示氢氧化钠和盐酸恰好完全反应 D、该反应实质是Na+和Cl-结合生成NaCl5. 课堂上教师演示了下图甲、乙两个实验,已知白磷的着火点为40℃,红磷的着火点为240℃,下列说法错误的是( ) A、向甲的水中的白磷持续通氧气,白磷会燃烧 B、甲中热水既能提供热量又有隔绝空气的作用 C、乙中鼓空气的主要作用是为了增大氧气的浓度 D、乙实验说明面粉是可燃物,面粉加工厂必须严禁烟火6. 中科院大连化学物理研究所研制出新型多功能复合催化剂,可将二氧化碳转化为汽油,过程示意如下图,已知X是一种单质,下列说法正确的是( )
A、向甲的水中的白磷持续通氧气,白磷会燃烧 B、甲中热水既能提供热量又有隔绝空气的作用 C、乙中鼓空气的主要作用是为了增大氧气的浓度 D、乙实验说明面粉是可燃物,面粉加工厂必须严禁烟火6. 中科院大连化学物理研究所研制出新型多功能复合催化剂,可将二氧化碳转化为汽油,过程示意如下图,已知X是一种单质,下列说法正确的是( ) A、该物质可能是C或H2 B、反应Ⅰ属于置换反应,反应Ⅱ属于化合反应 C、反应Ⅰ、Ⅱ中均有元素化合价发生改变 D、汽油中一定存在碳、氢、氧三种元素7. 如图所示实验方案不能达到实验目的的是( )A、
A、该物质可能是C或H2 B、反应Ⅰ属于置换反应,反应Ⅱ属于化合反应 C、反应Ⅰ、Ⅱ中均有元素化合价发生改变 D、汽油中一定存在碳、氢、氧三种元素7. 如图所示实验方案不能达到实验目的的是( )A、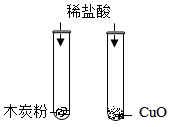 图Ⅰ鉴别木炭粉和CuO粉末
B、
图Ⅰ鉴别木炭粉和CuO粉末
B、 图Ⅱ除去一氧化碳中的水蒸气
C、
图Ⅱ除去一氧化碳中的水蒸气
C、 图Ⅲ检验待测液呈碱性
D、
图Ⅲ检验待测液呈碱性
D、 图Ⅳ除去NaCl溶液中少量的Na2CO3
8. 现有一包固体粉末M,可能由锌粉、铁粉、木炭粉、氧化铜、氧化亚铁(FeO)中的一种或几种组成,为了探究其组成,取m g固体进行如下如图所示的实验,得到滤渣质量为n g,在空气中充分灼烧固体质量仍为n g。(FeO在空气中灼烧会生成 Fe2O3或 Fe3O4)
图Ⅳ除去NaCl溶液中少量的Na2CO3
8. 现有一包固体粉末M,可能由锌粉、铁粉、木炭粉、氧化铜、氧化亚铁(FeO)中的一种或几种组成,为了探究其组成,取m g固体进行如下如图所示的实验,得到滤渣质量为n g,在空气中充分灼烧固体质量仍为n g。(FeO在空气中灼烧会生成 Fe2O3或 Fe3O4)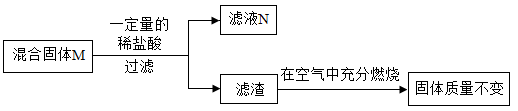
关于该实验有如下说法:
①若滤液 N为浅绿色,则混合物 M中一定有氧化亚铁。
②若固体粉末M含有铁,则m可能等于n。
③若充分反应后滤液N中含有四种阳离子,则滤渣一定为纯净物。
④若充分反应后滤液N中含有四种阳离子,则固体粉末M至少由四种物质组成。
⑤滤液N中一定含有氯化锌,可能含有氯化亚铁和氯化铜。
⑥混合物 M中一定有木炭粉,不能确定是否含有氧化亚铁和氧化铜。
其中说法正确的个数是( )
A、2 B、3 C、4 D、5二、填空题
-
9. 生活中处处有化学知识,请根据题意回答相关问题(1)、新型冠状病毒蔓延期间,为做好自我防护,要佩戴符合要求的口罩。活性炭口罩能有效阻隔氨、苯、甲醛等有害气体,因为活性炭具有性。(2)、电器着火,下列做法正确的是____。A、用水浇灭 B、用干粉灭火器灭火 C、用湿棉被覆盖住电器 D、立即打开所有门窗(3)、中药“石灰”是由生石灰和熟石灰混合而成,具有解毒蚀腐,敛疮止血、杀虫止痒的功效,写出生石灰变成熟石灰的反应方程式。10. 下表是硝酸钾、氯化钠、硫酸铈【Ce2(SO4)3】在不同温度下的溶解度
温度℃
物质
0
10
20
30
40
50
60
70
80
溶解度 /g
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138.0
169.0
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
Ce2(SO4)3
24.1
20.0
17.2
14.0
10.0
8.9
8.3
7.1
6.0
请回答下列问题:
(1)、三种物质中,的溶解度受温度影响最大。(2)、硫酸铈中混有少量的氯化钠,可采用结晶的方法提纯硫酸铈(填“升温”、“降温”、“蒸发”)。(3)、70℃时,将200.0g溶质质量分数为50%的KNO3溶液配成该温度下的饱和溶液,至少应向溶液中再加入g的硝酸钾固体。(4)、下列说法正确的是____。A、在20~30℃某个温度,硝酸钾和氯化钠的饱和溶液的质量分数可能相等 B、10℃饱和的硫酸铈溶液迅速升温到40℃,此时溶液的溶质质量分数不变 C、向等质量的水中分别加入氯化钠和硫酸铈的饱和溶液,其溶液质量分数可能相等 D、等质量的KNO3、NaCl、Ce2(SO4)3在50℃分别配成饱和溶液,降温至30℃,所得溶液质量由大到小的顺序为KNO3、Ce2(SO4)3、NaCl三、综合题
-
11. 医用氯化钙可用于补钙、抗过敏和消炎等,利用工业碳酸钙(含少量的氧化铁、氧化铝、二氧化硅)生产医用二水合氯化钙(CaCl2•2H2O),工艺流程如图所示:

已知:二氧化硅不溶于稀盐酸
(1)、滤渣Ⅰ为(写化学式)(2)、试剂甲是a.Na2CO3溶液 b.NaOH溶液 c.石灰乳 d.Ba(OH)2溶液
(3)、操作a采用蒸发、浓缩、过滤、、低温烘干得到CaCl2•2H2O。(4)、按此流程获得CaCl2•2H2O的产率偏高(忽略实验操作误差),你认为可能的原因是:。(5)、滤液Ⅰ得到的溶液中一定含有的离子有。12. 硫酸亚铁铵晶体【(NH4)aFeb(SO4)c· xH2O】(俗称摩尔盐晶体,相对分子质量为784)是一种重要的化工原料,用途十分广泛。为了定量探究硫酸亚铁铵晶体成分,兴趣小组称取此晶体样品78.4g,在科研人员的指导下用下图装置进行热分解实验。
【查阅资料】①硫酸亚铁铵晶体在200℃完全失去结晶水,剩余物在500℃完全分解为氧化铁、SO2、SO3、NH3和H2O。②1400℃后氧化铁能续继分解。③碱石灰是由NaOH和CaO混合制成,不仅能吸收水蒸气,还能吸收SO2、SO3、CO2、HCl等酸性气体。
(1)、装置D的仪器名称为。(2)、本实验加热前后及反应过程中均需通入N2 , 停止加热后继续通N2的目的是防止倒吸和。(3)、实验过程中装置D的作用是。(4)、控制温度在不同的范围对A中样品加热,测得装置B和C中的质量变化如下表,测得装置A剩余固体质量随温度的变化如下图所示。
温度/℃
室温
200
500
B装置/g
200.00
221.6
255.60
C装置/g
100.00
100.00
m
①根据图示数据,m=;硫酸亚铁铵晶体中,a:b:c:x=。
②写出B点的化学式。
③F点剩余固体物质的化学式为。
四、计算题
-
13. 常温下,一锥形瓶中盛有10g溶质质量分数为8%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
 (1)、图中B点溶液呈色(2)、计算稀盐酸中溶质质量分数(写出计算过程)
(1)、图中B点溶液呈色(2)、计算稀盐酸中溶质质量分数(写出计算过程)