广东省汕头市潮南区2022年中考模拟化学试题
试卷更新日期:2022-08-31 类型:中考模拟
一、单选题
-
1. 北京冬奥运会被称无与伦比奥运盛会,下列行为中主要是发生化学变化的是( )A、
 冰墩墩欢迎大家
B、
冰墩墩欢迎大家
B、 冬奥运圣火在燃烧
C、
冬奥运圣火在燃烧
C、 滑冰赛场上比赛
D、
滑冰赛场上比赛
D、 自由式滑雪技巧
2. 无人机的用途越来越广泛,可以用于航拍、喷洒农药等。制无人机框架宜选用密度小、强度高、硬度较大,化学稳定性好的金属材料,下列材料中最适合做无人机框架的是( )
自由式滑雪技巧
2. 无人机的用途越来越广泛,可以用于航拍、喷洒农药等。制无人机框架宜选用密度小、强度高、硬度较大,化学稳定性好的金属材料,下列材料中最适合做无人机框架的是( ) A、生铁 B、黄铜 C、铝合金 D、不锈钢3. “碳中和(carbon neutrality)”提倡通过植树造林、节能减排等形式,抵消二氧化碳排放,实现二氧化碳的“零排放”。下列行为不利于“碳中和”的是( )A、减少使用化石燃料 B、严禁乱砍滥伐森林 C、提倡使用节能产品 D、大力发展火力发电4. 水是一切生命赖以生存的根本。下列说法正确的是( )A、自然界中的水都是液态形式存在 B、电解水时正、负极产生的气体体积比为2:1 C、电解水实验时向水中加入硫酸钠溶液可以增强水的导电性 D、水由氧分子和氢原子组成5. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、
A、生铁 B、黄铜 C、铝合金 D、不锈钢3. “碳中和(carbon neutrality)”提倡通过植树造林、节能减排等形式,抵消二氧化碳排放,实现二氧化碳的“零排放”。下列行为不利于“碳中和”的是( )A、减少使用化石燃料 B、严禁乱砍滥伐森林 C、提倡使用节能产品 D、大力发展火力发电4. 水是一切生命赖以生存的根本。下列说法正确的是( )A、自然界中的水都是液态形式存在 B、电解水时正、负极产生的气体体积比为2:1 C、电解水实验时向水中加入硫酸钠溶液可以增强水的导电性 D、水由氧分子和氢原子组成5. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、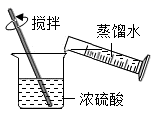 稀释浓硫酸
B、
稀释浓硫酸
B、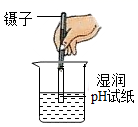 测稀硫酸的pH
C、
测稀硫酸的pH
C、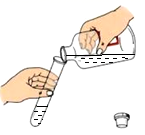 倾倒稀硫酸
D、
倾倒稀硫酸
D、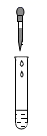 滴加稀硫酸
6. 下列有关推理正确的是( )A、同种元素的质子数相同,故质子数相同的微粒一定是同种元素 B、CO2能使紫色石蕊溶液变红,故CO也能使紫色石蕊溶液变红 C、中和反应一定生成盐,故生成盐的反应一定是中和反应 D、酸能使紫色石蕊溶液变红,故能使紫色石蕊溶液变红的溶液一定呈酸性7. 治疗胃酸(主要成分是HCl)过多,可服用含 的药片,制取这类药物不可以使用KOH替代 ,最不科学的理由是( )A、KOH与胃酸不反应 B、KOH易溶于水 C、KOH有强烈的腐蚀性 D、 的来源更广泛8. 化学让我们鉴赏了溶液的颜色美。下列物质溶于水后能得到无色溶液的是( )A、CuSO4 B、MgCl2 C、KMnO4 D、FeCl39. 化学符号是化学表达的重要工具,下列书写正确的是( )A、1个氢分子:H B、铝离子:Al3+ C、氧化铁化学式:FeO D、两个钠原子:Na210. 图所示是某反应的微观示意图。下列说法正确的是( )
滴加稀硫酸
6. 下列有关推理正确的是( )A、同种元素的质子数相同,故质子数相同的微粒一定是同种元素 B、CO2能使紫色石蕊溶液变红,故CO也能使紫色石蕊溶液变红 C、中和反应一定生成盐,故生成盐的反应一定是中和反应 D、酸能使紫色石蕊溶液变红,故能使紫色石蕊溶液变红的溶液一定呈酸性7. 治疗胃酸(主要成分是HCl)过多,可服用含 的药片,制取这类药物不可以使用KOH替代 ,最不科学的理由是( )A、KOH与胃酸不反应 B、KOH易溶于水 C、KOH有强烈的腐蚀性 D、 的来源更广泛8. 化学让我们鉴赏了溶液的颜色美。下列物质溶于水后能得到无色溶液的是( )A、CuSO4 B、MgCl2 C、KMnO4 D、FeCl39. 化学符号是化学表达的重要工具,下列书写正确的是( )A、1个氢分子:H B、铝离子:Al3+ C、氧化铁化学式:FeO D、两个钠原子:Na210. 图所示是某反应的微观示意图。下列说法正确的是( ) A、该反应属于置换反应 B、空气中该反应的发生能减少污染 C、参加反应的
A、该反应属于置换反应 B、空气中该反应的发生能减少污染 C、参加反应的 和
和 的分子个数比为2:3
D、该反应说明分子和原子在化学反应中都发生了改变
11. 利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
的分子个数比为2:3
D、该反应说明分子和原子在化学反应中都发生了改变
11. 利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )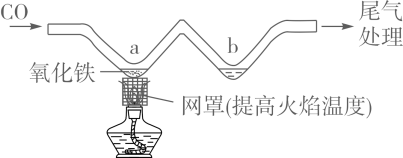 A、实验时应先点燃酒精灯后通CO B、充分加热,a处固体由黑色变为红色 C、b处可用澄清石灰水检验生成的CO2 D、可用NaOH溶液吸收尾气中的CO12. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )
A、实验时应先点燃酒精灯后通CO B、充分加热,a处固体由黑色变为红色 C、b处可用澄清石灰水检验生成的CO2 D、可用NaOH溶液吸收尾气中的CO12. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )选项
物质(括号内为杂质)
试剂及操作方法
A
CO2(CO)
通过灼热的氧化铜
B
CaO 固体(CaCO3)
加水溶解、过滤
C
Fe 粉(Cu 粉)
加入过量稀硫酸,过滤
D
FeSO4 溶液(CuSO4)
加入足量锌粒,充分反应,过滤
A、A B、B C、C D、D13. 几种固体物质的溶解度曲线如图所示,下列分析正确的是( )
 A、硝酸钾的溶解度大于氯化钾的溶解度 B、将60℃的硝酸钾溶液降温到0℃,不一定有晶体析出 C、在0℃-100℃之间的某一温度下,氢氧化钙的溶解度与氯化钾的溶解度可能相同 D、60℃时,硝酸钾的饱和溶液与氯化钾的饱和溶液相比,前者溶液中溶质的质量大14. 在奥运五环图中填入的五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型。下列说法中正确的是( )
A、硝酸钾的溶解度大于氯化钾的溶解度 B、将60℃的硝酸钾溶液降温到0℃,不一定有晶体析出 C、在0℃-100℃之间的某一温度下,氢氧化钙的溶解度与氯化钾的溶解度可能相同 D、60℃时,硝酸钾的饱和溶液与氯化钾的饱和溶液相比,前者溶液中溶质的质量大14. 在奥运五环图中填入的五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型。下列说法中正确的是( )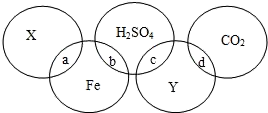 A、X可能是AgCl B、b处发生的反应后溶液呈黄色 C、c处可能生成白色沉淀 D、d处一定有白色沉淀生成15. 下列四个图像中,能正确反映对应变化关系的是 ( )
A、X可能是AgCl B、b处发生的反应后溶液呈黄色 C、c处可能生成白色沉淀 D、d处一定有白色沉淀生成15. 下列四个图像中,能正确反映对应变化关系的是 ( )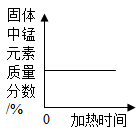



A.加热一定量的高锰酸钾固体
B.向两份完全相同的硫酸中,分别加入过量的铁粉和镁粉
C.向稀盐酸中滴加氢氧化钠溶液
D.将生锈严重的铁钉,放入到足量的稀盐酸中
A、A B、B C、C D、D二、填空题
-
16. “科技梦”助推“中国梦”,新材料的研发、科技的发展都离不开化学。(1)、2021年1月12日,江西省科研人员自主设计的“人造太阳”首次成功放电。“人造太阳”合理利用了可控核聚变,氘、氚是核聚变的热核材料。
原子种类
质子数
中子数
核外电子数
氘
1
1
1
氚
1
2
X
①氘和氚属于(填“同种”或“不同种”)元素的原子,上表中x=。
②贮存氘气的钢瓶禁止靠近明火,据此推测氘气具有的化学性质是。
(2)、2022年4月16日,我国神舟十三号返回舱成功着陆。飞船使用的超高强度钢材料和水气整合系统等引起了全世界的关注。①如果要比较超高强度钢材料中锰(Mn)和铁的活动顺序,以下方法不能达到目的的是(填字母)。
A.查阅现行九年级化学课本上的金属活动性顺序表
B.利用金属锰和FeSO4溶液进行实验
C.利用金属铁和MnSO4溶液进行实验
D.利用锰与铁互相刻划进行实验
②宇航员在太空出差的六个月里,需要的氧气和呼出的二氧化碳通过“水气整合系统”实现转化:光伏板产生的电能进行电解水,其中产生的氢气与二氧化碳在催化剂的作用下反应生成天然气的主要成分和水,水可循环利用,天然气排入太空。请写出二氧化碳转化为可循环水的化学方程式。
17. 经过学习,同学们提高了化学学科素养,学会用化学知识分析问题。请回答下列问题:(1)、持续防疫,化学助力。①佩戴口罩:佩戴口罩可以阻止飞沫进入口罩里面,起到的作用与(填实验操作)类似。
②接种疫苗:某款新冠肺炎疫苗所含辅料中含有的磷酸二氢钠其化学式为NaH2PO4 , 其中磷元素的化合价为。
③定期消毒:84消毒液的的消毒原理为NaClO+CO2+H2O=NaHCO3+X,生成的X有较强的杀菌作用,是一种酸,则X的化学式为。
④核酸检测:核酸检测作为新冠肺炎的决定性判断依据,核酸是脱氧核糖核酸(DNA)和核糖核酸(RNA)的总称。胞嘧啶(C4H5ON3)是DNA初步水解的产物之一。胞嘧啶(C4H5ON3)属于(填“无机物”“有机物”中的一项)。其中碳元素和氮元素的质量比为(填写最简整数比)。
(2)、北京冬奥会开幕式在“24节气”倒计时中拉开大幕,“24节气”是我国上古农耕文明的产物,农耕生产与节气息息相关。立春——春是温暖,春是生长。为促进作物生长,需加肥料,下列肥料属于复合肥的是____(填字母)。A、KNO3 B、K2SO4 C、NH4HCO3(3)、三星堆遗址被称为20世纪人类最伟大的考古发现之一。科研人员用X射线衍射分析技术测定三星堆出土的青铜神树外侧铜锈成分,得出该处铜锈由碱式碳酸铜【Cu2(OH)2CO3】和碱式氯化铜【Cu2(OH)3Cl】组成。根据OH-和两种离子的有关性质,试写出碱式碳酸铜【Cu2(OH)2CO3】和稀硫酸反应的化学方程式。三、综合题
-
18. 某兴趣小组通过以下实验探究气体的制取方法和性质。
已知:白色的无水硫酸铜与水反应生成蓝色的硫酸铜晶体:浓硫酸具有吸水性。

 (1)、实验室制二氧化碳反应的化学方程式为 , 发生装置选用图1中的 , 若用C装置收集的氧气不纯,可能的原因是(写出一种即可)。(2)、小华同学设计的实验装置(如图2),既可用于制取气体,又可用于验证物质性质。
(1)、实验室制二氧化碳反应的化学方程式为 , 发生装置选用图1中的 , 若用C装置收集的氧气不纯,可能的原因是(写出一种即可)。(2)、小华同学设计的实验装置(如图2),既可用于制取气体,又可用于验证物质性质。Ⅰ.当打开K1、关闭K2时,利用①、②装置可直接进行的实验是(填字母)。
A.过氧化氢溶液和二氧化锰混合制取氧气 B.锌与稀硫酸反应制取氢气
Ⅱ.实验Ⅰ中制得的气体不纯。小明同学认为杂质可能为水蒸气,这是科学探究中的。
A.提出问题 B.做出假设 C.进行实验 D.获得结论
打开K2、关闭K1 , 利用①、③装置来验证产生的气体中含水蒸气,此时仪器甲中盛放的物质是 , 可以观察到的现象是。
Ⅲ.仪器甲具有多种用途,某同学利用下图微型装置制氧气并验证氧气性质。实验过程中观察到的现象为 , 使用该微型装置的优点有。(回答一点即可)
 19. 造纸会产生大量含NaOH的废水,需经处理后再排放。环保监测小组取某造纸厂废水样品进行过滤,后取80g滤液于锥形瓶中,如图甲所示。向锥形瓶中逐滴滴加溶质质量分数为7.3%的稀盐酸,利用温度传感器和pH传感器测得反应过程中相关量的变化情况如图乙所示。(横坐标表示加入稀盐酸质量)
19. 造纸会产生大量含NaOH的废水,需经处理后再排放。环保监测小组取某造纸厂废水样品进行过滤,后取80g滤液于锥形瓶中,如图甲所示。向锥形瓶中逐滴滴加溶质质量分数为7.3%的稀盐酸,利用温度传感器和pH传感器测得反应过程中相关量的变化情况如图乙所示。(横坐标表示加入稀盐酸质量) (1)、由图乙推测中和反应是(填“放热”“吸热”)反应。(2)、根据图乙,计算80g废水滤液中含NaOH的质量。(写出计算过程)(3)、当滴加稀盐酸至溶液呈中性时,某同学画出溶液pH随加入稀盐酸质量的变化曲线如图丙所示。若改用溶质质量分数为14%的硫酸来处理80g上述废水滤液至中性,在图中画出溶液pH随加入稀硫酸质量的变化曲线,并标注必要的数据。
(1)、由图乙推测中和反应是(填“放热”“吸热”)反应。(2)、根据图乙,计算80g废水滤液中含NaOH的质量。(写出计算过程)(3)、当滴加稀盐酸至溶液呈中性时,某同学画出溶液pH随加入稀盐酸质量的变化曲线如图丙所示。若改用溶质质量分数为14%的硫酸来处理80g上述废水滤液至中性,在图中画出溶液pH随加入稀硫酸质量的变化曲线,并标注必要的数据。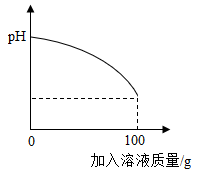 (4)、某同学另取80g上述废水滤液于锥形瓶中重复上述实验,向锥形瓶中滴加7.3%的稀盐酸的过程中意外发现有气泡产生,则当溶液都呈中性时,最终消耗稀盐酸的质量与上述实验相比(填“偏大”“偏小”或“不变”)。20. 化学探究小组的同学们在学习完了酸碱盐的化学性质后,进行了如图1所示的实验,请回答下列问题。
(4)、某同学另取80g上述废水滤液于锥形瓶中重复上述实验,向锥形瓶中滴加7.3%的稀盐酸的过程中意外发现有气泡产生,则当溶液都呈中性时,最终消耗稀盐酸的质量与上述实验相比(填“偏大”“偏小”或“不变”)。20. 化学探究小组的同学们在学习完了酸碱盐的化学性质后,进行了如图1所示的实验,请回答下列问题。 (1)、B试管中一定发生的反应其化学方程式为。(2)、同学们将B实验的固液混合物过滤,得到滤渣C和滤液D,同学们想要探究滤渣C和滤液D中溶质的成分。小丽同学取滤渣少许于试管中,向其中加入稀盐酸,固体质量变化情况如图2图像,则推测出滤渣的成分为(填化学式)。(3)、【提出问题】滤液D中含有哪些离子呢?
(1)、B试管中一定发生的反应其化学方程式为。(2)、同学们将B实验的固液混合物过滤,得到滤渣C和滤液D,同学们想要探究滤渣C和滤液D中溶质的成分。小丽同学取滤渣少许于试管中,向其中加入稀盐酸,固体质量变化情况如图2图像,则推测出滤渣的成分为(填化学式)。(3)、【提出问题】滤液D中含有哪些离子呢?甲同学猜想:Na+、Cl-、、Ba2+
乙同学猜想:Na+、Cl-、
丙同学猜想:Na+、Cl、、
你的猜想是: (写出一种可能的组合即可)
(4)、【讨论与交流】经过大家讨论,一致认为甲同学的猜想是错误的,理由是。
(5)、【实验验证】小明同学的验证方案是:先向滤液D中加入足量的溶液,若溶液中出现气泡的现象,而后再加入溶液,可以得出丙同学猜想的结论是正确的。
(6)、【反思与交流】根据小岗同学的经验,当溶液中有两种可能存在的离子要进行验证,要先加入一种足量试剂, , 再验证另一种可能存在的离子,就可以得出正确的结论。
21. 某废酸液主要含H2SO4和FeSO4 , 研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图: (1)、该废酸液的pH7(填“<”或“>”)。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,反应的化学方程式为。(4)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 , pH较低时产率较低的主要原因是。
(1)、该废酸液的pH7(填“<”或“>”)。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,反应的化学方程式为。(4)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 , pH较低时产率较低的主要原因是。溶液的pH
6.0
6.5
7.0
7.5
8.0
9.0
产物颜色
黄褐色
黄褐色
较黑
很黑
很黑
灰黑色
产率(%)
43.9
50.6
86.2
93.0
92.3
91.6
(5)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。工业上常用磁铁矿冶炼生铁,写出其原理的化学方程式。某同学发现用生铁与过量的稀硫酸充分反应后,容器底部总残留有黑色固体,该黑色固体中一定含有的成分是。