湖北省武汉市江夏区2022年5月中考模拟化学试题
试卷更新日期:2022-08-31 类型:中考模拟
一、单选题
-
1. 下列微粒中不能直接构成物质的是( )A、分子 B、原子 C、中子 D、离子2. 下列实验操作错误的是( )A、
 蒸发结晶
B、
蒸发结晶
B、 检查气密性
C、
检查气密性
C、 滴管用后不清洗
D、
滴管用后不清洗
D、 塞紧橡皮塞
3. 氢气是理想的清洁、高能燃料,液氢广泛应用于航天等领域。以下属于氢气化学性质的是( )A、无色、无臭 B、难溶于水 C、密度比空气的小 D、氢气可以燃烧4. 化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观示意图。
塞紧橡皮塞
3. 氢气是理想的清洁、高能燃料,液氢广泛应用于航天等领域。以下属于氢气化学性质的是( )A、无色、无臭 B、难溶于水 C、密度比空气的小 D、氢气可以燃烧4. 化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观示意图。
关于上述反应图示,下列说法错误的是( )
A、该反应属于置换反应 B、化学变化中分子可以分为原子,原子是化学变化中的最小粒子 C、反应前后,原子的种类没有改变,数目没有增减,原子的质量也没有改变 D、该反应中三种物质的化学计量数之比可以是2:1:25. 已知X能与Y反应生成MgSO4 和H2O,该反应可表示为:X+Y→MgSO4+mH2O(m为正整数),下列说法正确的是( )A、X可能是氧化镁、氢氧化镁或碳酸镁 B、X、Y中一定均含有氧元素 C、若m等于2时,则X和MgSO4质量比为1:3 D、该反应中一定有元素化合价的改变6. 如图所示进行有关碳及其氧化物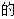 性质实验,下列说法错误的是( )
性质实验,下列说法错误的是( ) A、甲、乙两处的现象分别是黑色粉末减少、黑色粉末逐渐变红 B、丙处试管可防止液体倒吸 C、该装置的不足之处是未进行尾气处理 D、甲处发生的反应是典型的吸热反应7. 甲、乙、丙、丁为初中化学常见的物质,它们之间的关系如下图所示(“—”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质。反应条件、部分反应物和生成物已略去)。下列说法错误的是( )
A、甲、乙两处的现象分别是黑色粉末减少、黑色粉末逐渐变红 B、丙处试管可防止液体倒吸 C、该装置的不足之处是未进行尾气处理 D、甲处发生的反应是典型的吸热反应7. 甲、乙、丙、丁为初中化学常见的物质,它们之间的关系如下图所示(“—”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质。反应条件、部分反应物和生成物已略去)。下列说法错误的是( ) A、若甲为水,则丁可以是氧化物或盐 B、若甲为碳酸钠时,乙、丙、丁都可以是盐 C、若甲为金属时,可能实现甲、乙、丙、丁之间如图所示的转化 D、若甲、乙、丙、丁中有三种氧化物时,不能实现如图所示的转化8. 往100gFeCl3和CuCl2的混合溶液中加入铁粉。已知FeCl3会先与铁粉发生反应:2FeCl3+Fe=3FeCl2。下图为加入铁粉的质量与反应后剩余固体的质量关系。下列说法错误的是( )
A、若甲为水,则丁可以是氧化物或盐 B、若甲为碳酸钠时,乙、丙、丁都可以是盐 C、若甲为金属时,可能实现甲、乙、丙、丁之间如图所示的转化 D、若甲、乙、丙、丁中有三种氧化物时,不能实现如图所示的转化8. 往100gFeCl3和CuCl2的混合溶液中加入铁粉。已知FeCl3会先与铁粉发生反应:2FeCl3+Fe=3FeCl2。下图为加入铁粉的质量与反应后剩余固体的质量关系。下列说法错误的是( ) A、D点对应纵坐标为6.4 B、B点后溶液的颜色为蓝色 C、该100g溶液中的CuCl2的质量分数为13.5% D、取DE两点间(不含D)的剩余固体加入盐酸,均有气泡产生
A、D点对应纵坐标为6.4 B、B点后溶液的颜色为蓝色 C、该100g溶液中的CuCl2的质量分数为13.5% D、取DE两点间(不含D)的剩余固体加入盐酸,均有气泡产生二、填空题
-
9. 某同学利用如图装置研究稀盐酸与氢氧化钠溶液发生的中和反应,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到如图结果。
 (1)、仪器A中溶液的溶质是(填化学式)。(2)、烧杯中发生反应的化学方程式为。(3)、下列说法错误的是____。A、图中b点所示溶液中的溶质是NaCl和NaOH B、图中c→d所示溶液中NaCl的质量不断增加 C、图中e→f变化趋势可说明该反应是放热反应
(1)、仪器A中溶液的溶质是(填化学式)。(2)、烧杯中发生反应的化学方程式为。(3)、下列说法错误的是____。A、图中b点所示溶液中的溶质是NaCl和NaOH B、图中c→d所示溶液中NaCl的质量不断增加 C、图中e→f变化趋势可说明该反应是放热反应三、综合题
-
10. 下图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题。
 (1)、0℃时,乙物质的溶解度是。(2)、除去甲中混有的氯化钠,可采用的方法是。(3)、t3℃时,将甲、丙两物质的饱和溶液同时降温至℃,它们溶质的质量分数相等。(4)、下列说法正确的是____。A、向t2℃时甲的饱和溶液m1g和丙的饱和溶液m2g中分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等 B、t2℃时,分别向甲和乙的饱和溶液中加入等质量的水,所得溶液的质量分数可能相等 C、t3℃时,向50.0g质量分数为30%的甲溶液中加入10.0g固体甲,所得溶液中溶质的质量分数为37.5%11. 胆矾(CuSO4•5H2O)在工农业生产中有广泛的用途。(1)、探究一:制备胆矾。
(1)、0℃时,乙物质的溶解度是。(2)、除去甲中混有的氯化钠,可采用的方法是。(3)、t3℃时,将甲、丙两物质的饱和溶液同时降温至℃,它们溶质的质量分数相等。(4)、下列说法正确的是____。A、向t2℃时甲的饱和溶液m1g和丙的饱和溶液m2g中分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等 B、t2℃时,分别向甲和乙的饱和溶液中加入等质量的水,所得溶液的质量分数可能相等 C、t3℃时,向50.0g质量分数为30%的甲溶液中加入10.0g固体甲,所得溶液中溶质的质量分数为37.5%11. 胆矾(CuSO4•5H2O)在工农业生产中有广泛的用途。(1)、探究一:制备胆矾。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如下图所示:

已知氧化锌能与氢氧化钠溶液发生反应。反应方程式可表示为:ZnO+2NaOH=Na2ZnO2+X,则X的化学式为。
(2)、“酸溶”时,发生反应的化学方程式是。(3)、探究二:从胆矾中提取铜化学兴趣小组的同学利用胆矾为原料,从胆矾中提取铜,实验流程如下图所示(步骤IV中含有多步实验操作):

试剂B是。
(4)、步骤III中加入足量稀硝酸后可观察到的实验现象是。(5)、关于上述探究实验有如下说法,其中正确的是____。A、探究一“碱溶”步骤中,为加快反应速率可采取搅拌、加热等多种措施 B、探究一中可用洗洁精溶解电池铜帽表面的油污达到除油污目的 C、探究二中试剂B还可以是Zn、Fe等活泼金属 D、探究二所得的滤液②中一定含有的离子是Cu2+、12. 甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应。甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳。某化学小组为验证甲烷的组成并测定CuO粉末中CuO的质量分数,设计了如图所示实验。该实验装置气密性良好,实验中所用试剂均足量。
已知:白色无水CuSO4固体遇水会变蓝色。装置C、D、E中分别盛有白色无水CuSO4固体、碱石灰、澄清石灰水。
①实验步骤:
Ⅰ.称取10.0g含有铜粉的CuO粉末 Ⅱ.通入甲烷气体
Ⅲ.点燃酒精灯加热,充分反应后,停止加热 IV.继续通甲烷至玻璃管冷却
②有关现象:
①A中黑色固体变红色;②C中未见变蓝色;③E中未见出现浑浊。
③有关数据:
A中玻璃管及
物质总质量/g
B装置及物质
总质量/g
D装置及物质
总质量/g
反应前
110.0
132.0
130.0
反应后
108.4
132.9
131.1
请回答下列问题:
(1)、实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与(填序号)相同。A.用石灰石与稀盐酸制二氧化碳 B.用高锰酸钾制氧气(2)、装置B中的试剂应选用____(填序号)。A、澄清石灰水 B、氢氧化钠浓溶液 C、浓硫酸(3)、甲烷还原氧化铜的化学方程式为。(4)、含有铜粉的CuO粉末中CuO的质量分数为。(5)、若实验中CuO未完全反应,则根据实验数据测得的甲烷中碳、氢元素质量比值与实际值相比。(填“偏大”、“偏小”或“不变”)四、计算题
-
13. 小明用某纯碱样品(含少量氯化钠)进行了下图所示的实验。请计算:
 (1)、生成二氧化碳的总重量为g。(2)、所用稀盐酸的溶质质量分数为。
(1)、生成二氧化碳的总重量为g。(2)、所用稀盐酸的溶质质量分数为。
-