山东省枣庄滕州市2021-2022学年高一上学期期中考试化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 科学家为人类社会的进步做出巨大的贡献。下列研究成果与科学家对应不符合事实的是( )A、阿伏加德罗提出原子假说 B、侯德榜发明的侯氏制碱法推动了我国制碱工业的发展 C、屠呦呦因提取抗疟药青蒿素而获得诺贝尔奖 D、拉瓦锡建立的氧化学说使近代化学取得了革命性的进展2. 根据下列事实所得结论正确的是( )
事实
结论
A
SO2的水溶液能导电
SO2属于电解质
B
纯碱溶液显碱性
纯碱属于碱
C
Na2O2能与H2O反应生成NaOH和O2
Na2O2属于碱性氧化物
D
CO2能与NaOH反应生成Na2CO3和H2O
CO2属于酸性氧化物
A、A B、B C、C D、D3. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、18gH2O所含原子数为NA B、常温常压下,22.4LCO2所含分子数为NA C、0.5mol·L-1硫酸溶液中含有的H+数为NA D、3.2gO2和O3混合气体中的氧原子数为0.2NA4. 某学生利用如图所示装置对电解质溶液导电性进行实验探究。下列说法中正确的是( ) A、闭合开关K后,电流计
A、闭合开关K后,电流计 指针不发生偏转,证明酒精溶液是非电解质
B、闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C、用0.1mol·L-1的蔗糖溶液替换酒精溶液,电流计的示数相同,则蔗糖是非电解质
D、闭合开关,往烧杯中加NaCl固体,虽固体溶解,由于不反应,故电流计指针不偏转
5. 能正确表示下列化学反应的离子方程式的是( )A、氢氧化铜与硫酸的反应:OH-+H+=H2O B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag D、澄清的石灰水与醋酸反应:Ca(OH)2+2H+=Ca2++2H2O6. 随着科学的发展,学科之间的交叉综合越来越多,各个学科领域是相互联系的。下列变化不属于化学研究范畴的是( )A、疫情期间,新型冠状病毒COVID-19疫苗的研制 B、研制一款更加环保的易分解的塑料 C、将废旧的物品和不能直接利用的农产品通过技术转化成汽车燃料 D、研究物体的运动与运动规律7. 下列反应既是置换反应又是氧化还原反应的是( )A、2F2+2H2O=4HF+O2 B、Cl2+H2O=HCl+HClO C、3NO2+H2O=2HNO3+ NO D、2Na2O2+2H2O=4NaOH +O2↑8. 某同学用下列装置进行有关Cl2的实验,下列说法错误的是( )
指针不发生偏转,证明酒精溶液是非电解质
B、闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C、用0.1mol·L-1的蔗糖溶液替换酒精溶液,电流计的示数相同,则蔗糖是非电解质
D、闭合开关,往烧杯中加NaCl固体,虽固体溶解,由于不反应,故电流计指针不偏转
5. 能正确表示下列化学反应的离子方程式的是( )A、氢氧化铜与硫酸的反应:OH-+H+=H2O B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag D、澄清的石灰水与醋酸反应:Ca(OH)2+2H+=Ca2++2H2O6. 随着科学的发展,学科之间的交叉综合越来越多,各个学科领域是相互联系的。下列变化不属于化学研究范畴的是( )A、疫情期间,新型冠状病毒COVID-19疫苗的研制 B、研制一款更加环保的易分解的塑料 C、将废旧的物品和不能直接利用的农产品通过技术转化成汽车燃料 D、研究物体的运动与运动规律7. 下列反应既是置换反应又是氧化还原反应的是( )A、2F2+2H2O=4HF+O2 B、Cl2+H2O=HCl+HClO C、3NO2+H2O=2HNO3+ NO D、2Na2O2+2H2O=4NaOH +O2↑8. 某同学用下列装置进行有关Cl2的实验,下列说法错误的是( ) A、图I中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用 B、图II中:闻Cl2的气味、应吸入足量氯气 C、图III中:生成棕黄色的烟 D、图IV中:若气球膨胀,证明Cl2可与NaOH反应9. 除去氯气中混有的氯化氢气体,可将气体先通过( ),再通过盛有浓硫酸的洗气瓶。A、澄清石灰水 B、饱和碳酸氢钠溶液 C、饱和食盐水 D、苛性钠溶液10. 工业上利用粗硅制备高纯硅可通过如下反应实现(反应均已配平),①Si+3HClSiHCl3+X②SiHCl3+YSi+3HCl,下列说法错误的是( )A、X、Y为同一种物质 B、反应①②均为置换反应 C、由反应①②可知单质硅和单质氢还原性相同 D、反应①②均为氧化还原反应11. 在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )A、该溶液物质的量浓度为10mol·L-1 B、该溶液物质的量浓度因溶液的密度未知而无法求得 C、该溶液中溶质的质量分数因溶液的密度未知而无法求得 D、所得溶液的体积为22.5L12. 下列反应可用离子方程式“H++OH-=H2O”表示的是( )A、H2SO4溶液与Ba(OH)2溶液混合 B、CH3COOH溶液与Ca(OH)2溶液混合 C、HNO3溶液与KOH溶液混合 D、NaHCO3溶液与NaOH溶液混合13. ClO2是一种高效消毒剂,可通过反应2NaClO3+SO2+H2SO4 = 2ClO2+2NaHSO4制得,下列关于该反应的说法错误的是( )A、NaClO3发生氧化反应 B、SO2在反应中表现还原性 C、H2SO4 既不是氧化剂,也不是还原剂 D、转移1mol电子时,生成67.5g ClO214. 如图所示,将淀粉胶体和食盐溶液的混合物放入半透膜的袋子中,放入蒸馏水中,一段时间后,Na+和Cl-通过半透膜进入蒸馏水中,重复几次,可以得到纯净的淀粉胶体,该方法称为渗析。下列说法中错误的是( )
A、图I中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用 B、图II中:闻Cl2的气味、应吸入足量氯气 C、图III中:生成棕黄色的烟 D、图IV中:若气球膨胀,证明Cl2可与NaOH反应9. 除去氯气中混有的氯化氢气体,可将气体先通过( ),再通过盛有浓硫酸的洗气瓶。A、澄清石灰水 B、饱和碳酸氢钠溶液 C、饱和食盐水 D、苛性钠溶液10. 工业上利用粗硅制备高纯硅可通过如下反应实现(反应均已配平),①Si+3HClSiHCl3+X②SiHCl3+YSi+3HCl,下列说法错误的是( )A、X、Y为同一种物质 B、反应①②均为置换反应 C、由反应①②可知单质硅和单质氢还原性相同 D、反应①②均为氧化还原反应11. 在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )A、该溶液物质的量浓度为10mol·L-1 B、该溶液物质的量浓度因溶液的密度未知而无法求得 C、该溶液中溶质的质量分数因溶液的密度未知而无法求得 D、所得溶液的体积为22.5L12. 下列反应可用离子方程式“H++OH-=H2O”表示的是( )A、H2SO4溶液与Ba(OH)2溶液混合 B、CH3COOH溶液与Ca(OH)2溶液混合 C、HNO3溶液与KOH溶液混合 D、NaHCO3溶液与NaOH溶液混合13. ClO2是一种高效消毒剂,可通过反应2NaClO3+SO2+H2SO4 = 2ClO2+2NaHSO4制得,下列关于该反应的说法错误的是( )A、NaClO3发生氧化反应 B、SO2在反应中表现还原性 C、H2SO4 既不是氧化剂,也不是还原剂 D、转移1mol电子时,生成67.5g ClO214. 如图所示,将淀粉胶体和食盐溶液的混合物放入半透膜的袋子中,放入蒸馏水中,一段时间后,Na+和Cl-通过半透膜进入蒸馏水中,重复几次,可以得到纯净的淀粉胶体,该方法称为渗析。下列说法中错误的是( ) A、粒子直径小于1nm(10-9m)的分子和离子能通过半透膜 B、淀粉分子的直径在1nm~100nm之间 C、渗析法可以用来提纯胶体 D、用滤纸可以分离胶体和溶液15. 朱自清先生在《荷塘月色)中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”,关于月光穿过薄雾形成的种种美景的说法错误的是( )A、雾是一种胶体 B、光是一种胶体 C、美景形成了一种气溶胶 D、发生丁达尔效应16. 高铁酸钾()是一种环保、高效、多功能的饮用水处理剂,制备流程如图所示:
A、粒子直径小于1nm(10-9m)的分子和离子能通过半透膜 B、淀粉分子的直径在1nm~100nm之间 C、渗析法可以用来提纯胶体 D、用滤纸可以分离胶体和溶液15. 朱自清先生在《荷塘月色)中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”,关于月光穿过薄雾形成的种种美景的说法错误的是( )A、雾是一种胶体 B、光是一种胶体 C、美景形成了一种气溶胶 D、发生丁达尔效应16. 高铁酸钾()是一种环保、高效、多功能的饮用水处理剂,制备流程如图所示:
下列叙述错误的是( )
A、用对饮用水杀菌消毒的同时,还能吸附杂质起到净化饮用水的作用 B、用溶液吸收反应Ⅰ中尾气后可再利用 C、反应Ⅱ中氧化剂与还原剂的物质的量之比为3:2 D、该生产条件下,物质的溶解性:17. 在某透明的强酸性溶液中,能大量共存的无色离子组是( )A、K+、Na+、Cu2+、SO B、Na+、Al3+、Cl-、NO C、Na+、K+、CO、Cl- D、K+、SO、Cl-、Ba2+18. 经测定一瓶气体中只含有C、O两种元素,通常情况下这瓶气体不可能是( )A、一种化合物 B、一种单质和一种化合物的混合物 C、两种化合物 D、两种单质19. 某实验小组通过下图所示实验,探究Na2O2与水的反应: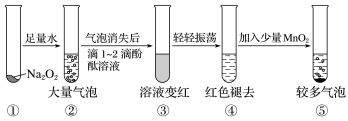
下列说法中正确的是( )
A、②中的大量气泡的主要成分是氢气 B、③中溶液变红,说明有酸性物质生成 C、④中现象可能是由于溶液中含有强氧化性物质造成的 D、⑤中MnO2的主要作用是降低了水中氧气的溶解度20. 关于Na2CO3和NaHCO3的说法错误的是( )A、加热可除去Na2CO3固体中的NaHCO3 B、Na2CO3和NaHCO3二者在一定条件下可以相互转化 C、热稳定性:NaHCO3>Na2CO3 D、相同物质的量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体的质量相同二、填空题
-
21. 钠、氯及其化合物在生产和生活中有广泛的应用。金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制的工业方法,其反应原理:2NaCl(熔融)2Na+Cl2↑。根据所学知识完成下列各题。(1)、下列各项中属于保存金属钠的正确方法是____。A、石蜡封存 B、放在细沙中 C、放在水中 D、放在煤油中(2)、将金属钠放入CuSO4溶液中会产生蓝色沉淀,请用化学方程式解释这一现象。(3)、将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,其现象为。请写出发生反应的化学方程式:。(4)、钠的一种氧化物常用于呼吸面具和潜水艇氧气的来源,用化学反应方程式表示其原理:。22. 食盐是有钠元素和氯元素组成的日常生活中使用最为广泛的调味品。从海水得到的粗食盐水中常含Ca2+、Mg2+、 , 需要分离提纯。现有含少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的食盐、某学生小组设计的提纯操作步骤和加入试剂的情况如图。
 (1)、第①步蒸馏水溶解粗盐后,获得“液体(浓)”的操作名称为 , 沉淀A的化学式。(2)、写出第⑤步操作中可能发生反应的离子方程式:;。(3)、请写出操作第④、⑤步所加试剂名称:④;⑤。(4)、有同学认为上述实验设计步骤可以简化,请你提出一种设想;。
(1)、第①步蒸馏水溶解粗盐后,获得“液体(浓)”的操作名称为 , 沉淀A的化学式。(2)、写出第⑤步操作中可能发生反应的离子方程式:;。(3)、请写出操作第④、⑤步所加试剂名称:④;⑤。(4)、有同学认为上述实验设计步骤可以简化,请你提出一种设想;。三、综合题
-
23. 某次实验中预计需要使用480mL0.1mol·L-1的纯碱溶液,如图是某同学在实验室配制该溶液的流程图,回答下列问题:
 (1)、此配制过程中,溶解纯碱首次向烧杯中加入蒸馏水的体积约为mL。(2)、使用托盘天平的第一步操作是 , 需要称量纯碱的质量为。(3)、本次配制应选择的最主要仪器为(只写1个)。(4)、指出所给流程图中的操作有两个明显的不正确,请简要描述出不正确点:、。(5)、指出操作对所配制溶液浓度的影响(填写“偏大”“偏小”或“无影响”)。
(1)、此配制过程中,溶解纯碱首次向烧杯中加入蒸馏水的体积约为mL。(2)、使用托盘天平的第一步操作是 , 需要称量纯碱的质量为。(3)、本次配制应选择的最主要仪器为(只写1个)。(4)、指出所给流程图中的操作有两个明显的不正确,请简要描述出不正确点:、。(5)、指出操作对所配制溶液浓度的影响(填写“偏大”“偏小”或“无影响”)。①溶解、转移溶液后,没有洗涤玻璃棒及烧杯:。
②定容时仰视刻度线:。
③容量瓶未干燥,有少量蒸馏水:。
24. 某课外活动小组用氯化铁制备Fe(OH)3胶体并检验其性质。(1)、现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。①甲同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:(填“甲”、“乙”或“丙”),发生的化学反应方程式是。
(2)、用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论。(3)、Fe(OH)3胶体稳定存在的主要原因是。(4)、下列说法中属于Fe(OH)3胶体区别于FeCl3溶液的选项共有____个(填阿拉伯数字)。A、分散质Fe(OH)3胶体粒子的直径在1~100nm之间 B、Fe(OH)3胶体具有丁达尔效应 C、Fe(OH)3胶体是均一稳定的分散系 D、分散质Fe(OH)3胶体粒子能透过滤纸 E、Fe(OH)3胶体为红褐色透明状液体