黑龙江省”五校联谊“2021-2022学年高一上学期期中考试化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、焰色试验为物理变化 B、醋酸、纯碱、烧碱、生石灰分别属于酸、碱、盐、氧化物 C、可用过滤法分离由溶液和氢氧化铁沉淀组成的混合物 D、浓盐酸属于混合物,液氯、干冰均属于纯净物2. 下列物质属于电解质的是( )A、 B、 C、食醋 D、3. 下列叙述中正确的是( )A、物质的溶解过程实质上就是其电离过程 B、纯净的液态酸不导电,故酸都不是电解质 C、溶于水后,溶液中只含有和 D、向溶液中通入气体至溶液呈中性,溶液的导电能力几乎不变4. 下列说法中正确的是( )A、铁丝和铜丝都可以在氯气中燃烧 B、钠粒投入硫酸铝溶液中,可置换出铝 C、铁丝在空气中燃烧生成黑色的四氧化三铁 D、久置的氯水,其剩余成分只有水5. 根据钠及其化合物的有关性质,试推断钠元素在自然界中存在的主要形式是( )A、 B、 C、 D、6. “有效氯”的含量定义:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯的“有效氯”的含量为( )A、 B、 C、 D、7. 长久未使用的铜质器皿中常含有“铜绿”(铜锈),它的化学成分是(碱式碳酸铜)。铜在潮湿的空气中生锈的化学方程式为。下列有关该反应的说法错误的是( )A、该反应是氧化还原反应 B、反应物中铜元素和氧气中的氧元素的化合价均发生了变化 C、该反应中得电子,失电子,被氧化 D、该反应中发生了还原反应8. 下列物质中能增强“”消毒液的使用效果的是( )A、稀硫酸 B、碳酸钙粉末 C、氢氧化钠固体 D、氯化钙粉末9. 已知还原性: , 据此判断下列反应不能发生的是( )A、 B、 C、 D、10. 钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )A、K是银白色金属,硬度大,熔点高 B、K在空气可以被空气中的氧气所氧化,且产物只有K2O C、K与水能够反应,但不如Na与水的反应剧烈,产物都有氢气 D、K也可以与氯气反应,且比Na与氯气的反应剧烈11. 将Na2CO3固体加入含下列离子的溶液中,溶液中原离子还能够大量存在的是( )A、 B、 C、 D、12. 下列反应中电子转移的方向和数目表示正确的是( )A、
 B、
B、 C、
C、 D、
D、 13. 下列指定反应的离子方程式正确的是( )A、向溶液中加入过量溶液: B、向溶液中滴加几滴溶液: C、用醋酸除去热水瓶中水垢: D、除去混在铁粉中的铝:14. 下表中,对陈述Ⅰ、Ⅱ的符合题意性及两者间是否具有因果关系的判断都正确的是( )
13. 下列指定反应的离子方程式正确的是( )A、向溶液中加入过量溶液: B、向溶液中滴加几滴溶液: C、用醋酸除去热水瓶中水垢: D、除去混在铁粉中的铝:14. 下表中,对陈述Ⅰ、Ⅱ的符合题意性及两者间是否具有因果关系的判断都正确的是( )选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃酸过多
碳酸钠可与硫酸反应
Ⅰ对,Ⅱ对,有
B
将Na2O2加入酚酞溶液中,酚酞变红色
过氧化钠与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠保存在煤油中以隔绝空气
常温下,金属钠在空气中会生成过氧化钠
Ⅰ对,Ⅱ对,有
D
过氧化钠可用作航天员的供氧剂
过氧化钠能和CO2、H2O反应生成氧气
Ⅰ对,Ⅱ对,有
A、A B、B C、C D、D15. 在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )A、溶液中Na+浓度增大,有O2放出 B、溶液碱性不变,有H2放出 C、溶液中Na+数目减少,有O2放出 D、溶液碱性增强,有O2放出16. 某容器中发生一个化学反应,反应过程中存在、、、、和六种粒子,在反应过程中测得、的质量分数(w)随时间变化的曲线如图所示。下列有关判断中错误的是( ) A、在反应中被还原,发生还原反应 B、还原性: C、该反应中被氧化为 D、在反应中参加反应的还原剂与氧化剂的个数之比为
A、在反应中被还原,发生还原反应 B、还原性: C、该反应中被氧化为 D、在反应中参加反应的还原剂与氧化剂的个数之比为二、填空题
-
17. 现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液。(1)、上述物质中属于电解质的物质序号为;属于非电解质的物质序号为。(2)、有两种物质发生反应的离子方程式为:H++OH˗=H2O,这两种物质的序号是。(3)、加入盐酸、NaOH溶液均能发生化学反应的物质序号为。(4)、能导电的物质序号为。(5)、④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)。
三、综合题
-
18. 有一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的成分,某化学兴趣小组进行如图所示的实验:

已知:步骤I中固体全部溶解,且无气泡产生。请回答下列问题:
(1)、原固体中一定含有的物质是(填化学式)。(2)、原固体中一定不含有的物质是(填化学式),原因是。(3)、写出步骤II中生成白色沉淀的离子方程式:。(4)、步骤I所得蓝色溶液中含有的溶质是。(填化学式)19. 某实验小组欲在实验室探究氯气的性质和模拟工业上制取漂白粉,设计了如下装置进行实验。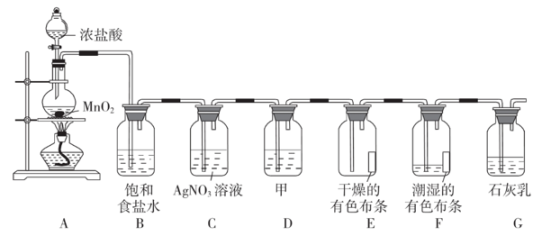
回答下列问题:
(1)、装置中发生反应的离子方程式为 , 装置的作用是。(2)、实验时,观察到装置中出现的现象是 , 出现该现象的原因是。(3)、若装置中布条不褪色,装置中布条褪色,则装置中盛放的试剂甲是(填名称)。(4)、装置中生成漂白粉,漂白粉的有效成分是 , 漂白粉应密闭保存,请说明原因:。20. 纯碱是一种重要的化工原料,广泛应用于玻璃造纸、纺织和洗涤剂的生产。(1)、起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为。(2)、1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出一种无色、有刺激性气味的气体,其分子结构示意图为 , 该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备,该酸雾腐蚀金属铁的化学方程式为。 (3)、1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为____(填标号)。A、 B、 C、 D、(4)、“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是“索尔维制碱法”的改进,大大提高了原料的利用率,至今仍为全世界广泛采用。
, 该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备,该酸雾腐蚀金属铁的化学方程式为。 (3)、1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为____(填标号)。A、 B、 C、 D、(4)、“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是“索尔维制碱法”的改进,大大提高了原料的利用率,至今仍为全世界广泛采用。
①沉淀池中发生的化学反应方程式是。
②上述流程中X物质是(填化学式)。
③使原料氯化钠的利用率从提高到以上,主要是设计了(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是。
-