河南省郑州市十校2021-2022学年高一上学期期中联考化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 我国科学家屠呦呦因发现了用于治疗疟疾的青蒿素而获得了诺贝尔奖。下列关于青蒿素的研制过程经历的正确顺序为( )
①提取有效成分 ②广泛应用 ③测定结构 ④确定组成 ⑤获得晶体 ⑥合成与修饰 ⑦研究的缘起
A、⑦①③④⑥⑤② B、⑦①⑤④③⑥② C、⑦④③①⑥⑤② D、⑦①⑤③④⑥②2. 化学科学与生产、生活密切相关。下列说法错误的是( )A、用活性炭为糖浆脱色和用次氯酸漂白纸浆的原理不同 B、在酸性物质存在的情况下,碳酸氢钠作膨松剂效果更好 C、研究物质性质的基本方法有观察法、实验法、分类法、比较法等 D、1803年,道尔顿提出的“分子学说”为近代化学的发展奠定了坚实的基础3. 下列图示对应的操作规范的是( )A、称量 B、过滤
B、过滤 C、将剩余钠放回试剂瓶
C、将剩余钠放回试剂瓶 D、转移溶液
D、转移溶液 4. 设NA为阿伏加德罗常数的数值。下列说法正确的是( )A、常温常压下,11.2 L N2含有的原子数目小于NA B、常温常压下,1.7 g H2O2中含有的电子数为NA C、标准状况下,32g O2和O3的混合气体所含原子数为2.5NA D、测得NA个H2的体积为22.4L,则该气体一定处于标准状况5. 某溶液中含有HCO 、CO 、Na+、NO 离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )A、NO B、HCO 、NO C、Na+、NO D、CO 、NO 、Na+6. 下列各组物质中,按化合物、单质、混合物顺序排列的一组是( )A、烧碱、液氯、Fe(OH)3胶体 B、生铁、纯碱、熟石灰 C、干冰、铁、氯化氢 D、空气、氮气、苏打7. 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是( )
4. 设NA为阿伏加德罗常数的数值。下列说法正确的是( )A、常温常压下,11.2 L N2含有的原子数目小于NA B、常温常压下,1.7 g H2O2中含有的电子数为NA C、标准状况下,32g O2和O3的混合气体所含原子数为2.5NA D、测得NA个H2的体积为22.4L,则该气体一定处于标准状况5. 某溶液中含有HCO 、CO 、Na+、NO 离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )A、NO B、HCO 、NO C、Na+、NO D、CO 、NO 、Na+6. 下列各组物质中,按化合物、单质、混合物顺序排列的一组是( )A、烧碱、液氯、Fe(OH)3胶体 B、生铁、纯碱、熟石灰 C、干冰、铁、氯化氢 D、空气、氮气、苏打7. 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是( ) A、OH−+HCl=H2O+Cl− B、Ca(OH)2+Cu2+=Ca2++Cu(OH)2 C、Fe+Cu2+=Cu+Fe2+ D、Fe+2H+=Fe3++H2↑8. 某化学试剂厂不慎发生了氯气泄漏事故,下列关于安全处理措施错误的是( )A、紧急组织群众沿逆风方向疏散 B、处在该厂附近家中的群众,应用肥皂水浸湿毛巾捂住口鼻,向低洼处撤离 C、处在该厂实验室的工作人员,撤离时可以用NaHCO3溶液浸湿毛巾捂住口鼻 D、消防官兵赶到现场后,把泄漏的氯气钢瓶投入一盛有石灰水的水池中9. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。下列叙述错误的是( )
A、OH−+HCl=H2O+Cl− B、Ca(OH)2+Cu2+=Ca2++Cu(OH)2 C、Fe+Cu2+=Cu+Fe2+ D、Fe+2H+=Fe3++H2↑8. 某化学试剂厂不慎发生了氯气泄漏事故,下列关于安全处理措施错误的是( )A、紧急组织群众沿逆风方向疏散 B、处在该厂附近家中的群众,应用肥皂水浸湿毛巾捂住口鼻,向低洼处撤离 C、处在该厂实验室的工作人员,撤离时可以用NaHCO3溶液浸湿毛巾捂住口鼻 D、消防官兵赶到现场后,把泄漏的氯气钢瓶投入一盛有石灰水的水池中9. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。下列叙述错误的是( )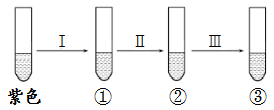 A、过程I溶液由紫色变成红色,起作用的微粒是H+ B、过程Ⅱ溶液由红色变成无色,证明试管②溶液不再呈酸性 C、过程Ⅲ溶液颜色由无色变成浅黄绿色,证明溶液中有Cl2 D、若向紫色石蕊试液中持续加入Na2O2粉末,最终颜色会褪去10. 化学是一门研究物质的组成、结构、性质、转化及其应用的科学。下列说法正确的是( )A、胆矾、冰水混合物、四氧化三铁都是纯净物 B、NaCl、CO2的水溶液均能导电,二者均属于电解质 C、CaCl2 、KCl在水中均易电离,且水溶液的导电能力相同 D、Na2O、Na2O2均属于碱性氧化物,都能与酸性氧化物CO2反应11. 下列实验现象描述正确的是( )A、氢气在氯气中燃烧,产生淡蓝色火焰,瓶口上方有白雾 B、金属钠在氯气中燃烧,产生白色烟雾,产物溶于水产生无色气体 C、铁丝在氯气中燃烧,产生红棕色烟,产物溶于少量的水得浅绿色溶液 D、铜在氯气中燃烧,产生棕黄色烟,产物溶于少量的水得蓝绿色溶液12. 下列实验操作、现象和结论均正确的是( )
A、过程I溶液由紫色变成红色,起作用的微粒是H+ B、过程Ⅱ溶液由红色变成无色,证明试管②溶液不再呈酸性 C、过程Ⅲ溶液颜色由无色变成浅黄绿色,证明溶液中有Cl2 D、若向紫色石蕊试液中持续加入Na2O2粉末,最终颜色会褪去10. 化学是一门研究物质的组成、结构、性质、转化及其应用的科学。下列说法正确的是( )A、胆矾、冰水混合物、四氧化三铁都是纯净物 B、NaCl、CO2的水溶液均能导电,二者均属于电解质 C、CaCl2 、KCl在水中均易电离,且水溶液的导电能力相同 D、Na2O、Na2O2均属于碱性氧化物,都能与酸性氧化物CO2反应11. 下列实验现象描述正确的是( )A、氢气在氯气中燃烧,产生淡蓝色火焰,瓶口上方有白雾 B、金属钠在氯气中燃烧,产生白色烟雾,产物溶于水产生无色气体 C、铁丝在氯气中燃烧,产生红棕色烟,产物溶于少量的水得浅绿色溶液 D、铜在氯气中燃烧,产生棕黄色烟,产物溶于少量的水得蓝绿色溶液12. 下列实验操作、现象和结论均正确的是( )选项
实验操作、现象
结论
A
将湿润的有色布条放入充满氯气的集气瓶中,布条褪色
氯气具有漂白性
B
向次氯酸钙溶液中通入过量CO2气体,无沉淀产生
酸性:HClO> H2CO3
C
盛有氯气的试管倒扣在水槽中,静置一段时间后,试管中液面上升一段距离
氯气能溶于水
D
用小刀切割金属钠,钠表面光亮的银白色迅速变暗
金属钠质软,易与水反应生成NaOH
A、A B、B C、C D、D13. 粗盐中含有泥沙以及Ca2+、Mg2+、SO等杂质,其提纯过程一般经过以下流程: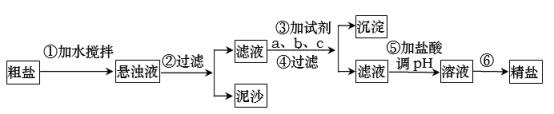
下列说法错误的是( )
A、步骤⑥获得精盐的操作方法是蒸发结晶 B、过滤时需要用到的玻璃仪器有烧杯、漏斗、玻璃棒 C、加盐酸调溶液pH的目的只是为了除去过量的OH- D、操作③按a、b、c顺序可依次加入过量的NaOH溶液、BaCl2溶液、Na2CO3溶液14. 在坩埚中放一小块钠加热,钠很快熔成圆球,停止加热,立即用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,产生耀眼的火花,并有轻微爆鸣声,同时有红色固体生成,经检验该红色固体与稀硫酸不反应。下列说法错误的是( )A、钠受热易熔成圆球说明其熔点低 B、钠与CuSO4粉末反应时放出大量热 C、将无水CuSO4粉末改为CuSO4溶液,反应现象相同 D、一定条件下,Na可以与CuSO4反应生成Cu15. 向一定浓度的Ba(OH)2溶液中滴加NaHSO4溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是( ) A、ab段发生反应的离子方程式是Ba2++ =BaSO4↓ B、bc段发生反应的离子方程式是Ba2++OH-+H++ =BaSO4↓+H2O C、c点溶液中大量存在的离子是Na+、 D、b、d两点对应溶液中的离子总数目相等16. 在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1.下列叙述中正确的是( )
A、ab段发生反应的离子方程式是Ba2++ =BaSO4↓ B、bc段发生反应的离子方程式是Ba2++OH-+H++ =BaSO4↓+H2O C、c点溶液中大量存在的离子是Na+、 D、b、d两点对应溶液中的离子总数目相等16. 在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1.下列叙述中正确的是( )① c= ×100%
② c=
③ 若上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5w
④ 将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1 , 则加入水的体积应小于50 mL
A、①④ B、②③ C、①③ D、②④二、填空题
-
17. 淀粉是人类膳食中糖类的主要来源,在体内被酶水解为葡萄糖(C6H12O6)供机体利用。某病人血液化验单如图所示,其中葡萄糖测定值明显高于正常值(参考范围)。请回答下列问题:
××医院化验单
姓名:×××
项目
测定值
单位
参考范围
丙氨酸氨基转氨酶ALT
35
U/L
9~50
血清葡萄糖GLU
216↑
mg/dl
60~110
甘油三酯TG
217↑
mg/dl
50~200
总胆固醇TCH
179
mg/dl
150~220
注:1dl=100mL
(1)、27g葡萄糖中含碳原子的物质的量为 , 含氢原子数为。(2)、0.5mol葡萄糖在人体内完全转化为二氧化碳的体积(标准状况)是。(3)、该病人血清葡萄糖的物质的量浓度为。(4)、把淀粉溶液溶于沸水中,制成淀粉胶体。鉴别葡萄糖溶液和淀粉胶体的方法是 , 提纯、精制胶体的方法是。18. 84消毒液是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒,某84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:84消毒液
【有效成分】NaClO
【规格】1 000 mL
【质量分数】25%
【密度】1.192 g·cm-3
【使用方法】稀释100倍(体积比)后使用
(1)、工业上常用氯气与烧碱溶液制取84消毒液,写出该反应的离子方程式。(2)、某同学量取100 mL此84消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中c(NaClO)=mol·L-1。(3)、某化学实验小组欲用NaClO固体配制含25%NaClO的消毒液480mL。①请计算配制此溶液需称取NaClO固体的质量为g 。
②如图所示的仪器中配制溶液需要使用的是(填字母),还缺少的玻璃仪器是。
 (4)、若实验遇下列情况,导致所配溶液的物质的量浓度偏高是____(填字母)。A、定容时俯视刻度线 B、转移前,容量瓶内有蒸馏水 C、未冷却至室温就转移定容 D、定容时水加多了用胶头滴管吸出19. 离子反应广泛用于化学研究、化工生产、医疗诊断、环境保护等方面。现有四种溶液: A.盐酸 B.稀硫酸 C.NaOH溶液 D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3 mol·L-1 , 根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
(4)、若实验遇下列情况,导致所配溶液的物质的量浓度偏高是____(填字母)。A、定容时俯视刻度线 B、转移前,容量瓶内有蒸馏水 C、未冷却至室温就转移定容 D、定容时水加多了用胶头滴管吸出19. 离子反应广泛用于化学研究、化工生产、医疗诊断、环境保护等方面。现有四种溶液: A.盐酸 B.稀硫酸 C.NaOH溶液 D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3 mol·L-1 , 根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)溶液取用情况
溶液中存在的主要离子及其浓度
示例:只取溶液C
Na+ 和OH-物质的量浓度均为0.3mol·L-1
等体积混合溶液B和C
①
溶液A和D按体积比2:1混合
②
③
Ba2+物质的量浓度为0.1mol·L-1 ,
OH-物质的量浓度为0.2mol·L-1
三、综合题
-
20. 某化学小组利用下列装置,模拟呼吸面具中的有关反应原理测定样品中Na2O2的纯度。
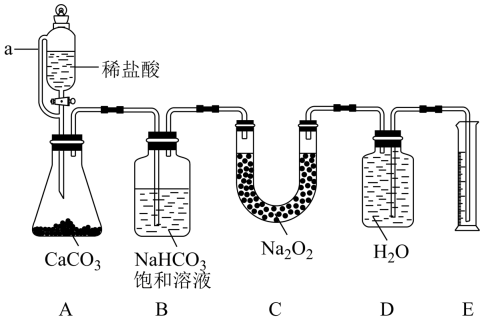 (1)、装置A中a的作用是;装置A中发生反应的离子方程式是。(2)、装置C中发生反应的化学方程式是。(3)、上述装置存在一处缺陷,会导致测定的Na2O2的纯度偏高,改进的方法是。(4)、实验装置改进后,向C中加入10.0g样品进行实验,试验结束后后共收集到标准状况下672mL气体,则样品中Na2O2的纯度为。(5)、实验室配置100mL 1.5mol·L-1稀盐酸,需要量取质量分数为36.5%,密度为1.20g·cm-3的浓盐酸mL。21. 膨松剂反应时单位质量产生标准状况下气体的体积(mL/g)是检验膨松剂品质的一项重要指标。某膨松剂中发挥作用的物质为碳酸氢钠。某化学兴趣小组为研究膨松剂的该项指标,设计了以下实验。按如图所示连接装置(气密性良好,各装置中的气体吸收剂皆为足量)。
(1)、装置A中a的作用是;装置A中发生反应的离子方程式是。(2)、装置C中发生反应的化学方程式是。(3)、上述装置存在一处缺陷,会导致测定的Na2O2的纯度偏高,改进的方法是。(4)、实验装置改进后,向C中加入10.0g样品进行实验,试验结束后后共收集到标准状况下672mL气体,则样品中Na2O2的纯度为。(5)、实验室配置100mL 1.5mol·L-1稀盐酸,需要量取质量分数为36.5%,密度为1.20g·cm-3的浓盐酸mL。21. 膨松剂反应时单位质量产生标准状况下气体的体积(mL/g)是检验膨松剂品质的一项重要指标。某膨松剂中发挥作用的物质为碳酸氢钠。某化学兴趣小组为研究膨松剂的该项指标,设计了以下实验。按如图所示连接装置(气密性良好,各装置中的气体吸收剂皆为足量)。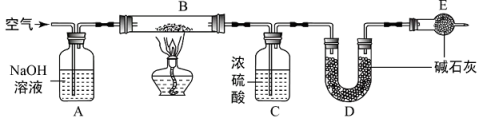
【资料】
a.浓硫酸常用于吸收水蒸气;
b. 碱石灰是固体氢氧化钠和氧化钙的混合物。
(1)、装置E的名称是。(2)、完成该实验要进行以下操作,正确的操作顺序为。①点燃酒精灯 ②熄灭酒精灯 ③连接上D、E装置 ④通入一段时间的空气 ⑤再通入一段时间的空气
(3)、实验中称取膨松剂6.0g,实验结束后装置(填装置对应的字母符号)增重1.32g,即为样品产生二氧化碳的质量。实验过程中装置B发生反应的化学方程式为 , 该膨松剂的该项指标为mL/g 。