山东省枣庄市薛城区2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 下列不属于新能源的是( )A、石油 B、太阳能 C、地热能 D、生物质能2. 下列说法中,错误的是( )A、锡铜合金在湿润环境中比干燥环境中更易生锈 B、生铁(铁碳合金)比纯铁更易生锈 C、钢柱在水下比在空气与水的交界处更易生锈 D、船泊浸在水中的部分挂有锌块能防止船泊生锈3. 下列关于反应∆U的说法中,正确的是( )A、∆U>0时,反应释放能量 B、∆U<0时,反应释放能量 C、∆U=Q D、∆U=∆H4. 如图中曲线表示一定条件下一定量的锌粒与足量的稀硫酸反应的过程。若使曲线b变为曲线a,可采取的措施是( )
 A、加入醋酸钠固体 B、加热使温度升高 C、加入氯化钠固体 D、加入少量的硫酸铜固体5. 研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
A、加入醋酸钠固体 B、加热使温度升高 C、加入氯化钠固体 D、加入少量的硫酸铜固体5. 研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ∆H1<0;
2NO(g)+Cl2(g)2ClNO(g) K2 ∆H2<0。
则反应4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数是( )
A、K12/K2 B、2K1-K2 C、2K1/K2 D、K12-K26. 已知:2N2O5(g)4NO2(g)+O2(g),该反应消耗2mol N2O5需吸收Q kJ的热量。某温度下,向2L的密闭容器中通入N2O5 , 部分实验数据如表:时间/s
0
500
1000
1200
n(N2O5)/mol
10.0
7.0
5.0
5.0
下列说法错误的是( )
A、在500 s内,分解速率为3×10-3mol·L-1·s-1 B、在1000 s时,反应为平衡状态 C、1000 s内,反应吸收热量为Q kJ D、在1100 s时,N2O5的正反应速率和逆反应速率相等7. 在测定中和反应反应热的实验中,下列叙述错误的是( )A、向小烧杯中加入盐酸,测量的温度为盐酸的起始温度 B、实验中可使酸或碱略过量 C、向小烧杯中加碱液时,碱液的温度应与酸的温度相同 D、可以用氢氧化钾代替氢氧化钠,浓硫酸代替盐酸8. Bodensteins研究了反应2HI(g)I2(g)+H2(g),某温度下的上述反应中,正反应速率为v正=k正c2(HI),逆反应速率为v逆=k逆c(I2)·c(H2),其中k正、k逆为速率常数,根据以上内容得出的结论,错误的是( )A、反应物浓度越大,正反应速率越大 B、生成物浓度越大,逆反应速率越大 C、该反应的平衡常数K=k正/k逆 D、速率常数的大小只与温度有关9. 一定温度下密闭容器中发生反应:N2(g)+3H2(g)2NH3(g),n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( ) A、点a的逆反应速率比点b的大 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处的n(N2)一样多 D、平衡常数K(e)>K(d)10. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述错误的是( )
A、点a的逆反应速率比点b的大 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处的n(N2)一样多 D、平衡常数K(e)>K(d)10. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述错误的是( ) A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整11. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2OPb+PbO2+2H2SO4。则下列说法正确的是( )
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整11. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2OPb+PbO2+2H2SO4。则下列说法正确的是( ) A、充电时:正极反应为PbSO4+2H2O-2e-→PbO2+4H++SO B、放电时:负极反应是PbSO4+2e-→Pb+SO C、放电时:电池中硫酸的浓度不断增大 D、充电时:铅蓄电池的负极应与充电器电源的正极相连12. 钴( )的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
A、充电时:正极反应为PbSO4+2H2O-2e-→PbO2+4H++SO B、放电时:负极反应是PbSO4+2e-→Pb+SO C、放电时:电池中硫酸的浓度不断增大 D、充电时:铅蓄电池的负极应与充电器电源的正极相连12. 钴( )的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )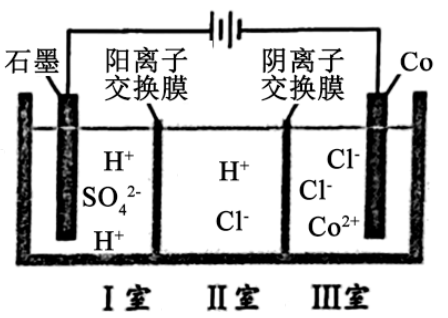 A、工作时,Ⅰ室和Ⅱ室溶液的 均增大 B、生成 ,Ⅰ室溶液质量理论上减少 C、移除两交换膜后,石墨电极上发生的反应不变 D、电解总反应:13. 酯在碱溶液中水解反应历程如图所示。下列说法错误的是( )
A、工作时,Ⅰ室和Ⅱ室溶液的 均增大 B、生成 ,Ⅰ室溶液质量理论上减少 C、移除两交换膜后,石墨电极上发生的反应不变 D、电解总反应:13. 酯在碱溶液中水解反应历程如图所示。下列说法错误的是( ) A、活化能:反应①>反应② B、反应①和②、总反应的∆H都小于0 C、反应①决定酯在碱溶液中水解的总速率 D、其他条件相同,增大碱的浓度能提高酯水解速率
A、活化能:反应①>反应② B、反应①和②、总反应的∆H都小于0 C、反应①决定酯在碱溶液中水解的总速率 D、其他条件相同,增大碱的浓度能提高酯水解速率二、多选题
-
14. 下列各组热化学方程式中,∆H的比较正确的是( )
①C(s)+O2(g)=CO2(g) ∆H1 C(s)+O2(g)=CO (g) ∆H2
②S(s)+O2(g)=SO2(g) ∆H3 S(g)+O2(g)=SO2(g) ∆H4
③H2(g)+O2(g)=H2O(l) ∆H5 2H2(g)+O2(g)=2H2O(l) ∆H6
④CaO(s)+H2O(l)=Ca(OH)2(s) ∆H7 CaCO3(s)=CaO(s)+CO2(g) ∆H8
A、∆H1<∆H2 B、∆H3<∆H4 C、∆H5>∆H6 D、∆H7>∆H815. 中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α-Fe2O3纳米棒列阵上(α-Fe2O3/Amine-RGO/ CsPbBr3),构筑Z-Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和H2O的反应路径如图所示。下列说法正确的是( ) A、该路径中能量转化形式为电能→化学能 B、“CsPbBr3纳米晶”表面发生了还原反应 C、该光催化转化反应可以阻止温室效应 D、该催化转化的总反应涉及共价键的断裂和形成
A、该路径中能量转化形式为电能→化学能 B、“CsPbBr3纳米晶”表面发生了还原反应 C、该光催化转化反应可以阻止温室效应 D、该催化转化的总反应涉及共价键的断裂和形成三、综合题
-
16. 工业上利用一氧化碳和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)CO2(g)+H2(g) ∆H=-41kJ/mol。某小组研究在同温度下该反应过程中的能量变化。他们分别在容积相等的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应,获得数据如下:
容器编号
起始时各物质的物质的量/mol
达平衡的时间/min
达平衡时体系能量的变化
CO
H2O
CO2
H2
①
1
4
0
0
t1
放出热量:32.8kJ
②
2.5
10
0
0
t2
放出热量:Q
回答下列问题:
(1)、该反应过程中,反应物分子化学键断裂时所吸收的总能量(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。(2)、容器①中反应达平衡时,生成H2的物质的量为。(3)、容器①的容积变为原来的一半,则CO的转化率(填“增大”、“不变”或“减小”)。(4)、到达平衡时间的关系:t1t2(填“大于”、“小于”或“等于”)。(5)、容器②中反应的平衡常数K= , Q=。17. 合成氨工业对国民经济和社会发展具有重要意义。回答下列问题:(1)、一定温度下的恒容密闭容器中进行的合成氨反应,能够说明合成氨反应达到平衡状态的是____(填标号)A、容器内N2、H2、NH3的浓度之比为1:3:2 B、v(N2)(正)=3v(H2)(逆) C、容器内压强保持不变 D、混合气体的密度保持不变(2)、如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数 。
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3) vB(NH3) (填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数(填“变大”、“变小”或“不变”)。
③在250℃、1.0×104Pa下,H2的转化率为%(计算结果保留小数点后1位)
(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将1mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是(用图中a、b、c、d表示),理由是。
18. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发CO2和CH4等利用技术,降低空气中二氧化碳含量成为研究热点。(1)、大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热(焓)数据如下表:物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧焓∆H/kJ·mol-1
-285.8
-393.5
-3267.5
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
(2)、CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:a.CH4(g)+CO2(g)2CO(g)+2H2(g) ∆H1 b.H2(g)+CO2(g)CO(g)+H2O(g) ∆H2
c.CH4(g)C(s)+2H2(g) ∆H3 d.2CO(g)CO2(g)+C(s) ∆H4
e.H2(g)+CO(g)C(s)+H2O(g) ∆H5
①上述反应体系在一定条件下建立平衡后,下列说法错误的有 (填标号)。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
②一定条件下,CH4分解形成碳的反应历程如下图所示。该历程分步进行,其中,第步的正反应活化能最大。

③设K为相对压力平衡常数,其表达式写法:在浓度的衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K随1/T(温度的倒数)的变化如下图所示。则反应a、c、e中,属于放热反应的有 (填字母):反应d的相对压力平衡常数表达式为K=。
 19. 碘在科研与生活中有重要应用,某兴趣小组用0.50mol/L KI、0.2%淀粉溶液、0.20mol/L K2S2O8、0.10mol/L Na2S2O3 , 等试剂,探究反应条件对化学反应速率的影响。
19. 碘在科研与生活中有重要应用,某兴趣小组用0.50mol/L KI、0.2%淀粉溶液、0.20mol/L K2S2O8、0.10mol/L Na2S2O3 , 等试剂,探究反应条件对化学反应速率的影响。已知:S2O+2I-=2SO+I2(慢) I2+2S2O=2I-+S4O(快)
(1)、向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为:n(S2O):n(S2O)。(2)、已知:实验序号
体积V/mL
K2S2O8溶液
水
KI溶液
Na2S2O3溶液
淀粉溶液
①
10.0
0.0
4.0
4.0
2.0
②
9.0
VX
4.0
4.0
2.0
③
8.0
2.0
4.0
4.0
VY
则,表中VX=mL,VY=mL;理由是。
(3)、已知某条件下,浓度c(S2O)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O)-t的变化曲线示意图(进行相应的标注)。 20. 合理开发利用能源具有重要意义。回答下列问题:(1)、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。
20. 合理开发利用能源具有重要意义。回答下列问题:(1)、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。
①电极b的名称是 , 电子的流动方向为。
②a极的电极反应式为。
③电池工作时,理论上反应消耗NH3与O2的物质的量之比为。
(2)、氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
①电解饱和食盐水的离子方程式。
②精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出。(选填“a”、“b”、“c”或“d”)
③离子交换膜的作用为:。