山东省潍坊市2021-2022学年高二上学期第一学段期中监测化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 有利于实现“碳达峰、碳中和”的是( )A、风能发电 B、掩埋废弃电池 C、开采可燃冰作为新能源 D、石油裂化2. 常温下,等物质的量浓度的下列四种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④NaHCO3 , 溶液中水的电离程度最大的是( )A、① B、② C、③ D、④3. 下列做法与盐的水解无关的是( )A、碳酸氢铵与草木灰不能混合使用 B、用热的苏打溶液除去餐具上的油渍 C、用硫酸铜溶液对游泳池中的水消毒 D、实验室配制FeCl3溶液时,向FeCl3溶液中加入少量的盐酸4. 下列离子方程式属于盐的水解,且书写正确的是( )A、NH4Cl溶液:NH+H2O=NH3·H2O+H+ B、AlCl3溶液:Al3++3H2OAl(OH)3↓+3H+ C、Na2CO3溶液:+H2O+OH- D、NaHCO3溶液:HCO+H2OH3O++ CO5. 下列措施中,不能加快化学反应速率的是( )A、煤作燃料燃烧时,将煤块碾磨成煤粉 B、铝片与稀盐酸反应时,加入少量的蒸馏水 C、H2O2分解制取氧气时,加入适量的MnO2 D、合成氨厂制备氨气时,适当升高温度6. 一定条件下,在容积为1 L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),2 min后测得生成0.06 mol NH3 , 则该段时间内用NH3来表示的化学反应速率为( )A、0.01 mol·L-1·min-1 B、0.02 mol·L-1·min-1 C、0.03 mol·L-1·min-1 D、0.06 mol·L-1·min-17. 下列测量化学反应速率的依据不可行的是( )
选项
化学反应
测量依据(单位时间内)
A
2H2O2(l)=2H2O(l)+O2(g)
温度、压强一定时,气体体积变化
B
Na2SO4+BaCl2=BaSO4↓+2NaCl
沉淀质量变化
C
CO(g)+H2O(g)⇌H2(g)+CO2(g)
温度、体积一定时,体系压强变化
D
H2O2+2HI=2H2O+I2
溶液体积一定时,I-的浓度变化
A、A B、B C、C D、D8. 制备水煤气的反应 ,下列说法正确的是( )A、该反应 B、升高温度,反应速率增大 C、恒温下,增大总压,H2O(g)的平衡转化率不变 D、恒温恒压下,加入催化剂,平衡常数增大9. 向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH-)>c(H+)的是( )A、NaHSO4固体 B、将水加热煮沸 C、NaClO固体 D、氨气10. 化学上把外加少量酸、碱而pH基本不变的溶液,称为缓冲溶液。25℃时,浓度均为0.10 mol·Lˉ1的HCN与NaCN等体积混合所得缓冲溶液pH=9.4。下列说法错误的是( )A、HCN的电离方程式为:HCN⇌H++CN- B、HCN的电离程度大于CN-的水解程度 C、向1.0 L上述缓冲溶液中滴加几滴NaOH稀溶液,溶液pH几乎不变 D、溶液中各离子浓度大小关系为:c(Na+)>c(CN-)>c(OH-)>c(H+)11. 工业生产硝酸过程中,反应I、II均会在氧化炉内发生。不同温度下,反应I、II的化学平衡常数如下表所示。下列说法正确的是( )温度
(K)
化学平衡常数
反应I:4NH3+5O2⇌4NO+6H2O
反应II:4NH3+3O2⇌2N2+6H2O
500
1.1×1026
7.1×1034
700
2.1×1019
2.6×1025
A、反应I、II的ΔH均大于0 B、氧化炉内NH3主要发生反应II C、改变氧化炉的压强可促进反应I而抑制反应II D、使用选择性催化反应I的催化剂,可增大氧化炉中NO的含量二、多选题
-
12. 将一定量的固体Ag2SO4置于1 L容积不变的密闭容器中,在一定温度下加入催化剂后发生下列反应:①Ag2SO4(s)⇌Ag2O(s)+SO3(g);②2SO3(g)⇌2SO2(g)+O2(g)。反应经过10 min后达到了平衡状态,测得c(SO3)=0.4 mol·L-1 , c(SO2)=0.1 mol·L-1。下列说法正确的是( )A、SO3(g)的分解率为20% B、此温度下反应①平衡常数K=0.4 mol·L-1 C、在上述平衡体系中再加入少量的Ag2O(s),再次达到平衡后c(SO3)将减小 D、若温度不变,体积缩小为原来的一半,n(SO2)不变13. 中国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol﹣1)如图所示,下列说法错误的是( )
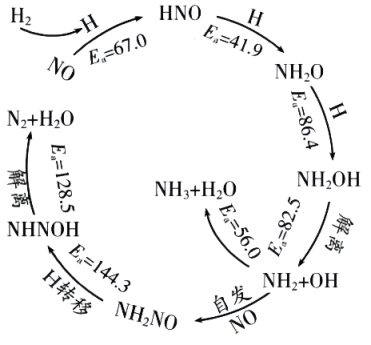 A、生成NH3的各基元反应中,N元素均被还原 B、在Pd/SVG催化剂上,NO更容易被H2还原为N2 C、决定NO生成NH3速率的基元反应为NH2NO→NHNOH D、生成NH3的总反应方程式为2NO+5H22NH3+2H2O14. 根据下列实验操作及现象所得出的结论或解释正确的是( )
A、生成NH3的各基元反应中,N元素均被还原 B、在Pd/SVG催化剂上,NO更容易被H2还原为N2 C、决定NO生成NH3速率的基元反应为NH2NO→NHNOH D、生成NH3的总反应方程式为2NO+5H22NH3+2H2O14. 根据下列实验操作及现象所得出的结论或解释正确的是( )选项
实验操作
实验现象
解释或结论
A
FeCl3+3KSCN⇌Fe(SCN)3+3KCl在平衡体系中加入KCl晶体
溶液颜色不变
加入少量KCl晶体,不会影响该化学平衡
B
取相同大小、形状和质量的Cu粒分别投入稀硝酸和浓硝酸中
Cu粒与浓硝酸反应更剧烈
实验目的是探究浓度对化学反应速率的影响
C
将20℃0.5mol·Lˉ1Na2CO3溶液加热到60℃,用传感器测定溶液pH
溶液的pH逐渐减小
Kw改变与水解平衡移动共同作用的结果
D
用pH试纸测得相同浓度的CH3COONa溶液、NaNO2溶液的pH
CH3COONa溶液pH约为9,NaNO2溶液的pH约为8
CH3COOH的酸性比HNO2强
A、A B、B C、C D、D15. 常温下向100 mL0.2 mol·Lˉ1的氨水中逐滴加入0.2 mol·Lˉ1的盐酸,所得溶液的pH、溶液中和NH3·H2O的物质的量分数φ与加入盐酸的体积V的关系如图所示,下列说法正确的是( ) A、表示NH3·H2O物质的量分数变化的曲线是B B、常温下,NH3·H2O的电离常数为1.8×10ˉ5 mol·Lˉ1(已知lg1.8=0.26) C、pH=9.26时的溶液中,NH3·H2O的电离程度小于的水解程度 D、当加入盐酸50 mL时,溶液中c()-c(NH3·H2O)=2×(10ˉ5-10ˉ9) mol·Lˉ1
A、表示NH3·H2O物质的量分数变化的曲线是B B、常温下,NH3·H2O的电离常数为1.8×10ˉ5 mol·Lˉ1(已知lg1.8=0.26) C、pH=9.26时的溶液中,NH3·H2O的电离程度小于的水解程度 D、当加入盐酸50 mL时,溶液中c()-c(NH3·H2O)=2×(10ˉ5-10ˉ9) mol·Lˉ1三、填空题
-
16. 硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:(1)、下列能说明硫酸是强酸、醋酸是弱酸的事实有(填序号)。
a.25℃,0.05mol·L-1H2SO4的pH=1,0.1mol·L-1CH3COOH的pH≈2.8
b.25℃,0.1mol·L-1Na2SO4溶液的pH=7,0.1mol·L-1CH3COONa溶液的pH>7
c.温度相同时,1mol·L-1H2SO4溶液的导电能力强于1mol·L-1CH3COOH溶液的导电能力
d.中和等物质的量的H2SO4和CH3COOH,前者消耗NaOH的物质的量是后者两倍
(2)、某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
实验编号
T/K
c(KI)/mol·Lˉ1
c(H2SO4)/mol·Lˉ1
实验目的
I
298
1
0.1
实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响
II
308
1
c
III
T
1
0.2
c= , T=。
②该实验中应该观察记录 , 为此,该实验中三种溶液混合的顺序不合理的是。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
c.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
(3)、实验表明,液态时纯硫酸的导电能力强于纯水。液态电解质都能像水那样自身电离而建立电离平衡。纯硫酸在液态时自身电离的方程式为 , 它在25℃时的离子积常数K(H2SO4)Kw(填“<”、“>”或“=”)。17. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:(1)、已知高炉炼铁过程中会发生如下反应:FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+CO(g)=Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度:250℃~600℃~1000℃~2000℃
主要成分:Fe2O3~Fe3O4~FeO~Fe
1600℃时固体物质的主要成分为 , 该温度下测得固体混合物中m(Fe)︰m(O)=35︰2,则FeO被CO还原为Fe的百分率为(设其它固体杂质中不含Fe、O元素)。
(2)、铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1 mol CO和3 mol H2加入容积为1 L的密闭容器中。实验测得CO的体积分数χ(CO)如下表:
t/min
0
10
20
30
35
χ(CO)
0.25
0.20
0.17
0.15
0.15
①前10 min内,CO的平均反应速率υ(CO)=(保留两位有效数字)。
②达到平衡时,体系的总压强p与初始压强之比p0 , p∶p0=;
③下图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是 , 理由是。
④45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol H2 , 再次达到平衡时,CO的平衡转化率(填“>”、“<”或“=”)30 min时CO的平衡转化率。
18. 弱电解质的研究是重要课题。(1)、①水溶液中碳元素的存在形态随pH变化如图所示。
下列说法正确的是(填序号)。
a.A点,溶液中H2CO3和浓度相同
b.pH=8时,溶液中含碳元素的微粒主要是
c.当c()=c()时,c(H+)>c(OHˉ)
②向上述pH=8.6的水溶液中加入NaOH溶液时,发生反应的离子方程式是。
(2)、碳酸及部分弱酸的电离平衡常数如下表。弱酸
H2S
H2CO3
HClO
电离平衡常数(25℃)
K1=1.3×10ˉ7
K2=7.1×10ˉ15
K1=4.4×10ˉ7
K2=4.7×10ˉ11
K=1.0×10ˉ8
①H2S、H2CO3、HClO的酸性由强到弱的顺序为。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:。
(3)、25℃,0.01mol·L-1NaClO溶液的pH= , 若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取),证明碳酸是弱电解质,你的设计方案是。四、综合题
-
19. 汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。回答下列问题:(1)、消除CO、NO污染物的反应机理如下[Pt(s)表示催化剂,带“*”表示吸附状态]:
I.NO+Pt(s)=NO*
II.CO+Pt(s)=CO*
III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s)
V.N*+N*=N2+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图一和图二所示。

①图一中温度从Ta℃升至Tb℃的过程中,反应物浓度急剧减小的主要原因是。
②由图二知,T2℃时反应V的活化能反应IV的活化能(填“<”、“>”或“=”)。
(2)、为模拟汽车的“催化转化器”,将2molNO(g)和2molCO(g)充入1L密闭容器中,加入催化剂后发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图三所示。①图像中A点正反应速率逆反应速率(填“>”、“=”或“<”);T1℃,下列说法能表明该反应已达到平衡状态的是(填序号)。
a.混合气体的密度不变 b.体系的压强不变
c.混合气体中N2的体积分数不变 d.2υ正(CO)=υ逆(N2)
②T1℃,该反应的化学平衡常数Kc=(mol·L-1)-1。
③T2℃时,实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆分别是正、逆反应速率常数。则T2℃时k正∶k逆=1∶。
20. NH3是一种重要的化工原料。已知:反应I:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH1=﹣905.0kJ·molˉ1
反应II:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH2=﹣1260kJ·molˉ1
(1)、在恒温恒容装置中充入一定量的NH3和O2 , 在某催化剂的作用下进行反应I,则下列有关叙述中正确的是____(填序号)。A、使用催化剂时,可降低该反应的活化能,加快其反应速率 B、若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡 C、当容器内=1时,说明反应已达平衡(2)、氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2 , 测得有关物质的量关系如下图:
①该催化剂在高温时选择反应(填“I”或“II”)。
②520℃时,4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)的平衡常数K=(不要求得出计算结果,只需列出数字计算式)。
(3)、工业上常用氨水吸收烟气中的SO2。①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈性(填“酸”或“碱”)(常温下电离平衡常数H2SO3:Ka1=1.3×10ˉ2mol·Lˉ1 , Ka2=6.3×10ˉ8mol·Lˉ1 , 氨水:Kb=1.8×10ˉ5mol·Lˉ1;)
②上述溶液中通入(填“SO2”或“NH3”)气体可使溶液呈中性,此时溶液中离子浓度由大到小的顺序为。