江苏省徐州市铜山区2021-2022学年高二上学期期中考试(选择考)化学试题
试卷更新日期:2022-08-30 类型:期中考试
一、单选题
-
1. 化学是你,化学是我,化学与我们的生活密切相关,以下有关说法错误的是( )A、用于制作车辆风挡的有机玻璃(聚甲基丙烯酸甲酯)可通过加聚反应得到 B、典型的“绿色能源”——生物柴油中含有芳香烃 C、糯米砂浆被称为“有机砂浆”,是由于糯米的主要成分为天然有机高分子 D、在钢铁制造的船舷上镶有锌块,可减轻海水对船体的腐蚀2. 下列表示正确的是( )A、甲醛的电子式 B、乙烯的球棍模型
 C、2-甲基戊烷的键线式
C、2-甲基戊烷的键线式 D、甲酸乙酯的结构简式
3. 下列物质的性质和用途叙述均正确,且有因果关系的是( )A、乙烯能被酸性高锰酸钾溶液氧化,所以用浸泡过高锰酸钾溶液的硅藻土保鲜水果 B、淀粉溶液遇会变蓝,所以可用淀粉溶液检验海水中是否含碘元素 C、某些油脂常温时是固态,所以可用于制作肥皂 D、乙醇可使蛋白质变性,所以在医药上用的酒精来杀菌消毒4. 表示下列变化的化学用语中,正确的是( )A、钢铁吸氧腐蚀的正极反应式: B、 C、苯酚钠溶液中通入少量的:2
D、甲酸乙酯的结构简式
3. 下列物质的性质和用途叙述均正确,且有因果关系的是( )A、乙烯能被酸性高锰酸钾溶液氧化,所以用浸泡过高锰酸钾溶液的硅藻土保鲜水果 B、淀粉溶液遇会变蓝,所以可用淀粉溶液检验海水中是否含碘元素 C、某些油脂常温时是固态,所以可用于制作肥皂 D、乙醇可使蛋白质变性,所以在医药上用的酒精来杀菌消毒4. 表示下列变化的化学用语中,正确的是( )A、钢铁吸氧腐蚀的正极反应式: B、 C、苯酚钠溶液中通入少量的:2 +H2O+CO2→2
+H2O+CO2→2 +
D、惰性电极电解硝酸银溶液的阳极反应式:
5. 某有机物的结构如右图所示,关于该有机物下列说法正确的是 ( )
+
D、惰性电极电解硝酸银溶液的阳极反应式:
5. 某有机物的结构如右图所示,关于该有机物下列说法正确的是 ( ) A、分子与足量溶液完全反应后生成的钠盐有2种 B、该有机物分子存在顺反异构 C、分子完全水解后所得有机物分子中手性碳原子数目为1个 D、分子可以在醇溶液加热条件下发生消去反应6. 下列有关实验装置正确且能达到实验目的的是( )
A、分子与足量溶液完全反应后生成的钠盐有2种 B、该有机物分子存在顺反异构 C、分子完全水解后所得有机物分子中手性碳原子数目为1个 D、分子可以在醇溶液加热条件下发生消去反应6. 下列有关实验装置正确且能达到实验目的的是( ) A、装置甲:分离乙醇和乙酸 B、装置乙:实验室制备少量乙烯 C、装置丙:制取少量乙酸乙酯 D、装置丁:比较乙酸、碳酸、硅酸三者酸性强弱7. 下列化学方程式或离子方程式书写错误的是( )A、乙醇与浓氢溴酸反应: B、用铜作电极电解硫酸铜溶液: C、甲烷燃料电池(以铂为电极、溶液为电解质溶液)负极的电极反应: D、乙醛溶液中加入足量的银氨溶液并加热:8. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是( )
A、装置甲:分离乙醇和乙酸 B、装置乙:实验室制备少量乙烯 C、装置丙:制取少量乙酸乙酯 D、装置丁:比较乙酸、碳酸、硅酸三者酸性强弱7. 下列化学方程式或离子方程式书写错误的是( )A、乙醇与浓氢溴酸反应: B、用铜作电极电解硫酸铜溶液: C、甲烷燃料电池(以铂为电极、溶液为电解质溶液)负极的电极反应: D、乙醛溶液中加入足量的银氨溶液并加热:8. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是( )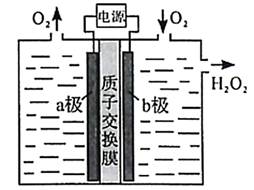 A、阳极反应为 B、电解一段时间后,阳极室的pH未变 C、电解过程中,H+由a极区向b极区迁移 D、电解一段时间后,a极生成的O2与b极反应的O2等量9. 下列操作不能达到实验目的的是 ( )
A、阳极反应为 B、电解一段时间后,阳极室的pH未变 C、电解过程中,H+由a极区向b极区迁移 D、电解一段时间后,a极生成的O2与b极反应的O2等量9. 下列操作不能达到实验目的的是 ( )选项
实验目的
操作或装置
A
除去苯中少量的苯酚
加入足量浓溴水后过滤
B
制备

C
验证铁钉发生了吸氧腐蚀

D
检验麦芽糖中含有醛基
取样品加入新制悬浊液中并加热
A、A B、B C、C D、D10. 一种活性物质的结构简式为 , 下列有关该物质的叙述正确的是( ) A、能发生取代反应,不能发生加成反应 B、既是乙醇的同系物也是乙酸的同系物 C、与
, 下列有关该物质的叙述正确的是( ) A、能发生取代反应,不能发生加成反应 B、既是乙醇的同系物也是乙酸的同系物 C、与 互为同分异构体
D、该物质与碳酸钠反应得
11. 相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法错误的是 ( )
互为同分异构体
D、该物质与碳酸钠反应得
11. 相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法错误的是 ( ) A、a电极的电极反应式为 B、电池放电过程中,电极上的电极反应式为 C、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 D、电池从开始工作到停止放电,电解池理论上可制得12. 下列说法正确的是( )A、蛋白质溶液中加入饱和溶液可发生盐析 B、由反应可知,甲烷的燃烧热为 C、铅蓄电池放电时的正极反应式为 D、 , , 结论:相同条件下金刚石比石墨稳定13. 根据下列实验操作和现象所得到的结论正确的是 ( )
A、a电极的电极反应式为 B、电池放电过程中,电极上的电极反应式为 C、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 D、电池从开始工作到停止放电,电解池理论上可制得12. 下列说法正确的是( )A、蛋白质溶液中加入饱和溶液可发生盐析 B、由反应可知,甲烷的燃烧热为 C、铅蓄电池放电时的正极反应式为 D、 , , 结论:相同条件下金刚石比石墨稳定13. 根据下列实验操作和现象所得到的结论正确的是 ( )选项
实验操作和现象
结论
A
向淀粉溶液中加适量溶液,加热,冷却后加溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
向苯和液溴的混合液中加入铁粉,将产生的气体通入溶液,产生淡黄色沉淀
苯与溴发生了取代反应成了
C
某卤代烃与氢氧化钠溶液混合加热,冷却后滴加溶液,未出现淡黄色沉淀
该卤代烃中不含有溴元素
D
将锌片和铁片用导线相连后放入经过酸化的溶液中(两极间保持一定距离),一段时间后往铁电极区滴入2滴(铁氰化钾,遇会生成蓝色沉淀)溶液,铁片附近溶液无蓝色沉淀生成
牺牲阳极的阴极保护法
A、A B、B C、C D、D14. 含铜催化剂催化 与
与 偶联反应机理如图所示(表示苯基)。下列说法错误的是 ( )
偶联反应机理如图所示(表示苯基)。下列说法错误的是 ( ) A、Ⅱ到Ⅲ的转化过程中有碳碳单键的断裂和形成 B、Ⅲ到Ⅳ原子利用率为100% C、Ⅴ中所有碳原子不可能共平面 D、该反应的方程式为:
A、Ⅱ到Ⅲ的转化过程中有碳碳单键的断裂和形成 B、Ⅲ到Ⅳ原子利用率为100% C、Ⅴ中所有碳原子不可能共平面 D、该反应的方程式为:
二、综合题
-
15. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
 (1)、反应Ⅰ:
(1)、反应Ⅰ:反应Ⅲ:
反应Ⅱ的化学方程式为 , 标准状况下每有的发生反应,释放的能量为。 , 则(填“>”、“<”或“=”)
(2)、利用下图所示装置可实现的吸收,同时获得了硫黄、消毒液。①甲池中碳纳米管上的电极反应式是。
②乙池中的Y极可否改为与电极相连,其理由是什么?。

三、综合题
-
16. E是合成抗炎镇痛药洛索洛芬钠的一种中间体,其合成路线如下:
 (1)、B分子中含有官能团的名称是。(2)、反应需经历的过程,中间体X的分子式为。的反应类型为。(3)、反应的条件Y是。(4)、C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、B分子中含有官能团的名称是。(2)、反应需经历的过程,中间体X的分子式为。的反应类型为。(3)、反应的条件Y是。(4)、C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中含有苯环,且有5种不同化学环境的氢原子;
②能在溶液中发生水解反应,且水解产物之一为。
(5)、写出以和为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 某兴趣小组在实验室用乙醇、浓硫酸、溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 某兴趣小组在实验室用乙醇、浓硫酸、溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:乙醇
溴乙烷
液溴
相对分子质量
46
109
160
状态
无色液体
无色液体
深红色液体
密度/(g·cm-3)
0.79
1.44
3.1
沸点/℃
78.5
38.4
59
(1)、I.溴乙烷的制备:反应原理如下:
H2SO4+NaBr NaHSO4+HBr↑
CH3CH2OH+HBr CH3CH2Br+H2O
实验装置如图(加热装置夹持装置均省略):

图甲中B仪器的名称 , 作用为。
(2)、若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了;F连接导管通入稀NaOH溶液中,其目的主要是吸收等尾气防止污染空气。(3)、II.溴乙烷性质的探究。用如图实验装置验证溴乙烷的性质:
在乙中试管内加入10 mL 6 mol·L-1 NaOH溶液和2 mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为。
(4)、若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为。18. 二氧化氯()是一种重要的氧化剂,可用于某些污染物的处理。(1)、可由图1所示装置制备(电极不反应)。
①电解时阳极附近溶液的(填“减小”“增大”或“不变”)。
②阴极上产生的机理如图2所示,则A的化学式为;该机理可描述为。
(2)、可用于水体中的去除。控制其他条件不变,在水体分别为7.1、7.6、8.3时,测得浓度随反应时间的变化如图3所示。
①时水体中转化为 , 转化为 , 该反应的离子方程式为。
②反应相同时间,水体中浓度随增大而降低的原因是。
(3)、与的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛,已吸收气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放的浓度随时间的变化如图4所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 , 原因是。
-