江苏省常州市2022年中考化学真题
试卷更新日期:2022-08-26 类型:中考真卷
一、单选题
-
1. 中华文学源远流长。下列词语蕴含化学变化的是( )A、清风徐来 B、水落石出 C、伐薪烧炭 D、愚公移山2. 诺贝尔奖获得者居呦呦研究的青蒿素属于有机物。青蒿素中一定含有的元素是( )A、C B、Ca C、Mg D、Fe3. 去年我国粮食产量创历史新高,这离不开各种化肥的合理使用。下列化肥属于复合肥的是( )A、KNO3 B、K2SO4 C、Ca3(PO4)2 D、CO(NH2)24. 5月20日是中国学生营养日,下列早餐富含蛋白质的是( )A、稀饭 B、馒头 C、牛奶 D、玉米5. 分类是学习和研究化学物质的重要方法,下列物质属于单质的是( )A、空气 B、水蒸气 C、氧气 D、天然气6. 滑雪运动可锻炼平衡力和意志力。滑雪板中的玻璃纤维增强塑料属于( )A、天然材料 B、复合材料 C、金属材料 D、非金属材料7. 景泰蓝制作工艺能将28克金拉成65公里长的金丝。该过程体现了金属的性质是( )A、导热性 B、导电性 C、延展性 D、耐酸性8. 革命先烈方志敏用米汤在白纸上写字,给党组织传递情报,下列溶液能使字迹显示的是( )A、碘酒 B、盐酸 C、盐水 D、糖水9. 干冰可用于疫苗等特殊药品的低温运输。下列说法正确的是( )A、干冰由水分子构成 B、构成干冰的微粒静止不动 C、构成干冰的微粒间无间隙 D、干冰升华吸热使环境温度降低10. 酸碱中和的实验多处用到滴管,下列有关操作正确的是( )A、滴加酚酞
 B、取用盐酸
B、取用盐酸 C、搅拌溶液
C、搅拌溶液 D、放置滴管
D、放置滴管 11. 敦煌壁画闻名世界,修复发黑的壁画时发生反应 ,则X是( )A、H2 B、H2O C、H2S D、SO212. 合金是由金属与其他物质熔合形成的“新型金属”。下列说法正确的是( )A、合金属于纯净物 B、合金中只含金属元素 C、合金的硬度比其成分金属小 D、废旧合金需回收利用13. 在催化剂作用下,N2和H2比反应生成NH3的微观过程示意如下:
11. 敦煌壁画闻名世界,修复发黑的壁画时发生反应 ,则X是( )A、H2 B、H2O C、H2S D、SO212. 合金是由金属与其他物质熔合形成的“新型金属”。下列说法正确的是( )A、合金属于纯净物 B、合金中只含金属元素 C、合金的硬度比其成分金属小 D、废旧合金需回收利用13. 在催化剂作用下,N2和H2比反应生成NH3的微观过程示意如下:
下列说法正确的是( )
A、过程中原子种类不断发生变化 B、过程中H原子数不断减少 C、反应前后分子数未改变 D、NH3不具有N2和H2的化学性质14. 在指定条件下,下列物质转化能实现的是( )A、 B、 C、 D、15. 下列实验设计能达到目的的是( )A、用湿润的pH试纸测定肥皂水的pH B、用肥皂水鉴别蒸馏水和硬水 C、用湿润的蓝色石蕊试纸检验NH3 D、用浓硫酸除去NH3中的水蒸气16. 常州的焦尾琴是四大古琴之一,面板材料取自尾部烧焦的桐木。下列说法错误的是( )A、桐木能够燃烧说明其具有可燃性 B、向灶膛扇风可加快桐木燃烧速度 C、桐木烧焦时部分桐木转化为木炭 D、浇水可降低桐木的着火点而灭火17. 下表是两种硫酸盐在不同温度时的溶解度:温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
硫酸钠
4.9
9.1
19.5
40.8
48.8
46.2
45.3
44.3
43.7
硫酸铈
24.1
20.0
17.2
14.0
10.0
8.9
8.3
7.1
6.0
下列说法正确的是( )
A、随温度升高,物质的溶解度只可能不断增大或不断减小 B、在0-80℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等 C、某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者 D、将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体18. 某阻燃剂主要成分为碱式碳酸镁【Mga(OH)2(CO3)b】,遇热分解生成三种氧化物。称取一定质量阻燃剂样品,充分灼烧(其他成分未发生反应),将产生的气体依次通过浓硫酸和过量澄清石灰水,浓硫酸增重0.18g,澄清石灰水中生成4g白色沉淀。则Mga(OH)2(CO3)b中a值为( )A、6 B、5 C、4 D、3二、选择题组
-
19. 阅读下列资料,完成下列小题:大蒜素(C6H10S2O)有较强的抗菌作用,易挥发,遇热或碱立即失去抗菌活性,但不受酸的影响。新鲜大蒜头中并没有大蒜素,只含蒜氨酸(C6H11NSO3)。蒜氨酸受撞击后,蒜氨酸酶被激活,催化蒜氨酸转化为大酸素。(1)、下列有关大蒜素和蒜氨酸的说法正确的是( )A、两者组成元素种类相同 B、两者碳元素含量不同 C、挥发性是大蒜素的化学性质 D、蒜氨酸中含SO3分子(2)、下列有关大蒜头的说法正确的是( )A、拍碎过程中仅发生物理变化 B、煮熟食用比生食抗菌效果更好 C、与醋一起食用抗菌效果变差 D、储存时不可用生石灰作干燥剂
三、填空题
-
20. “一勤天下无难事”。请为下列日常生活劳动准备合适的用品(填序号)。
①食醋 ②食盐 ③小苏打 ④活性炭
(1)、清洗水壶水垢。(2)、去除冰箱异味。(3)、烘焙面制糕点。(4)、腌制肉类食品。21. 常州人史一安发明的“史氏环氧化反应”是世界有机催化发展史上的重要里程碑。(1)、手性酮是史氏环氧化反应的催化剂。①史氏环氧化反应前后,手性酮的质量和均未改变。
②手性酮用天然糖类制备,糖类可由绿色植物通过作用合成。
(2)、KHSO5影或H2O2是进行史氏环氧化的重要反应物。①KHSO5中硫、氧原子数之比为。
②H2O2中氢元素的化合价为。
(3)、史氏环氧化反应一般在弱碱性条件下进行。下列pH范围适宜的是____。(填序号)A、1~2 B、5~6 C、7~8 D、13~1422. 明代《徐光启手迹》中记载了硝酸的制法。(1)、原料——绿矾五斤,硝五斤。绿矾(FeSO4·7H2O)和硝(KNO3)均属于____(填序号)。
A、氧化物 B、酸 C、碱 D、盐(2)、预处理——将矾炒去,约折五分之一。二味同研细,听用。①加热绿矾,质量约减小1/5。该过程中绿矾失去部分水,生成FeSO4·4H2O。写出反应的化学方程式:。
②研碎FeSO4·4H2O和KNO3 , 研碎的目的是。
(3)、制备——用铁作锅,铁锅置炭炉上,锅下起火…取起冷定,开坛则药化为强水。强水即硝酸,制备时发生如下反应:;; 。①以上三个反应中未涉及的反应类型是(填“化合”、“分解”、“置换”或“复分解”)反应。
②H2SO4和HNO3的水溶液中均含有的阳离子是(填符号)。
23. 一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下: (1)、科学利用燃烧为人类服务,有利于社会可持续发展。
(1)、科学利用燃烧为人类服务,有利于社会可持续发展。①甲烷燃烧时,(填“吸收”或“放出”)热量。
②与传统燃烧方式相比,化学链燃烧可避免燃料和空气直接接触,有利于捕集CO2 , 防止其大量排入空气,造成。
(2)、CuO进入燃料反应器与甲烷发生反应 , 生成的Cu2O再进入空气反应器,在一定温度下发生反应(填化学方程式),实现载氧体的循环再生。(3)、已知:空气中O2的体积分数约为21%。从空气反应器排出的气体中O2体积分数随反应温度变化关系如图所示。

①在800~1100℃间,升高温度,排出的气体中N2体积分数(填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是(填序号)
A.800-900℃ B.900-1000℃ C.1000-1030℃ D.1030-1100℃
四、综合题
-
24. 侯德榜发明的侯氏制碱法为中国民族化学工业赢得了声誉。(1)、侯氏制碱的主要产品是Na2CO3 , 其俗名是。(2)、实验室模拟侯氏制碱,在浓氨水中加入NaCl粉末,配成饱和氨盐水,用下列装置制备NaHCO3 , 反应为 。
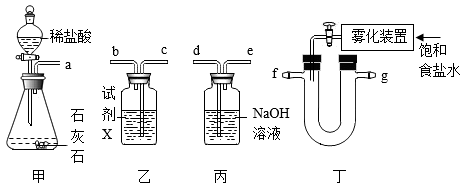
①甲装置中发生反应的化学方程式为。
②乙装置中试剂X可吸收HCl,但不与CO2反应,气流的进气接口为(填“b”或“c”)。
③上述四个装置的连接顺序为(填序号)。
A.甲乙丙丁 B.甲乙丁丙 C.甲丙丁乙 D.甲丁丙乙
(3)、分离丁装置U形管内的混合物得到NaHCO3固体和NH4Cl溶液。①灼烧NaHCO3发生反应 , 若灼烧前后固体质量减少1.24g,则产品Na2CO3的质量为g。
②已知:NH4Cl和NaCl溶解度曲线如图所示。

向NH4Cl溶液中加入NaCl粉末,可使NH4Cl结晶析出。为使剩余的NH4Cl和NaCl混合溶液中的NH4Cl充分结晶析出,应采用的结晶方式是。
25. 在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。(1)、【提出问题】Al和CuSO4溶液也能发生化学反应吗?预测Al能和CuSO4溶液反应,理由是。
(2)、【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。铝丝表面未出现红色物质,原因是。
(3)、【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。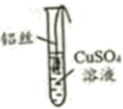
填写实验报告单:
序号
实验现象
结论与解释
①
铝丝表面有少量气泡;铝丝周围出现蓝绿色物质
CuSO4溶液呈弱酸性,与Al反应产生的气体是:蓝绿色物质成分待探究
②
24h后,铝丝仍光亮;48h后,铝丝表面出现少量红色物质
红色物质是 , 说明Al能和CuSO4溶液反应,但反应较慢
③
铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色;两层溶液界面清晰
反应生成的Al2(SO4)3为无色;Al2(SO4)3溶液的密度(填“>” 或“<”)CuSO4溶液
(4)、【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为。
(5)、欲加快Al和CuSO4溶液的反应,可加入的物质是。(填一种即可)(6)、【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。下列食品不能长时间用铝制炊具盛放的是(填序号)。A.食醋 B.食用油 C.面粉 D.咸菜
26. 化学兴趣小组设计了如图所示两个装置,以H2O2溶液为原料制备O2 , 可灵活控制气体的产生与停止。 (1)、甲装置用MnO2作催化剂,先用黏合剂将MnO2粉末制成团伏。
(1)、甲装置用MnO2作催化剂,先用黏合剂将MnO2粉末制成团伏。①仪器a的名称是。
②团状MnO2应放在(填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入H2O2溶液至浸没团状MnO2 , 立即产生O2 , 收集完后,(填操作),反应随后停止。
(2)、乙装置用铂丝(可上下抽动)作催化剂。安全管下端浸没于H2O2溶液中,将铂丝插入溶液,立即产生O2。①若烧瓶内压强过大,安全管中出现的现象是。
②当出现上述现象时,应采取的措施是。
(3)、取100gH2O2溶液加入乙装置的烧瓶中,完全反应后,测得生成2.56gO2。计算H2O2溶液的溶质质量分数(写出计算过程)。27. 钱老师设计了如图所示的数字化实验指导同学们对铜铁锈蚀进行探究。用铁粉和碳粉的均匀混合物模拟铁钉成分,用传感器测定试剂瓶内气体的相关数据。
可供选择的药品见表:
组别
药品
铁粉/g
碳粉/g
水/滴
食盐/g
其他
一
5.0
0.1
0
0
干燥剂
二
5.0
0.1
10
0
无
三
5.0
0.1
10
1.0
无
四
5.0
0.1
0
1.0
无
(1)、铁在空气中锈蚀生成铁锈。铁锈的主要成分是(填化学式)。(2)、在A、B两只试剂瓶中依次加入第一组和第二组药品进行实验。①600s内A瓶中O2含量几乎不变,B瓶中不断减少。实验表明,铁在空气中锈蚀是铁和O2、发生了化学反应。
②将第二组药品中的水改为迅速冷却的沸水,且用量增多至足以完全浸没固体混合物。600s内B瓶中O2含量也略有减少,主要原因是。
(3)、为探究食盐对钢铁锈蚀速率的影响,应选择的药品组别是(填序号)。(4)、在两只试剂瓶中均加入第二组药品,分别改用温度和湿度传感器测得结果如图所示。瓶内湿度随时间增大(即水蒸气含量增大),根本原因是。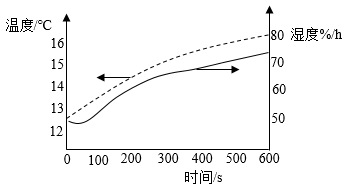 (5)、请提出一种防止钢铁生锈的方法:。28. 涂覆在铺路石表面的TiO2可净化路面空气。实验室制备TiO2的流程如下:
(5)、请提出一种防止钢铁生锈的方法:。28. 涂覆在铺路石表面的TiO2可净化路面空气。实验室制备TiO2的流程如下: (1)、焙炒时,钛铁矿的主要成分FeTiO3在蒸发皿(如图)中发生反应,。实验中用沙浴加热,图中还缺少的玻璃仪器是。
(1)、焙炒时,钛铁矿的主要成分FeTiO3在蒸发皿(如图)中发生反应,。实验中用沙浴加热,图中还缺少的玻璃仪器是。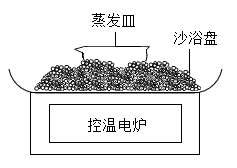 (2)、焙炒物冷却后,加水溶解浸取。
(2)、焙炒物冷却后,加水溶解浸取。①浸取时,水温易升高的原因是。
②浸取后,混合物经(填操作名称)弃去废渣,得到浸出液。
(3)、浸出液除铁后,所得滤液中含TiOSO4和H2SO4。加热煮沸滤液,TiOSO4和水反应生成H2TiO3沉淀和H2SO4 , 该反应的化学方程式为。(4)、煅烧H2TiO3沉淀得产品TiO2。整个实验流程中可循环利用的物质除水外,还有。
-