2022-2023 学年 浙教版科学九年级上册 1.1 物质的变化 同步练习
试卷更新日期:2022-08-26 类型:同步测试
一、单选题
-
1. 自然界中的物质在不断的变化,下列一定发生化学变化的是( )A、下雨 B、植物的光合作用 C、铁丝绕成各种形状 D、钢高温下成为“钢水”2. 世界充满了变化、下列过程中,发生了化学变化的是( )A、雕琢玉石
 B、丝线织锦
B、丝线织锦
 C、葡萄制酒
C、葡萄制酒
 D、瓷盘破碎
D、瓷盘破碎
 3. 下列是铁丝在氧气里燃烧的现象,其中能说明其发生化学变化的是( )A、铁丝变短 B、放出大量的热 C、火星四射 D、生成黑色固体4. 下列各说法中的“一定”,你认为正确的是( )A、需要加热才能发生的变化一定是化学变化 B、由固体变为气体的变化一定是化学变化 C、物理变化中一定不生成新物质 D、化学变化中一定有放热、发光现象5. 《中国诗词大会》是中央电视台制作的特别节目,已经举行了六季。下列古诗词只涉及物理变化的是 ( )A、只要功夫深,铁杵磨成针 B、爆竹声中一岁除,春风送暖入屠苏 C、野火烧不尽,春风吹又生 D、落红不是无情物,化作春泥更护花6. 在抗击新冠肺炎疫情的下列做法中,一定发生化学变化的是( )A、佩戴口罩 B、保持通风 C、杀菌消毒 D、勤洗手7. “某气体能使澄清石灰水变浑浊”这是该气体的( )A、物理变化 B、化学变化 C、物理性质 D、化学性质8. 下列过程中只发生物理变化的是( )A、牛奶变酸 B、葡萄酿酒 C、西瓜榨汁 D、面粉发酵9. 我们周围的物质都在不断发生变化。下列变化中,属于化学变化的是( )A、铁丝折弯
3. 下列是铁丝在氧气里燃烧的现象,其中能说明其发生化学变化的是( )A、铁丝变短 B、放出大量的热 C、火星四射 D、生成黑色固体4. 下列各说法中的“一定”,你认为正确的是( )A、需要加热才能发生的变化一定是化学变化 B、由固体变为气体的变化一定是化学变化 C、物理变化中一定不生成新物质 D、化学变化中一定有放热、发光现象5. 《中国诗词大会》是中央电视台制作的特别节目,已经举行了六季。下列古诗词只涉及物理变化的是 ( )A、只要功夫深,铁杵磨成针 B、爆竹声中一岁除,春风送暖入屠苏 C、野火烧不尽,春风吹又生 D、落红不是无情物,化作春泥更护花6. 在抗击新冠肺炎疫情的下列做法中,一定发生化学变化的是( )A、佩戴口罩 B、保持通风 C、杀菌消毒 D、勤洗手7. “某气体能使澄清石灰水变浑浊”这是该气体的( )A、物理变化 B、化学变化 C、物理性质 D、化学性质8. 下列过程中只发生物理变化的是( )A、牛奶变酸 B、葡萄酿酒 C、西瓜榨汁 D、面粉发酵9. 我们周围的物质都在不断发生变化。下列变化中,属于化学变化的是( )A、铁丝折弯 B、水挥发
B、水挥发  C、水果腐烂
C、水果腐烂  D、冰块融化
D、冰块融化  10. 下列变化不属于化学变化的是( )A、菜刀生锈 B、硫酸铜晶体受热生成白色粉末 C、浓硫酸使纸张变黑 D、氢氧化钠固体潮解
10. 下列变化不属于化学变化的是( )A、菜刀生锈 B、硫酸铜晶体受热生成白色粉末 C、浓硫酸使纸张变黑 D、氢氧化钠固体潮解二、填空题
-
11. 常温下,氯气(Cl2)是一种黄绿色有刺激性气味比空气重的有毒气体,常用于自来水消毒,原因是氯气能与水反应生成次氯酸(HClO)和氯化氢,其中次氯酸能杀菌消毒,次氯酸不稳定,见光易分解成氯化氢和一种单质气体.根据以上信息回答下列问题:(1)、氯气的物理性质是(只写 2 点) , 。(2)、写出次氯酸中氯元素的化合价。12. 红氧,非金属单质,化学式O8 , 是氧的一种单质形式,它可被认为可能会是更好的氧化剂,因为它能量密度更高。O8遭遇96GPa以上的高压就会变为金属氧,不仅会导电,在低温下表现出超导性:(1)、红氧,被认为可能会是更好的氧化剂,是利用了红氧的性质(填“物理”或“化学”,下同)。(2)、红氧遭遇96GPa以上的高压就会变为金属氧,不仅会导电,在低温下表现出超导性;金属氧不仅会导电,在低温下表现出超导性是利用了金属氧的性质。13. 以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图。如图为硫的价类图, 请分析该图后填空:
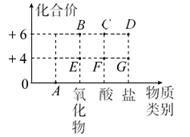 (1)、E 点表示的是二氧化硫,写出它的一条物理性质;(2)、A 点表示的物质类别是;(3)、写出由 B点表示的化合物与氢氧化钠溶液反应的化学方程式。14. 在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体。在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气体。请根据以上信息回答:(1)、二硫化碳的物理性质有;(2)、二硫化碳在空气中燃烧的化学方程式.15. 我国发射卫星的火箭常用联胺(N2H4)作为燃料,点燃时与助燃剂N2O4发生反应,生成N2和H2O。N2H4有刺鼻气味,有强烈的吸水性,易溶于水,长期暴露在空气中或短时间受热时易发生分解。(1)、联胺在物质组成上属于纯净物中的。(2)、上述联胺相关性质中属于物理性质的是。(写出一点)(3)、联胺作为火箭燃料,燃烧的化学方程式为。
(1)、E 点表示的是二氧化硫,写出它的一条物理性质;(2)、A 点表示的物质类别是;(3)、写出由 B点表示的化合物与氢氧化钠溶液反应的化学方程式。14. 在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体。在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气体。请根据以上信息回答:(1)、二硫化碳的物理性质有;(2)、二硫化碳在空气中燃烧的化学方程式.15. 我国发射卫星的火箭常用联胺(N2H4)作为燃料,点燃时与助燃剂N2O4发生反应,生成N2和H2O。N2H4有刺鼻气味,有强烈的吸水性,易溶于水,长期暴露在空气中或短时间受热时易发生分解。(1)、联胺在物质组成上属于纯净物中的。(2)、上述联胺相关性质中属于物理性质的是。(写出一点)(3)、联胺作为火箭燃料,燃烧的化学方程式为。三、实验探究题
-
16. 在实验室中,用镊子从煤油中取出一小块金属钠,用滤纸将煤油吸干,用小刀切下一小块,切口面为银白色,将切下的小块钠放入装有适量水的烧杯中,钠迅速熔成闪亮的小球在水中快速地游动,发出嘶嘶声,产生大量气泡。查阅资料得知钠与水反应会生成氢气和氢氧化钠(NaOH)。
(1)、由此推断金属钠的物理性质有:①;
②;
③。
(2)、钠的密度比水 , 比煤油。(填“大”或“小”)(3)、钠与水反应的化学方程式为。17. 某科学兴趣小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。(1)、写出铁丝在氧气中燃烧的化学方程式: 。(2)、探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸人内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由 (填“固态”或“气态”)物质燃烧形成的。
(3)、探究二:物质燃烧产生火焰的根本原因是什么?查阅资料所得信息如下表:
物质
熔点/℃
沸点/℃
燃烧时温度/℃
石蜡
50~70
300~550
约600
铁
1535
2750
约1800
钠
97.8
883
约1400
由表中数据可知:物质燃烧能否产生火焰与其 (填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时, (填“有”或“没有”)火焰产生。
(4)、木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时往往会产生火焰,其原因可能是 。四、解答题
-
18. 2018年杭州市萧山区小城镇环境综合整治行动拉开帷幕。全面推进小城镇生产方式、生活方式和社会治理方式的转型,让小城镇更加宜居、更有特色、更富活力。全面开展卫生镇创建工作,强化环境卫生长效管理机制,破解镇街环境卫生管理难题,全面提升镇街环境卫生面貌。(1)、下列做法能 “低碳、环保”理念的是 。A、用可降解“玉米塑料”代替传统塑料制作餐具 B、用回收的牛奶包装纸盒再生的材料制造休闲椅 C、多个展馆充分利用了太阳能、风能、地热能、生物能(2)、在公共场所分布着许多“直饮水”点,其“直饮水”主要生产流程为:自来水→活性炭→超滤膜分离→ 紫外线消毒→直饮水,其中活性炭起吸附作用;超滤膜可以让水分子通过,其它大分子污染物则被截留,这个分离过程属于。(填“物理变化”或“化学变化”)(3)、正常雨水显弱酸性的原因是。(4)、“节能减排”是我国的重要国策,过多的CO2排放会造成温室效应,为了减缓大气中CO2含量的增加,目前以下建议可行的是 。(填字母序号)A、开发太阳能、水能、风能、地热能等新能源 B、禁止使用煤、石油、天然气等矿物燃料 C、开发燃煤新技术使其充分燃烧 D、植树造林,保护森林19. 每年的5月15日为全国碘缺乏病防治日,以提高人们对碘缺乏病的认识。碘是人体必需的微量元素,而缺碘会引起“大脖子病”、“呆小症”等碘缺乏症,所以国家强制给食用的氯化钠食盐中加入少量的含碘化合物(如KIO3)。最新的科学研究表明碘缺乏和碘过量都会影响人体健康。(1)、甲状腺激素由甲状腺分泌,其固体为白色针状晶体,无臭、无味。它的化学式为C15H11O414N,其中C、N元素的质量比为。(2)、碘酸钾在受热时易分解,这是它的性质(选填“物理性质”或“化学性质” )。(3)、随着科学研究的深入,部分民众尤其是沿海地区的居民对是否应该全民食用加碘盐提出了质疑。下列事实中属于支持食用加碘盐的有 。(可多选)A、沿海地区的居民通过食用含碘丰富的海产品,就能从食物中获得丰富的碘。 B、我国大部分为内陆地区,远离大海,缺碘较严重。即使是沿海地区,由于饮食习惯等原因,大部分民众碘含量仍然偏低。 C、通过碘盐补充的碘虽然不会超过安全标准,但加上食物和饮水中摄入的碘,能导致碘摄入过量而影响人体健康。 D、长期摄入过量的碘可能导致甲状腺功能减退及自身免疫性甲状腺炎。 E、与碘缺乏症带来的危害相比,碘过量导致的疾病风险相对要小得多。20. 木糖醇(C5H12O5)是一种天然、健康的甜味剂,常用于口香糖、甜品等的制作。木糖醇为白色晶体或结晶性粉末,极易溶于水,微溶于乙醇与甲醇,熔点92~96℃,沸点216℃,10%水溶液pH5.0~7.0。按要求计算:(1)、木糖醇的 10%水溶液 pH5.0~7.0,这种性质属于性质。(填“物理性质”或“化学性质”)(2)、木糖醇中 C、H、O 质量比为。(3)、15.2g的木糖醇晶体中含有的C元素的质量为。21. 丁酸乙脂是无色有菠萝香味的液体,其密度为0. 87g/cm3,难溶于水,可与油类互溶。现取11.6g丁酸乙脂在氧气中完全燃烧,只产生26.4gCO2和10.8gH2O。(1)、含有丁酸乙脂的物品应远离火源。若丁酸乙脂燃烧, (填“能”或 “不能”)用水来灭火。(2)、丁酸乙脂可与油类互溶,这种性质属于性质。(3)、丁酸乙脂中碳元素和氢元素的质量比为。22. 阅读下列信息,分析回答有关问题。
1909年哈伯在实验室将氮气和氢气在600 ℃、2.02×104千帕和铁作催化剂的条件下首次合成了氨(NH3)。常温下,氨是一种无色有刺激性气味的气体,氨和氧气可以在铂催化和一定温度下反应生成一氧化氮和水。工业合成氨的原料来自空气、煤和水,这是一种经济的固氮方法。这一成果生产的化肥给农业带来了丰收,也获得了代替智利硝石生产炸药的原料。1914年第一次世界大战爆发时,由于德国垄断了合成氨技术,能快速生产氨和硝酸,使粮食和炸药的供应有了保障,这也促成了德皇威康二世开战的决心,给世界人民带来了灾难。
(1)、氨的物理性质:;
(2)、氨的化学性质:;(3)、用化学方程式写出氨的实验室制法:.(4)、氨的用途: 。