江苏省常熟市2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2022-08-23 类型:期中考试
一、单选题
-
1. 《内经》曰:“五谷为养,五果为助…”,合理膳食能提高免疫力。下列说法正确的是( )A、食用植物油的主要成分是高级脂肪酸 B、人体不能合成的八种必需氨基酸需从膳食中获取 C、糖类、油脂和蛋白质在人体内均可发生水解反应 D、食物中的膳食纤维(纤维素)与面粉中的淀粉互为同分异构体2. 分别取50 mL0.50 mol/L盐酸与50 mL0.55 mol/L氢氧化钠溶液混合进行中和热的测定,下列说法错误的是( )
 A、仪器A的名称是环形玻璃搅拌棒 B、用稍过量的氢氧化钠可确保盐酸完全反应 C、为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中 D、用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,结果也符合题意3. 如图连接下列装置,发现导线中产生电流,则有关叙述错误的是( )
A、仪器A的名称是环形玻璃搅拌棒 B、用稍过量的氢氧化钠可确保盐酸完全反应 C、为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中 D、用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,结果也符合题意3. 如图连接下列装置,发现导线中产生电流,则有关叙述错误的是( ) A、装置为原电池,电子由铁电极经导线流向石墨电极 B、若自来水中加入少量NaCl,能加快Fe的腐蚀 C、若自来水中通入HCl,石墨表面产生气体: D、若自来水中通入空气,铁电极反应为:4. 已知:一定条件下(a>0),对该反应的下列说法正确的是( )A、H2、CO、CH3OH都属于未来重点发展的新能源 B、反应为放热反应,常温下就能进行反应 C、相同条件下,和的总能量一定高于的总能量 D、一定条件下将和混合,充分反应后共放出a kJ热量5. 在Fe+催化作用下CO可将N2O转化为N2 , 反应的能量变化及反应历程如图所示:
A、装置为原电池,电子由铁电极经导线流向石墨电极 B、若自来水中加入少量NaCl,能加快Fe的腐蚀 C、若自来水中通入HCl,石墨表面产生气体: D、若自来水中通入空气,铁电极反应为:4. 已知:一定条件下(a>0),对该反应的下列说法正确的是( )A、H2、CO、CH3OH都属于未来重点发展的新能源 B、反应为放热反应,常温下就能进行反应 C、相同条件下,和的总能量一定高于的总能量 D、一定条件下将和混合,充分反应后共放出a kJ热量5. 在Fe+催化作用下CO可将N2O转化为N2 , 反应的能量变化及反应历程如图所示:①(慢)
②(快)

下列叙述错误的是( )
A、反应①为吸热反应,所以速率相对较慢 B、FeO+为反应①的氧化产物,也是总反应的中间产物 C、反应②的活化能Ea2比反应①的活化能Ea1要小 D、每生成1 mol N2 , 转移电子数目为6. 将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+aQ(g),2 min后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1 , 下列叙述错误的是( )A、a的值为2 B、平衡时X的浓度为0.2 mol·L-1 C、Y的转化率为60% D、反应速率v(Y)=0.3 mol·(L·min)-17. 一定条件下,在体积固定的密闭容器中通入SO3 , 发生反应 , 一段时间后,下列情况无法确定反应已达到平衡状态的是( )A、浓度: B、速率:v正(SO2)=2v逆(O2) C、压强:恒温条件下,压强不再发生变化 D、温度:绝热条件下,温度不再发生变化8. 下列图示的相关论述及得出的结论均合理的是( )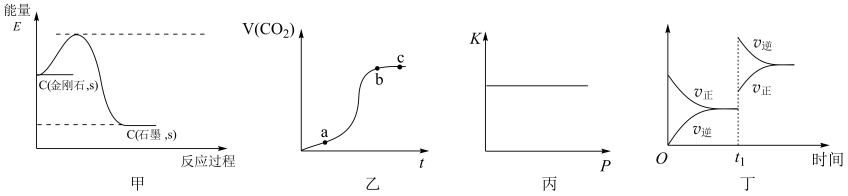 A、图甲为C(金刚石,s)=C(石墨,s) 反应过程的能量变化曲线,说明金刚石比石墨稳定 B、图乙为碳酸钙与盐酸反应生成CO2气体体积随时间的变化曲线,说明b→c时间段内反应速率最快 C、图丙为一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变 D、图丁为反应的反应速率随时间变化的曲线,说明t1时刻改变的条件可能是升高温度9. 废水中通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。则下列叙述错误的是( )
A、图甲为C(金刚石,s)=C(石墨,s) 反应过程的能量变化曲线,说明金刚石比石墨稳定 B、图乙为碳酸钙与盐酸反应生成CO2气体体积随时间的变化曲线,说明b→c时间段内反应速率最快 C、图丙为一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变 D、图丁为反应的反应速率随时间变化的曲线,说明t1时刻改变的条件可能是升高温度9. 废水中通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。则下列叙述错误的是( ) A、电池工作时需控制温度不宜过高 B、a极电极反应式为:
A、电池工作时需控制温度不宜过高 B、a极电极反应式为: +e-=
+e-= +Cl-
C、b极为负极,发生氧化反应
D、H+由b极穿过质子交换膜到达a极
10. 某同学检验淀粉水解程度的实验如下:
+Cl-
C、b极为负极,发生氧化反应
D、H+由b极穿过质子交换膜到达a极
10. 某同学检验淀粉水解程度的实验如下:步骤1:向淀粉溶液中加入一定量稀H2SO4 , 加热反应几分钟;冷却后取少量水解液,加入碘水,溶液显蓝色。
步骤2:另取少量水解液加入足量NaOH溶液,再加入新制Cu(OH)2悬浊液并加热至沸腾,有砖红色沉淀生成。
该同学结合实验情况做出了以下判断,你认为其中说法错误的是( )
A、步骤1加入稀H2SO4 , 目的是为了加快淀粉的水解速率 B、步骤2产生沉淀的方程式为: C、步骤1、2的现象说明淀粉发生了部分水解 D、实验结果并不能得出淀粉的水解反应是可逆过程的结论11. 化合物c的制备原理如下:
下列说法正确的是( )
A、该反应还有生成 B、化合物a分子中所有原子一定共平面 C、化合物b分子中含有手性碳原子 D、化合物c在酸性条件下发生水解,有一种产物能与乙二醇发生缩聚反应12. 下列实验的操作、现象和结论均合理的是( )选项
实验操作
现象
结论
A
碘酒滴到土豆片上
土豆片变蓝
淀粉遇碘元素变蓝
B
蛋白质溶液中加入浓溶液
产生沉淀
蛋白质发生了盐析
C
向溶液中加入少量KI溶液,充分反应后再滴加KSCN溶液
溶液变血红色
与的反应具有可逆性
D
溶液中加入少量
立即产生大量气泡
促使分解反应的平衡正移
A、A B、B C、C D、D13. 已知高能锂离子电池的总反应为 , 以为电解质,用该电池为电源电解处理含镍废水并回收单质Ni的实验装置如图所示(实验结束后,b室中NaCl溶液浓度变大)。下列说法错误的是( ) A、碳棒为阳极,有电子从碳棒经导线流向FeS B、离子交换膜m为阳离子交换膜 C、当Li电极质量减轻7g时,b室离子数将增加1mol D、若与电源连接时将电极接反,某一电极易发生腐蚀14. 在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g) 2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:
A、碳棒为阳极,有电子从碳棒经导线流向FeS B、离子交换膜m为阳离子交换膜 C、当Li电极质量减轻7g时,b室离子数将增加1mol D、若与电源连接时将电极接反,某一电极易发生腐蚀14. 在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g) 2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:实验编号
实验Ⅰ
实验Ⅱ
实验Ⅲ
反应温度/℃
700
700
750
达平衡时间/min
40
5
30
n(D)平衡/ mol
1.5
1.5
1
化学平衡常数
K1
K 2
K 3
下列说法正确的是( )
A、K 3>K 2=K 1 B、实验Ⅱ可能是增大了压强 C、实验Ⅲ达平衡后容器内的压强是实验Ⅰ的9/10倍 D、实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动二、填空题
-
15. 氢气是一种理想的绿色能源,有科学家预言,氢能将成为人类的主要能源。已知以水为原料通过下列途径均可制得氢气。
ⅰ)太阳光催化分解水:
ⅱ)焦炭与水反应:
ⅲ)甲烷与水反应:
(1)、反应ⅰ中主要的能量转化为;你认为通过此途径进行H2工业化生产的最突出优点是。(2)、相同温度压强下,若分别以ⅰ、ⅱ反应生成1mol H2 , 反应ⅱ比ⅰ要少吸收热量;你认为ⅱ反应需要吸热较小的原因可能是。(3)、①写出反应ⅲ的化学平衡常数的表达式:;②一定温度下,ⅲ反应中使用催化剂后,下列物理量能保持不变的有。
a.焓变 b.反应活化能Ea c.活化分子百分比 d.平衡常数K3
(4)、①利用上述热化学方程式,推测反应;②以为燃料、KOH溶液为电解液的燃料电池,负极的电极反应式为。
16. 为了工农业生产,氮的固定研究一直在不断进行。下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。反应
大气固氮
工业固氮
温度/℃
27
2000
25
400
450
平衡常数/K
0.1
0.507
0.152
(1)、分析上表数据,回答下列问题。①大气固氮反应不适合大规模工业生产,可能原因是;
②工业固氮需在高温、有催化剂的条件下进行,主要目的是。
(2)、工业固氮反应中,其他条件相同时,分别测定的平衡转化率在不同压强下随温度变化的曲线,则下图中正确的是图(填“甲”或“乙”),p1、p2的大小关系为。 (3)、在一定温度下,将和混合置于一体积不变的密闭容器中发生反应 , 达到平衡后,测得气体总物质的量为4amol。计算:
(3)、在一定温度下,将和混合置于一体积不变的密闭容器中发生反应 , 达到平衡后,测得气体总物质的量为4amol。计算:①平衡时,的转化率为;
②平衡时,若容器中气体总压强为P,则压强平衡常数Kp=(用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数。
三、综合题
-
17. 化合物M是一种新型有机酰胺,在工业生产中有重要作用,以有机物A、乙烯和苯为原料合成M的路线如下:

已知:i)RCHO+R'CH2CHO

ⅱ)
回答下列问题:
(1)、已知A是一种烃的含氧衍生物,相对分子质量为58,氧的质量分数为55.2%,核磁共振氢谱显示只有一组峰,可发生银镜反应,试写出A的结构简式:。(2)、B→C的反应类型为反应;D中含氧官能团为(填写名称)。(3)、F+H→M的化学反应方程式为:。(4)、X是G的一种同系物,分子式为 , 写出一种同时满足下列条件的X的同分异构体的结构简式:。①属于氨基酸
②含有苯环,且苯环上只有一个取代基
③分子中有7种不同化学环境的氢
(5)、参照上述合成路线,以乙烯、乙醇为原料,设计制备 的合成路线:。 18. 为实现生产生活的“碳减”和经济的可持续发展,科学工作者开展的价值型转化的相关研究。请回答以下有关问题:(1)、和在催化下,转化为甲烷和氧气。已知有关化学反应的能量变化如图1所示。
的合成路线:。 18. 为实现生产生活的“碳减”和经济的可持续发展,科学工作者开展的价值型转化的相关研究。请回答以下有关问题:(1)、和在催化下,转化为甲烷和氧气。已知有关化学反应的能量变化如图1所示。
①则甲反应(填写“一定非自发”、“低温自发”或“高温自发”)。
②转化总反应的热化学方程式为。
(2)、和在催化下,转化为甲烷和水。常压催化下,将和按体积比1∶4混合,发生反应:ⅰ)、
ii)。
测得转化率、和CO的选择性(即转化生成或CO的百分比)随温度变化如下图所示。

①0、0;(填写“>”或“<”)
②为提高的选择性 , 除控制合适的温度外,还可采取的措施有;
③图中350~550℃温度范围,的转化率先明显下降后又减缓直至基本不变。试解释其原因:。
(3)、一种聚合物锂电池通过充、放电可实现“大气固碳”(工作原理如图所示)。该电池在充电时,通过催化剂的选择性控制,只有发生氧化释放出和。
①充电时,电极B电极反应式为;
②该电池每循环充、放电子各4mol,理论上可固定标准状况下L。