山东省东营市东营区中考2022年三模化学试题
试卷更新日期:2022-08-12 类型:中考模拟
一、单选题
-
1. 下列描述有一项与其它不同的是( )A、新冠疫情期间用医用酒精消毒 B、“侯氏制碱法”用空气、水、食盐生产纯碱和化肥 C、古建筑房檐下的青石被雨水滴成很多小坑 D、夜幕降临,清风湖两岸霓虹灯通电后发出美丽的光芒2. 下列关于化学与日常生活关系的归纳中,存在错误的是( )A、化学与环境:①使用天然气代替煤——减少空气污染;②合理使用农药、化肥——减少水污染 B、化学与生活:①使用含氟牙膏可预防龋齿;②防止食品受潮——用氧化钙做干燥剂 C、化学与安全:①重金属盐中毒——喝鲜牛奶解毒;②山洞探险——灯火实验 D、化学与健康:①人体缺铁——易患贫血病;②食用鲜黄瓜——可大量补钙3. 今年开始,我省17地市将开展城市生活垃圾分类减量试点。废弃塑料购物袋属于( )A、
 B、
B、 C、
C、 D、
D、 4. 下列知识整理的内容均正确的一组是( )
4. 下列知识整理的内容均正确的一组是( )A.物质的分类
B.物质的检验
合成橡胶、合金和合成纤维都是合成材料
冰水、雨水和矿泉水都是混合物
消石灰、纯碱和烧碱都是碱
用湿润的蓝色石蕊试纸能检验氨气
用灼烧的方法能区别棉花和羊毛
用适量的水能区分NH4NO3固体和NaCl固体
C.化学生产
D.化学历史
工业上可以用煤经过干馏制得煤焦油
使用热固性塑料制电器插座
用聚氯乙烯塑料袋制食品包装袋
拉瓦锡通过定量实验证明了化学反应遵循质量守恒的结论
汤姆森首先发现了电子,证实原子是可分的
俄国化学家门捷列夫将当时已发现的63种元素推序,制得了第一张元素周期表
A、A B、B C、C D、D5. 下列叙述正确的是( )A、自然界中的碳循环中的“碳”是指二氧化碳,氧循环中的“氧”是指氧气 B、活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属 C、水的三态变化,能实现水的自身净化和水资源的重新分配 D、铵态氮肥遇到可溶性碱能释放出氨气,则所有的氮肥遇到可溶性碱都能释放出氨气6. 体育运动在一定程度上可以增强民族的凝聚力,但兴奋剂是体育界的一个黑点,在奥运会比赛中对运动员进行兴奋剂检查的开销相当惊人。诺龙是兴奋剂中的一种,其化学式是C18H26O2。下列关于诺龙的说法正确的是( )A、诺龙分子是由C、H、O元素组成的 B、诺龙中碳、氢、氧元素质量比为108:13:16 C、诺龙中含有氧分子 D、诺龙由18个碳原子、26个氢原子、2个氧原子构成7. 东营是一座美丽的沿海城市,海洋资源丰富。下列对海洋化学资源利用的叙述错误的是( )A、利用多级闪急蒸馏法淡化海水 B、利用蒸发结晶的方法从海水中提取食盐 C、利用海底蕴藏的大量“可燃冰”作燃料不会加剧温室效应 D、利用向海水或卤水中加入石灰乳的方法将海水中的Mg2+富集沉淀出来8. 通过下列图示实验得出的结论中正确的是( ) A、图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素 B、图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧 C、图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的 D、图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物9. 除去下列物质中的少量杂质,所选试剂及操作都正确( )
A、图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素 B、图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧 C、图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的 D、图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物9. 除去下列物质中的少量杂质,所选试剂及操作都正确( )序号
物质
杂质
试剂
操作
A
Fe
Fe2O3
盐酸
结晶
B
NaCl
NH4HCO3
—
加热
C
Cu(NO3)2溶液
BaCl2
AgNO3溶液
过滤
D
CO2
水蒸气
生石灰
洗气
A、A B、B C、C D、D10. 菠菜中含有一种有机物——草酸。将草酸隔绝空气加热,使其完全分解,生成水和碳的氧化物。为了探究上述反应生成的碳的氧化物成分,某同学设计了如下图所示实验。下列说法正确的是( ) A、乙装置对实验结果不产生影响,因此可以去掉乙装置以简化实验方案 B、丙装置玻璃管中若发生化学反应,则一定为置换反应 C、若甲试管内溶液变浑浊,丁试管内无明显现象,则该碳的氧化物成分为二氧化碳和一氧化碳的混合物 D、若甲试管和丁试管内溶液都变浑浊,丙处玻璃管内的红色固体变成黑色,则该碳的氧化物成分为一氧化碳和二氧化碳11. 下列图像能正确反映其对应的实验操作的是( )A、将锌片插入盛有一定量稀硫酸的烧杯中
A、乙装置对实验结果不产生影响,因此可以去掉乙装置以简化实验方案 B、丙装置玻璃管中若发生化学反应,则一定为置换反应 C、若甲试管内溶液变浑浊,丁试管内无明显现象,则该碳的氧化物成分为二氧化碳和一氧化碳的混合物 D、若甲试管和丁试管内溶液都变浑浊,丙处玻璃管内的红色固体变成黑色,则该碳的氧化物成分为一氧化碳和二氧化碳11. 下列图像能正确反映其对应的实验操作的是( )A、将锌片插入盛有一定量稀硫酸的烧杯中 B、向一定量的氯化钡和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量
B、向一定量的氯化钡和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量  C、电解水
C、电解水  D、向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量
D、向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量  12. 某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法正确的是( )A、滤出的固体中一定含有银,可能含有铜,一定不含铁 B、滤出的固体中一定含有银,可能含有铜和铁 C、滤液中一定含有硝酸亚铁,可能含有硝酸银 D、滤液中一定含有硝酸亚铁,可能含有硝酸银和硝酸铜
12. 某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法正确的是( )A、滤出的固体中一定含有银,可能含有铜,一定不含铁 B、滤出的固体中一定含有银,可能含有铜和铁 C、滤液中一定含有硝酸亚铁,可能含有硝酸银 D、滤液中一定含有硝酸亚铁,可能含有硝酸银和硝酸铜二、填空题
-
13. 元素周期表是学习和研究化学的重要丁具,如表是元素周期表的一部分。
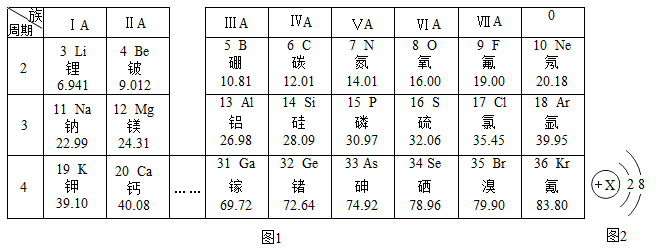
回答下列问题:
(1)、若锂元素在周期表中的位置可表示为“第2周期IA族”,则地壳中含量最高的金属元素在周期表中的位置可表示为。(2)、某粒子的结构示意图如图2所示,若该粒子为某稀有气体元素的原子,则该元素单质的化学式量为(取整数值):若该粒子为+2价阳离子,则该阳离子的符号为。(3)、①镓元素(Ga)的原子结构示意图为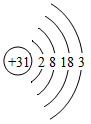 ,形成的氧化物化学式表示为。
,形成的氧化物化学式表示为。 ②下列原子结构示意图所对应的元素与镓元素的化学性质相似的是(填字母序号)。

金属镓能与稀盐酸反应。写出反应的化学方程式。
(4)、化学与生活:近几年,“镉大米“再次引发了人们对食品安全,环境污染问题的思考。小明同学查阅了镉的相关信息:①镉单质是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3 , 有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱。②镉元素对人体十分有害。提入过量镉污染的食品和水,会引起肺和肾脏疾病。回答下列问题:①根据图中的相关信息,下列对镉元素的判断错误的是。
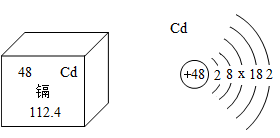
A.镉属于金属元素 B.一个镉原子中有48个质子
C.镉原子示意图中X=8 D.镉的相对原子质量为112.4g
②“镉大米”主要出现在河水、土壤遭到镉污染的地区,消除“镉大米”需要从源头治理。目前河水治理的方法是:把适量Na2CO3投入被Cd2+”污染的河水中,形成沉淀,以降低河水中Cd2+”的浓度。若某河段主要含有氯化镉,写出与碳酸钠反应的化学方程式为。
14. 甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:物质
甲
乙
丙
丁

化学式
H2O
C
?
H2
微观
示意图



?
(1)、请画出丁物质的微观示意图。(2)、四种物质中属于原子构成的是。(填化学式)(3)、甲和乙在一定条件下反应生成丙和丁,若20g甲与12g乙充分反应。可生成丙物质的质量为。15. 溶液在生产生活中有着广泛的应用。(1)、甲、乙两种固体物质的溶解度曲线如图1所示,析出的晶体均不含结晶水,回答下列问题:
A是40℃含有120g水的甲溶液,经过如图2操作,得到50g甲固体。对以上过程的分析,错误的是______(选填编号)
A、A到B的过程中,溶质质量没有改变 B、B中溶质与溶剂的质量比为138:100 C、B到C的过程中,溶质甲已全部析出 D、A溶液的质量等于255g(2)、40℃,将甲、乙物质饱和溶液各200g降温至20℃。对此过程判断一定正确的是______。A、现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量 B、溶解度:溶解度都变小;20℃时:S甲<S乙 C、溶液状态:都为饱和溶液;40℃:甲溶质的质量<乙溶质的质量 D、溶剂变化:溶剂质量不变;20℃时:甲溶液中溶剂质量>乙溶液中溶剂质量(3)、氧气是一种与我们密不可分的气体,不同温度下,氧气的溶解疫随压强的变化如下图所示,图中t1对应的温度为40℃,则t2对应的温度______(填编号)。 A、大于40℃ B、小于40℃ C、等于40℃ D、无法确定(4)、将40℃等质量的两种物质的饱和溶液恒温蒸发10g水后,所得甲、乙溶液质量大小关系为甲乙(选填“<”、“>”或“=”)。
A、大于40℃ B、小于40℃ C、等于40℃ D、无法确定(4)、将40℃等质量的两种物质的饱和溶液恒温蒸发10g水后,所得甲、乙溶液质量大小关系为甲乙(选填“<”、“>”或“=”)。三、科普阅读题
-
16. 2015年中国科学家屠呦呦凭借从植物青蒿中提取青蒿素的实验研究获得了诺贝尔奖,也为世界的每一位疟疾患者送去了福音。基本工艺为:把青蒿干燥—破碎—用乙醚浸泡、萃取(反复进行)—浓缩提取液—粗品—精制。
阅读资料:a.青蒿素 无色针状晶体,味苦。在丙酮、醋酸乙酯、氯仿、苯及冰醋酸中易溶,在乙醇和甲醇、乙醚及石油醚中可溶解,在水中几乎不溶。熔点:156-157℃,而青蒿素在温度超过60℃以后则过氧桥结构被很快破坏,完全失去药效;
b.乙醚 化学式为C4H10O,无色透明液体。有特殊刺激气味。带甜味,极易挥发,其蒸汽重于空气。易燃、低毒,与无水硝酸、浓硫酸和浓硝酸的混合物反应也会发生猛烈爆炸,熔点 -116.3℃。沸点 34.6℃;
c.乙醇 是一种有机物。俗称酒精。在常温、常压下是一种易燃、易挥发的无色透明液体,沸点是78.3℃,熔点是-114.1℃,易燃,其蒸气能与空气形成爆炸性混合物,能与水以任意比互溶。
请回答:
(1)、乙醚的化学性质是。(2)、写出乙醚燃烧的化学方程式。(3)、由浓缩提取液得到粗品利用的原理(4)、根据资料分析不能用乙醇来代替乙醚从青蒿中来萃取青蒿素的原因。四、综合题
-
17. 冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。请回答:(1)、除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于______(填写序号字母)。A、合成材料 B、合金 C、金属材料 D、化合物(2)、氯化钙是常用的融雪剂。工业上以碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产氯化钙的主要流程如下:

①滤渣的主要成分是(填化学式);
②盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式。
(3)、2019年“全国生态文化村”遴选工作已开启。为了保护环境,我市某村办企业需对含硫酸的废水处理呈中性后排放。①若要达到排放标准,可以向废水里加入(填序号)。
A.氯化钠 B.氯化钡 C.生石灰
②某同学欲利用该村的赤铁矿(杂质不溶于水,也不与酸反应)来处理废水,并制取红色颜料(Fe2O3)从而变废为宝。他设计了如下方案,试回答相关问题。

写出反应③的化学方程式。
18. 乙烯(C2H4)是一种可燃性气体。某同学用40%的乙烯利和氢氧化钠固体,在常温下反应制取乙烯并探究其爆炸极限(遇到火源就会发生爆炸的乙烯与空气的混合气体,其中乙烯的体积分数范围,用a%-b%表示)。回答下列问题:(1)、现学校实验室现需要6000克溶质质量分数为40%的乙烯利用于学生实验,而实验室只有溶质质量分数60%的乙烯利溶液,如果你是实验老师,需要克浓乙烯利和毫升水来配制,需要的玻璃仪器是。(2)、下列仪器中,仪器B的名称是。为了得到平稳的乙烯气流,连接乙烯的发生装置,除了橡胶塞、导管外,还需要的仪器是(填字母)。
不能用排空气法收集乙烯的原因是。
(3)、用溶剂均为VmL的集气瓶收集乙烯与空气的混合气体进行实验。步骤如下:
①先如图A表示,收集一瓶乙烯体积分数为50%的混合气体,点火不发生爆炸,
②再如图B、C所示,分别收集气体并点火,前者发生爆炸,后者不爆炸,结合步骤①,得出a%、b%的范围,其中b%的范围是:%—%。
③按照中值法继续探究,可得到更准确的爆炸极限数据。
④启示与感悟:小明同学在完成“氧气的制取与性质”的基础实验后,他还想进行蜡烛在不同浓度的氧气中燃烧情况的探究,现要较简便地获得两瓶不同浓度的氧气,应选择收集氧气的方法是。实验室制取氧气方法较多,写出比较环保、安全的反应化学方程式。
(4)、乙烯利溶液酸性较强,如果皮肤上不小心沾上它,应立即用大量的水冲洗。再涂上3%—5%的______。(填字母)A、氢氧化钠溶液 B、硼酸溶液 C、碳酸氢钠溶液 D、醋酸溶液五、计算题
-
19. 某课外兴趣小组在实验室发现了一瓶含杂质的熟石灰粉末(杂质不溶于水也不与稀盐酸反应),为探究熟石灰的变质程度他们取六份样品,分别加稀盐酸反应测得部分数据如下,请根据有关信息回答问题。
实验次数
1
3
4
5
6
取样品质量(g)
25.0
25.0
25.0
25.0
25.0
取稀盐酸质量(g)
50.0
120.0
140.0
160.0
205.0
产生气体质量(g)
0
a
2.2
3.3
4.4
(1)、a的数值为。(2)、第6次实验,所得溶液中溶质的化学式为。(3)、计算25克样品中碳酸钙的质量分数。(4)、列式计算所用盐酸的溶质质量分数(保留到0.1%)(写出解题过程)
-