福建省厦门市思明区2022年6月中考适应性练习化学试题
试卷更新日期:2022-08-12 类型:月考试卷
一、单选题
-
1. 劳动赋能,助力背少年成长。下列劳动项目所涉及的化学知识错误的是( )
选项
劳动项目
化学知识
A
学农活动:在田地里施洒KNO3
KNO3属于复合肥
B
学校清洁:用酒精对课桌椅进行消毒
酒精可燃烧
C
社区服务:垃圾分类,植树造林
节约资源,低碳环保
D
家务劳动:用洗洁精洗碗碟
洗洁精有乳化作用
A、A B、B C、C D、D2. 下列实验操作正确的是( )A、混合固体 B、处理废弃药品
B、处理废弃药品 C、滴加液体
C、滴加液体 D、倾倒液体
D、倾倒液体 3. 《本草纲目•苍术》中记载“两目昏涩。用苍术半斤,淘米水浸七天,去皮切片,焙干,加木贼二两,共研为末。每服一钱,茶或酒送下。”上述过程中,没有涉及的操作是( )A、研磨 B、干燥 C、称量 D、蒸馏4. 某种胰蛋白酶(C6H15O12P3)是新冠疫苗的原料,关于该胰蛋白酶说法正确的是( )A、属于无机物 B、氢元素质量分数最小 C、由36个原子构成 D、碳、氧元素质量比为1:25. 某口罩中使用了MOF催化过滤材料,在潮湿空气中臭氧去除率可达100%,反应的微观过程如图所示。下列说法中正确的是( )
3. 《本草纲目•苍术》中记载“两目昏涩。用苍术半斤,淘米水浸七天,去皮切片,焙干,加木贼二两,共研为末。每服一钱,茶或酒送下。”上述过程中,没有涉及的操作是( )A、研磨 B、干燥 C、称量 D、蒸馏4. 某种胰蛋白酶(C6H15O12P3)是新冠疫苗的原料,关于该胰蛋白酶说法正确的是( )A、属于无机物 B、氢元素质量分数最小 C、由36个原子构成 D、碳、氧元素质量比为1:25. 某口罩中使用了MOF催化过滤材料,在潮湿空气中臭氧去除率可达100%,反应的微观过程如图所示。下列说法中正确的是( )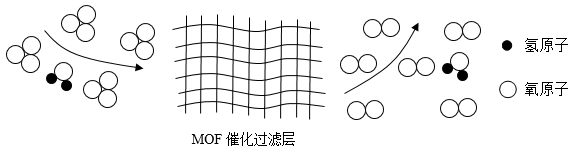 A、该反应属于化合反应 B、臭氧全部转化生成了氧气 C、氧元素化合价发生改变 D、经上述过滤后的气体属于纯净物6. 宇航员太空授课时,利用酸碱指示剂甲基橙(变色范围:
A、该反应属于化合反应 B、臭氧全部转化生成了氧气 C、氧元素化合价发生改变 D、经上述过滤后的气体属于纯净物6. 宇航员太空授课时,利用酸碱指示剂甲基橙(变色范围: )画出奥运五环,把甲基橙滴入乙酸溶液变出红色环,滴入碳酸钠溶液变出黄色环。下列说法正确的是( ) A、使甲基橙变黄的溶液一定呈碱性 B、甲基橙能指示HCl与NaOH恰好完全反应 C、碳酸钠溶液与乙酸混合产生气泡 D、把甲基橙滴入肥皂水显红色7. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述错误的是( )
)画出奥运五环,把甲基橙滴入乙酸溶液变出红色环,滴入碳酸钠溶液变出黄色环。下列说法正确的是( ) A、使甲基橙变黄的溶液一定呈碱性 B、甲基橙能指示HCl与NaOH恰好完全反应 C、碳酸钠溶液与乙酸混合产生气泡 D、把甲基橙滴入肥皂水显红色7. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述错误的是( ) A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用8. 下列操作能达到实验目的的是( )
A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用8. 下列操作能达到实验目的的是( )选项
实验目的
实验操作
A
鉴别NH4Cl和(NH4)2SO4固体
分别加入熟石灰研磨,闻气味
B
检验固体中是否含有
取样,加入稀盐酸观察是否有气泡产生
C
鉴别氢气和甲烷
分别点燃,在火焰上方罩干冷烧杯
D
检验集气瓶中氧气是否集满
将带火星的木条放在瓶口,观察是否复燃
A、A B、B C、C D、D9. 利用铁粉,炭粉、氯化钠进行铁的锈蚀实验(装置如下图所示,装置气密性良好)。实验1min后温度计读数上升,8min后打开止水夹,水倒吸入锥形瓶,实验数据如下表:
实验前的体积
实验后的体积
锥形瓶内空气(含导管内空气)
烧杯内水
烧杯内剩余水
246.0mL
100.0mL
51.5mL
下列说法不合理的是( )
A、铁的锈蚀是放热反应 B、使用氯化钠溶液的目的是加快铁的锈蚀 C、此实验能推断出铁的锈蚀需要水的参与 D、计算得出空气中氧气的含量约为19.7%10. 自热米饭发热包的主要成分:氧化钙、碳酸钠、铝粉,加水后反应产生的温度和pH变化如图所示(已知 放热)。下列说法错误的是( )
 A、在t=2000s时反应结束 B、在880s~1856s内随着温度的持续下降,氢氧化钙溶解度变大,pH上升 C、由曲线得出反应后溶液碱性较强,有腐蚀性,且放出大量热,所以禁止食用 D、发热包需远离明火是因为加水过程中有氢气产生
A、在t=2000s时反应结束 B、在880s~1856s内随着温度的持续下降,氢氧化钙溶解度变大,pH上升 C、由曲线得出反应后溶液碱性较强,有腐蚀性,且放出大量热,所以禁止食用 D、发热包需远离明火是因为加水过程中有氢气产生二、填空题
-
11. 神舟十三号载人飞船发射成功。(1)、为防止骨质疏松,宇航员应吃富含(填名称)元素的食物。(2)、太阳能板给飞船供电时能量的转化过程是。(3)、制作航天通风服的聚氯乙烯管属于(填“合成材料”或“天然材料”)。(4)、飞船使用钛合金作为材料。

①如图为钛原子结构示意图,则x=。
②用过量的镁在加热条件下与TiCl4发生置换反应制得金属钛,其化学方程式为。
③钛合金可能具有的性质是(填标号)。
A.密度大,强度高 B.熔点高,密度小 C.耐腐蚀,硬度小
12. “南风之时兮,可以阜吾民之财兮”这首上古歌谣说的是夏季南风一吹,盐池隔宿成盐,带来巨大财富。(1)、食盐是由(填“分子”、“原子”或“离子”)构成。(2)、从盐水中得到食盐,需进行的操作是。能反映水在该操作中发生变化的微观示意图是(填标号,“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子)
”表示氢原子) (3)、劳动致富过程中,用溶质质量分数为16%的NaCl溶液来选种。若配制5kg这种溶液,需要NaCl的质量是根据NaCl溶解度曲线判断,此溶液(填“是”或“不是”)20℃时NaCl的饱和溶液。
(3)、劳动致富过程中,用溶质质量分数为16%的NaCl溶液来选种。若配制5kg这种溶液,需要NaCl的质量是根据NaCl溶解度曲线判断,此溶液(填“是”或“不是”)20℃时NaCl的饱和溶液。 (4)、写出氯化钠在生理健康上的一种用途。13. “黑科技”亮相北京冬奥会。
(4)、写出氯化钠在生理健康上的一种用途。13. “黑科技”亮相北京冬奥会。
 (1)、图1的反渗透系统是净水系统的核心部外,主要采用膜过滤工艺。水分子通过反渗透膜,其他一些如钙、镁离子等随废水一起排掉。
(1)、图1的反渗透系统是净水系统的核心部外,主要采用膜过滤工艺。水分子通过反渗透膜,其他一些如钙、镁离子等随废水一起排掉。①反渗透过程属于(填“物理变化”或“化学变化”)。
②检验所得纯净水含较少钙、镁离子的操作和现象:。
(2)、科学家正致力于用图2所示方法制氢,写出该反应的化学方程式。(3)、水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图3所示。
①当温度低于2000℃时,体系内微粒含量没有改变的原因是。
②已知图中曲线A、B对应的微粒是原子,写出微粒A的化学符号。
三、综合题
-
14. 甲、乙、丙三种物质有如图所示的转化关系。
 (1)、若甲、乙、丙依次是氢气、水、硫酸。乙→丙时所需另一种反应物中,一定含有氧元素和元素。(2)、若甲是紫红色金属,丙的溶液呈蓝色。
(1)、若甲、乙、丙依次是氢气、水、硫酸。乙→丙时所需另一种反应物中,一定含有氧元素和元素。(2)、若甲是紫红色金属,丙的溶液呈蓝色。①乙的化学式是。
②写出乙→丙的化学方程式:。
(3)、若甲、乙是两种常见的碱。①丙的化学式是。
②写出乙→丙的化学方程式:。
15. 高铁酸钾是一种净水剂,下图是赤铁矿(主要含Fe2O3)制备高铁酸钾的技术路线。
已知高铁酸钾部分性质如下:
ȋ.热稳定性差,在低温、碱性环境中稳定;
ⅱ.在水中溶解度大,难溶于无水乙醇等有机溶剂。
(1)、“还原”中,化合价降低的元素是(填名称)。(2)、“酸溶”中,加快反应速率可采取的一条措施是;溶液A中含有的金属阳离子是(填符号)。(3)、“转化”是在无水乙醇中进行的复分解反应,该反应的化学方程式是;该反应要在较低温度下进行的原因是。(4)、该技术路线可以循环利用的物质是。16. 下列装置和仪器常用于实验室制取气体。 (1)、仪器①的名称是。(2)、装置B气密性的检查方法:。(3)、结合上图,写出实验室制取氧气的一种方法的化学方程式:。所选择的气体发生装置是(填标号)。(4)、在加热条件下,用熟石灰与氯化铵反应制氨气,同时生成氯化钙和水,反应的化学方程式为。若用E装置收集氨气,应从(填“a”或“b”)端通入。17. 某学习小组探究干冰与NaOH的反应。
(1)、仪器①的名称是。(2)、装置B气密性的检查方法:。(3)、结合上图,写出实验室制取氧气的一种方法的化学方程式:。所选择的气体发生装置是(填标号)。(4)、在加热条件下,用熟石灰与氯化铵反应制氨气,同时生成氯化钙和水,反应的化学方程式为。若用E装置收集氨气,应从(填“a”或“b”)端通入。17. 某学习小组探究干冰与NaOH的反应。实验1探究干冰与NaOH溶液是否反应
如图1,在试管中放入几小块干冰,将产生的气体通入NaOH溶液中。
 (1)、干冰易升华利用了干冰的性质(填“物理”或“化学”)。(2)、将上述反应后的溶液分成2份,一份滴加足量Ca(OH)2溶液,如果观察到 , 另一份滴入足量盐酸,如果观察到 , 说明CO2与NaOH发生反应,反应的化学方程式为。(3)、 实验2探究干冰与不同浓度NaOH溶液反应过程中的pH变化情况
(1)、干冰易升华利用了干冰的性质(填“物理”或“化学”)。(2)、将上述反应后的溶液分成2份,一份滴加足量Ca(OH)2溶液,如果观察到 , 另一份滴入足量盐酸,如果观察到 , 说明CO2与NaOH发生反应,反应的化学方程式为。(3)、 实验2探究干冰与不同浓度NaOH溶液反应过程中的pH变化情况取150mL蒸馏水和150mL溶质质量分数为3%、2%、1%的氢氧化钠溶液于4个烧杯中,分别加入20g干冰,通过传感器测其pH,且pH变化如图2所示。

用NaOH固体配制一定溶质质量分数的溶液,无需用到的仪器有____(填标号)。
A、胶头滴管 B、酒精灯 C、量筒 D、烧杯 E、玻璃棒(4)、蒸馏水中加入干冰后,溶液呈(填“酸”或“碱”)性,该实验目的是。(5)、与干冰混合后,碱性最弱的一组对应的原氢氧化钠溶液的浓度为。(6)、 实验3探究干冰与NaOH溶液反应的产物成分在密闭体系中,分别往等体积、等浓度的Na2CO3溶液和NaHCO3溶液逐滴加入等浓度的稀硫酸,压强变化曲线如图3所示。

0~50s,压强无明显变化的体系中,反应生成的含碳元素的盐类物质M是(填化学式)。
(7)、受上述结论启发,分别取20mL实验2反应后的溶液,逐滴滴加5.3%的稀硫酸,获得的相关数据如下表所示。实验编号
A
B
C
取20mL对应溶液
3%NaOH与干冰反应后的溶液
2%NaOH与干冰反应后的溶液
1%NaOH与干冰反应后的溶液
完全生成M时消耗硫酸体积V1/mL
4.14
1.43
0.36
M完全转化成CO2时消耗硫酸体积V2/mL
4.55
2.46
1.60
①结合表中数据分析,2%NaOH与干冰反应后溶液中的溶质是。
②所取的20mL溶液中,Na2CO3质量分数最大的是(填实验编号)。
四、计算题
-
18. 某工厂以氧化镁矿粉和硫酸为原料制取化肥硫酸镁。现用含MgO 60%的矿粉20t与足量硫酸反应,可制得硫酸镁的质量是多少?(反应原理: )