高中化学人教版(2019)选择性必修1第四章第一节 原电池
试卷更新日期:2022-08-11 类型:同步测试
一、单选题
-
1. 根据原电池原理,下列反应不能设计成原电池的是( )A、2CH3OH+3O2 2CO2+4H2O B、Fe+CuSO4= FeSO4 +Cu C、HCl+NaOH=H2O+NaCl D、2H2S+SO2=3S ↓+2H2O2. 下列反应不可用于设计成原电池的是( )A、CaCO3+2HCl=CaCl2+CO2↑+H2O B、2CH3OH+3O2=2CO2+4H2O C、Zn+2HCl=ZnCl2+H2↑ D、4Al+3O2+6H2O=4Al(OH)33. 关于原电池的叙述中正确的是( )A、原电池是把化学能转变为电能的装置 B、构成原电池正极和负极的必须是两种不同金属 C、原电池电解质溶液中阳离子向负极移动 D、理论上,所有的氧化还原反应都能设计成原电池4. 下列装置可以组成原电池的是( )A、
 B、
B、 C、
C、 D、
D、 5. 下列装置能构成原电池的是( )A、
5. 下列装置能构成原电池的是( )A、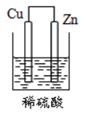 B、
B、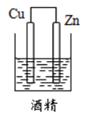 C、
C、 D、
D、 6. 如图为铜锌原电池的示意图,下列说法错误的是()
6. 如图为铜锌原电池的示意图,下列说法错误的是() A、一段时间后,锌片逐渐溶解,质量减小 B、该装置能将电能转化为化学能 C、将铜片换成石墨棒,灯泡亮度不变 D、铜不参与氧化还原反应,只起导电作用7. 如图所示,a、b是两根石墨棒。下列叙述正确的是( )
A、一段时间后,锌片逐渐溶解,质量减小 B、该装置能将电能转化为化学能 C、将铜片换成石墨棒,灯泡亮度不变 D、铜不参与氧化还原反应,只起导电作用7. 如图所示,a、b是两根石墨棒。下列叙述正确的是( ) A、a是正极,发生还原反应 B、b是阳极,发生氧化反应 C、往滤纸上滴加酚酞试液,a极附近颜色变红 D、稀硫酸中硫酸根离子的物质的量不变8. 铜锌原电池(如图)工作时,下列叙述错误的是( )
A、a是正极,发生还原反应 B、b是阳极,发生氧化反应 C、往滤纸上滴加酚酞试液,a极附近颜色变红 D、稀硫酸中硫酸根离子的物质的量不变8. 铜锌原电池(如图)工作时,下列叙述错误的是( ) A、正极反应为:Cu2++2e–= Cu B、电池反应为:Zn+Cu2+=Zn2+ +Cu C、在外电路中,电子从负极流向正极 D、盐桥中的K+移向ZnSO4溶液9. 如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
A、正极反应为:Cu2++2e–= Cu B、电池反应为:Zn+Cu2+=Zn2+ +Cu C、在外电路中,电子从负极流向正极 D、盐桥中的K+移向ZnSO4溶液9. 如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( ) A、反应中,盐桥中的K+会移向CuSO4溶液 B、取出盐桥后,电流计依然发生偏转 C、铜片上有气泡逸出 D、反应前后铜片质量不改变10. 镉镍可充电电池的充、放电反应如下:Cd + 2NiO(OH) + 2H2OCd(OH)2 + 2Ni(OH)2。则该电池充电时阳极放电的是( )A、Cd(OH)2 B、Cd C、Ni(OH)2 D、NiO(OH)11. 2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF− 6,下列说法正确的是( )A、放电时外电路中电子向铝锂电极移动 B、放电时负极反应为AlLi-e−=Al+Li+ C、充电时,应将石墨烯电极与电源负极相连 D、充电时,若电路中转移1 mol电子,则阴极质量增加9g12. 一种锂离子电池,其负极材料为嵌锂石墨,该电池放电时的反应原理为:。下列说法正确的是( )A、放电时,正极反应为Li1-xCoO2+xLi++xe-=LiCoO2 B、电池工作时,只有锂元素化合价发生变化 C、该锂电池的电解质溶液为六氟磷酸锂的水溶液 D、充电时,Li+从LiCoO2晶体中脱嵌,经外电路由正极回到负极13. 碱性锌锰电池的总反应为: , 以溶液为电解质,下列关于该电池的说法正确的是( )A、为正极 B、为负极 C、工作时电子由经外电路流向 D、工作时没有发挥作用14. 某燃料电池以熔融的金属氧化物为电解质、 为燃料,装置如图所示。下列说法错误的是( )
A、反应中,盐桥中的K+会移向CuSO4溶液 B、取出盐桥后,电流计依然发生偏转 C、铜片上有气泡逸出 D、反应前后铜片质量不改变10. 镉镍可充电电池的充、放电反应如下:Cd + 2NiO(OH) + 2H2OCd(OH)2 + 2Ni(OH)2。则该电池充电时阳极放电的是( )A、Cd(OH)2 B、Cd C、Ni(OH)2 D、NiO(OH)11. 2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF− 6,下列说法正确的是( )A、放电时外电路中电子向铝锂电极移动 B、放电时负极反应为AlLi-e−=Al+Li+ C、充电时,应将石墨烯电极与电源负极相连 D、充电时,若电路中转移1 mol电子,则阴极质量增加9g12. 一种锂离子电池,其负极材料为嵌锂石墨,该电池放电时的反应原理为:。下列说法正确的是( )A、放电时,正极反应为Li1-xCoO2+xLi++xe-=LiCoO2 B、电池工作时,只有锂元素化合价发生变化 C、该锂电池的电解质溶液为六氟磷酸锂的水溶液 D、充电时,Li+从LiCoO2晶体中脱嵌,经外电路由正极回到负极13. 碱性锌锰电池的总反应为: , 以溶液为电解质,下列关于该电池的说法正确的是( )A、为正极 B、为负极 C、工作时电子由经外电路流向 D、工作时没有发挥作用14. 某燃料电池以熔融的金属氧化物为电解质、 为燃料,装置如图所示。下列说法错误的是( ) A、a为CH4 , b为空气 B、 向负极移动 C、正极电极反应式为: D、标准状况下,每消耗 甲烷,则正极参加反应的O2为1mol15. 燃料电池是目前电池研究的热点之一、现有某课外小组自制的氢氧燃料电池,如下图所示, 、 均为惰性电极。下列叙述错误的是( )
A、a为CH4 , b为空气 B、 向负极移动 C、正极电极反应式为: D、标准状况下,每消耗 甲烷,则正极参加反应的O2为1mol15. 燃料电池是目前电池研究的热点之一、现有某课外小组自制的氢氧燃料电池,如下图所示, 、 均为惰性电极。下列叙述错误的是( ) A、 极是负极,该电极上发生氧化反应 B、电池总反应为 C、 极电极反应式为 D、氢氧燃料电池是一种具有广阔应用前景的绿色电源16. 甲烷燃料电池的工作原理如图所示,下列说法正确的是( )
A、 极是负极,该电极上发生氧化反应 B、电池总反应为 C、 极电极反应式为 D、氢氧燃料电池是一种具有广阔应用前景的绿色电源16. 甲烷燃料电池的工作原理如图所示,下列说法正确的是( ) A、电极 为负极 B、 由电极 区移向电极 区 C、电池总反应的化学方程式为 D、若电极区溶液体积不变,一段时间后电极 区溶液 变大17. 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH−)制备纳米Cu2O,其装置如图甲、乙。下列说法正确的是( )
A、电极 为负极 B、 由电极 区移向电极 区 C、电池总反应的化学方程式为 D、若电极区溶液体积不变,一段时间后电极 区溶液 变大17. 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH−)制备纳米Cu2O,其装置如图甲、乙。下列说法正确的是( ) A、D电极应连接肼燃料电池的A极 B、肼燃料电池的A极电极反应式为:N2H4-4e-=N2+4H+ C、当反应生成14.4gCu2O时,至少需要肼0.05mol D、图乙中的电解池离子交换膜是阳离子交换膜18. 一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A、D电极应连接肼燃料电池的A极 B、肼燃料电池的A极电极反应式为:N2H4-4e-=N2+4H+ C、当反应生成14.4gCu2O时,至少需要肼0.05mol D、图乙中的电解池离子交换膜是阳离子交换膜18. 一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( ) A、反应 ,每消耗1mol CH4转移12mol 电子 B、电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O C、电池工作时,CO32-向电极B移动 D、电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-19. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A、反应 ,每消耗1mol CH4转移12mol 电子 B、电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O C、电池工作时,CO32-向电极B移动 D、电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-19. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( ) A、HS-转化为 的反应为HS-+4H2O-8e-= +9H+ B、电极b是该电池的正极,发生氧化反应 C、电子从电极b流出,经外电路流向电极a D、若外电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜20. 利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如图所示,其中M。N为厌氧微生物电极。下列有关叙述正确的是( )
A、HS-转化为 的反应为HS-+4H2O-8e-= +9H+ B、电极b是该电池的正极,发生氧化反应 C、电子从电极b流出,经外电路流向电极a D、若外电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜20. 利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如图所示,其中M。N为厌氧微生物电极。下列有关叙述正确的是( ) A、负极的电极反应为: B、电池工作时, 由N极移向M极 C、好氧微生物反应器中发生的反应为: D、相同条件下,产生的 和消耗的 体积之比为5:221. 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2 , 同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( )
A、负极的电极反应为: B、电池工作时, 由N极移向M极 C、好氧微生物反应器中发生的反应为: D、相同条件下,产生的 和消耗的 体积之比为5:221. 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2 , 同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( ) A、氧化银电极上的反应为Ag2O+2e-=2Ag+O2- B、石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+ C、每转移4 mol电子,石墨电极产生22.4 L CO2气体 D、每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区22. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
A、氧化银电极上的反应为Ag2O+2e-=2Ag+O2- B、石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+ C、每转移4 mol电子,石墨电极产生22.4 L CO2气体 D、每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区22. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
A、图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应为:N2+6H++6e-== 2NH3 D、a极上每产生22.4L O2流过电极的电子数为4NA23. 某锂离子二次电池装置如图所示,其放电时的总反应为:Li1-xCoO2+LixC6=6C+LiCoO2 , 下列说法正确的是( ) A、石墨为正极 B、充电时,阳极质量不变 C、充电时,阴极反应式为xLi-xe-=xLi+ D、放电时,电池的正极反应式为xLi++Li1-xCoO2+xe-=LiCoO2
A、石墨为正极 B、充电时,阳极质量不变 C、充电时,阴极反应式为xLi-xe-=xLi+ D、放电时,电池的正极反应式为xLi++Li1-xCoO2+xe-=LiCoO2二、填空题
-
24. 原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
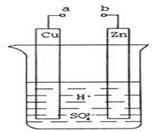
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
25. 燃料电池是一种将燃料所具有的化学能直接转换成电能的化学装置。(1)、以多孔铂为电极,如图甲装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是(填“正极”或“负极”),该电池的负极电极反应式为。 (2)、科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极反应式为 ,(3)、铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2 , 电解液为硫酸。该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
(2)、科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极反应式为 ,(3)、铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2 , 电解液为硫酸。该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)①该蓄电池放电时,电解质溶液中阴离子移向(填“正极”或“负极”);正极附近溶液的酸性(填“增强”“减弱”或“不变”),当外电路通过1 mol电子时,理论上正极板的质量增加g。