高中化学人教版(2019)选择性必修1第三章第一节 电离平衡
试卷更新日期:2022-08-11 类型:同步测试
一、单选题
-
1. 下列物质不属于弱电解质的是( )A、氯化钠 B、氢氟酸 C、醋酸 D、一水合氨2. 下列物质属于强电解质的是( )A、 B、溶液 C、KCl固体 D、(乙醇)3. 下列物质属于弱电解质的是( )A、NH3·H2O B、NaOH C、 D、4. 下列物质属于强电解质且能导电的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融的NaOH ⑥稀硫酸 ⑦乙酸
A、⑤ B、①②⑥ C、②⑤⑥⑦ D、①③④⑤⑥5. 下列各组关于强电解质、弱电解质,非电解质的归类,完全正确的是( )选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
Cl2
A、A B、B C、C D、D6. 下列关于强、弱电解质的叙述中正确的是( )A、强电解质都是离子化合物,弱电解质都是共价化合物 B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C、强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 D、强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱7. 下列说法正确的是( )A、在水溶液中能离解为自由移动的离子的化合物是电解质 B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 D、强电解质溶液导电性一定强于弱电解质的导电性8. 下列事实能说明H2SO3不是强电解质的是( )①0.05mol/LH2SO3溶液的c(H+)=10-3mol/L
②相同条件下,H2SO3的导电能力比H2SO4弱
③H2SO3不稳定,易分解
④H2SO3能与碳酸钠反应制CO2
⑤H2SO3能和水以任意比例互溶
⑥1molH2SO3能够消耗2molNaOH
A、①②⑤ B、①②④ C、①②③⑤ D、①②9. 下列说法中正确的是( )①将硫酸钡放入水中不能导电,但硫酸钡是电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物能导电
⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
A、①④ B、①④⑤ C、①②③④ D、①②③④⑤10. 下列事实不能说明是弱电解质的是( )A、溶液可使石蕊溶液变红 B、等浓度溶液的导电能力比盐酸弱 C、等浓度溶液和盐酸分别与锌粉反应,前者的速率慢 D、相同体积和值的溶液和盐酸与足量锌粉反应,前者产生的多11. 下列事实能证明醋酸是弱电解质的是( )A、醋酸钠的水溶液中存在OH- B、常温时,等浓度醋酸溶液的导电性比盐酸弱 C、0.1mol/L醋酸溶液可使石蕊溶液变红 D、醋酸溶液与碳酸钠溶液反应可产生CO212. 在0.1mol•L-1的醋酸溶液中,存在电离平衡CH3COOHCH3COO-+H+ , 如果要使平衡向逆反应方向移动,同时增大c(H+),应采用的方法是( )A、加入浓盐酸 B、加入CH3COONa固体 C、稀释 D、加入0.01mol•L-1的CH3COOH溶液13. 将浓度为0.1 mol·L-1的CH3COOH溶液加水不断稀释,下列各量始终保持增大的是( )A、c(H+) B、Ka(CH3COOH) C、c(CH3COO-) D、14. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( ) A、a、b、c三点溶液的pH:c<a<b B、用湿润的pH试纸测量a处溶液的pH,测量结果偏小 C、a、b、c三点CH3COOH的电离程度:c<a<b D、a、b、c三点溶液用1 mol·L−1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b15. 下表是几种弱酸常温下的电离平衡常数:
A、a、b、c三点溶液的pH:c<a<b B、用湿润的pH试纸测量a处溶液的pH,测量结果偏小 C、a、b、c三点CH3COOH的电离程度:c<a<b D、a、b、c三点溶液用1 mol·L−1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b15. 下表是几种弱酸常温下的电离平衡常数:1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A、碳酸的酸性强于氢硫酸 B、多元弱酸的酸性主要由第一步电离决定 C、常温下,加水稀释醋酸,溶液中所有离子浓度都减小 D、向弱酸溶液中加少量NaOH溶液,电离平衡常数不变16. 已知碳酸和次溴酸的电离常数如下,判断可以发生的反应是( )酸
碳酸
次溴酸(HBrO)
Ka(25℃)
K1=4.30×10-7 K2=5.61×10-11
2.4×10-9
①HBrO+Na2CO3=NaBrO+NaHCO3 ②2HBrO+Na2CO3=2NaBrO+H2O+CO2↑ ③NaBrO+CO2+H2O=NaHCO3+HBrO ④HBrO+NaHCO3=NaBrO+H2O+CO2↑
A、①④ B、②④ C、②③ D、①③17. 由表格中的电离常数判断下列反应可以发生的是( )弱酸
HClO
H2CO3
电离常数(25℃)
K=3.2×10-8
K1=4.3×10-7
K2=4.7×10-11
A、NaClO+NaHCO3=HClO+Na2CO3 B、NaClO+CO2+H2O=HClO+NaHCO3 C、2NaClO+CO2+H2O=2HClO+Na2CO3 D、HClO+NaHCO3=NaClO+CO2↑+H2O18. 已知几种弱酸的电离平衡常数数值如表:弱酸
HF
HClO
H2CO3
电离平衡常数(25℃)
6.3×10-4
4.0×10-8
Ka1=4.5×10-7
Ka2=4.7×10-11
下列离子方程式书写正确的是( )
A、F-+HClO=HF+ClO- B、2ClO-+CO2+H2O=CO32-+2HClO C、CO32-+2HF=2F-+CO2↑+H2O D、HCO3-+HClO=ClO-+CO2↑+H2O19. 已知部分弱酸的电离平衡常数如表所示:弱酸
电离平衡常数(25℃)
下列离子方程式不正确的是( )
A、少量通入溶液中: B、少量加入溶液中: C、过量加溶液中: D、相同浓度溶液与溶液等体积混合:二、填空题
-
20. 现有下列物质:①K2SO4晶体;②液态SO3;③冰醋酸;④铜;⑤小苏打;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨NaOH溶液。其中:能导电的是(填序号,下同);属于电解质的是;属于非电解质的是;属于强电解质的是;属于弱电解质的电离方程式为。21. 在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+△H>0,下列方法中,可以使0.10mol•L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol•L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol•L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol•L﹣1的NaOH溶液.
22.(1)、现有以下物质:① 晶体 ② ③液态醋酸 ④铜 ⑤固体 ⑥纯蔗糖 ⑦酒精 ⑧熔融的 ⑨氨水 ⑩液氮.请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式: .
(2)、一定条件下,冰醋酸加水稀释过程中溶液的导电能力如图所示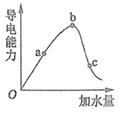
①a、b、c三点对应的溶液中,醋酸电离程度最大的是; 最小的是 .
②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A. B. C. 分子数 D.
(3)、已知 时, 的电离平衡常数 的电离平衡常数 ,试写出下列情况下发生的离子反应方程式:①向 溶液中通入少量 :
②向 溶液中滴入少量新制氯水:
23. 在稀氨水中存在下述电离平衡NH3+H2O⇌NH3•H2O⇌NH4++OH﹣ , 分别加入少量下列物质,溶液中c(OH﹣)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?加入的物质
少量(NH4)2SO4固体
少量HNO3溶液
少量KOH溶液
c(OH﹣)的变化
①
②
③
平衡移动方向
④
⑤
⑥
三、综合题
-
24. 25℃时,三种酸的电离平衡常数如下:回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
(1)、一般情况下,当温度升高时,电离平衡常数K(填“增大”、“减小”或“不变”)。(2)、下列四种离子结合质子能力最强的是(填字母)。a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)、下列反应不能发生的是(填字母)。a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
四、实验探究题
-
25.(1)、为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法(填“正确”或“不正确”),并说明理由:。②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a , 然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b , 若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变(填“深”或“浅”)。你认为证明氨水是弱碱的原因是。
④请你根据所提供的试剂,再提出一个合理简便的方案证明NH3·H2O是弱电解质:。
(2)、25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=。
-