高中化学人教版(2019)选择性必修1第二章第二节 化学平衡
试卷更新日期:2022-08-10 类型:同步测试
一、单选题
-
1. 某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是( )
 A、C,D是生成物 B、反应的方程式为2A + B
A、C,D是生成物 B、反应的方程式为2A + B 2C
C、2 min后各物质的量不再变化
D、该反应不是可逆反应
2. 对可逆反应2SO2+O2 2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()A、只存在于O2中 B、只存在于O2和SO3中 C、只存在于O2和SO2中 D、存在于O2、SO2和SO3中3. 在一定条件下的密闭容器中,进行可逆反应:。下列说法中,能说明该反应已经达到化学平衡状态的是( )A、、、的浓度均不再变化 B、、、三者的浓度相等 C、、、在容器中共存 D、正、逆化学反应速率均为04. 在一定温度、容积不变的密闭容器里,下列选项中可用来判断可逆反应A(g)+3B(g)2C(g)+2D(s)达到平衡的有( )
2C
C、2 min后各物质的量不再变化
D、该反应不是可逆反应
2. 对可逆反应2SO2+O2 2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()A、只存在于O2中 B、只存在于O2和SO3中 C、只存在于O2和SO2中 D、存在于O2、SO2和SO3中3. 在一定条件下的密闭容器中,进行可逆反应:。下列说法中,能说明该反应已经达到化学平衡状态的是( )A、、、的浓度均不再变化 B、、、三者的浓度相等 C、、、在容器中共存 D、正、逆化学反应速率均为04. 在一定温度、容积不变的密闭容器里,下列选项中可用来判断可逆反应A(g)+3B(g)2C(g)+2D(s)达到平衡的有( )①C的生成速率与C的消耗速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再改变
④混合气体的密度不再改变
⑤混合气体的总压强不再改变
⑥混合气体的总物质的量不再改变
⑦A、B、C、D浓度之比为1:3:2:2
A、两个 B、三个 C、四个 D、五个5. 恒温恒容条件下,某密闭容器中发生如下反应:H2(g)+I2(g) 2HI(g),说明该反应已达到平衡状态的是 ( )A、容器内总压强不随时间改变 B、气体的密度不随时间改变 C、单位时间内生成2 mol HI同时消耗1 mol H2 D、H2的体积分数不随时间改变6. 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A、①④⑤⑥ B、②③⑥ C、②④⑤⑥ D、只有④7. 对于可逆反应2A2(g)+B2(g)⇌2A2B(g)△H<0。达到平衡,要使正、逆反应的速率都增大,且平衡向右移动,可以采取的措施是( )A、加入合适的催化剂 B、降低温度 C、增大压强 D、减小压强8. 一定条件下的密闭容器中发生反应: 。当达到平衡时,下列各项措施中,能提高乙烷转化率的是( )A、缩小容器的容积 B、降低反应的温度 C、分离出部分氢气 D、等容下通入稀有气体9. 下列可逆反应达到平衡后,减压时平衡逆向移动的是( )A、2NH3(g)N2(g)+3H2(g) B、2NO(g)N2(g)+O2(g) C、3O2(g)2O3(g) D、CO(aq)+H+(aq)HCO(aq)10. 可逆反应aA(s)+bB(g) cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是( ) A、达到平衡后,加入催化剂,C的体积分数增大 B、达到平衡后,升高温度,平衡向逆方向移动 C、化学方程式中,b>c+d D、达到平衡后,增加A的量,平衡向右移动11. 将一定量的NO和Cl2充入密闭容器中,发生反应2NO(g)+ Cl2(g)⇌2NOCl(g),建立平衡后,保持温度不变,再充入少量的NO和NOCl,当达到新的平衡时,与旧平衡相比,的值( )A、不变 B、变小 C、变大 D、先变大后变小12. 已知反应 , 该反应的平衡常数表达式为( )A、 B、 C、 D、13. 已知448℃时反应 的平衡常数是49,则 在该温度下的平衡常数是( )A、 B、2401 C、7 D、14. 在密团容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g) CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( )A、0.5mol B、0.95mol C、1mol D、2/3mol15. 某温度下,将2 mol E和3 mol F充入一密闭容器中,发生反应: ,平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的平衡转化率为( )A、60% B、50% C、40% D、30%16. 利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g)
A、达到平衡后,加入催化剂,C的体积分数增大 B、达到平衡后,升高温度,平衡向逆方向移动 C、化学方程式中,b>c+d D、达到平衡后,增加A的量,平衡向右移动11. 将一定量的NO和Cl2充入密闭容器中,发生反应2NO(g)+ Cl2(g)⇌2NOCl(g),建立平衡后,保持温度不变,再充入少量的NO和NOCl,当达到新的平衡时,与旧平衡相比,的值( )A、不变 B、变小 C、变大 D、先变大后变小12. 已知反应 , 该反应的平衡常数表达式为( )A、 B、 C、 D、13. 已知448℃时反应 的平衡常数是49,则 在该温度下的平衡常数是( )A、 B、2401 C、7 D、14. 在密团容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g) CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( )A、0.5mol B、0.95mol C、1mol D、2/3mol15. 某温度下,将2 mol E和3 mol F充入一密闭容器中,发生反应: ,平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的平衡转化率为( )A、60% B、50% C、40% D、30%16. 利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )  A、b点时,CO的转化率为20% B、容器内的压强保持恒定,表明反应达到平衡状态 C、b点和d点的化学平衡常数:Kb>Kd D、0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-117. 一定条件下的反应aA(g)+bB(g)cC(g)+dD(s) ΔH=QkJ·mol−1 , 反应过程中化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示,以下说法不正确的是( )
A、b点时,CO的转化率为20% B、容器内的压强保持恒定,表明反应达到平衡状态 C、b点和d点的化学平衡常数:Kb>Kd D、0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-117. 一定条件下的反应aA(g)+bB(g)cC(g)+dD(s) ΔH=QkJ·mol−1 , 反应过程中化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示,以下说法不正确的是( ) A、Q>0 B、a+b<c C、K越大,A的转化率越大 D、达到平衡后,增加少量D,平衡逆向移动18. 向体积为10L的恒容密闭容器中通入1.1 mol CH4(g)和1.1molH2O(g)制备H2 , 反应原理为(正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是( )
A、Q>0 B、a+b<c C、K越大,A的转化率越大 D、达到平衡后,增加少量D,平衡逆向移动18. 向体积为10L的恒容密闭容器中通入1.1 mol CH4(g)和1.1molH2O(g)制备H2 , 反应原理为(正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是( ) A、温度Ta<Tb B、Ta时,CH4的平衡转化率 C、Tb时,平衡时再充入1.1 mol CH4 , 平衡常数增大 D、Tb时,若改为恒温恒压容器,平衡时n(CO)>0.6mol19. 在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 恒容密闭容器中,发生反应: , 一段时间后达到平衡。反应过程中测定的数据如下表:
A、温度Ta<Tb B、Ta时,CH4的平衡转化率 C、Tb时,平衡时再充入1.1 mol CH4 , 平衡常数增大 D、Tb时,若改为恒温恒压容器,平衡时n(CO)>0.6mol19. 在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 恒容密闭容器中,发生反应: , 一段时间后达到平衡。反应过程中测定的数据如下表:t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是( )
A、反应前 的平均速率 B、该温度下此反应的平衡常数 C、其他条件不变,再充入 Z ,平衡时 X 的体积分数不变 D、其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)20. 在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表物质的量
CO2
H2
CO
H2O
甲
amol
amol
0mol
0mol
乙
2amol
amol
0mol
0mol
丙
0mol
0mol
2amol
2amol
丁
0mol
0mol
amol
amol
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A、乙=丁>丙=甲 B、乙>丁>甲>丙 C、丁>乙>丙=甲 D、丙>乙>丁=甲21. 在一个1L的密闭容器中加2molA和1molB发生反应: 2A(g)+B(g) 3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是( )A、6mol C+2mol D B、4mol A+2mol B C、1mol A+0.5mol B+1.5mol C D、3mol C+5mol D二、填空题
-
22. 在一容积为 2L 的密闭容器内加入 0.2mol的 N2 和 0.5mol的 H 2 ,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3 (g) ΔH<0。反应中 NH3的物质的量浓度的变化情况如图所示:
 (1)、根据图示,计算从反应开始到平衡时,平均反应速率 v(NH3 )=。(2)、反应达到平衡后,计算该反应的平衡常数 K= 。(3)、反应达到平衡后,第 5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数(填“增大”、“减小”或“不变”)。23. 硫酰氯 和亚硫酰氯 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂.
(1)、根据图示,计算从反应开始到平衡时,平均反应速率 v(NH3 )=。(2)、反应达到平衡后,计算该反应的平衡常数 K= 。(3)、反应达到平衡后,第 5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数(填“增大”、“减小”或“不变”)。23. 硫酰氯 和亚硫酰氯 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂.已知:Ⅰ.
II.
(1)、若在绝热、恒容的密闭容器中充入一定量的 和 ,发生反应: ,下列示意图能说明 时刻反应达到平衡状态的是(填序号).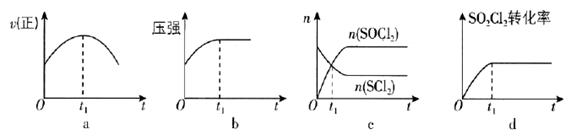 (2)、为研究不同条件对反应Ⅰ的影响.恒温条件下,向 恒容密闭容器中加入 ,经 反应Ⅰ达到平衡.测得 内 ,则平衡时 的转化率 . 保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时 的转化率为 ,则 (填“>”“<”“=”)24. 在一定条件下,反应A(g)+B(g) ⇋ C(g),∆H < 0,达到平衡后,根据下列图像判断:(1)、升温,达到新的平衡的是();(2)、降压,达到新的平衡的是();(3)、减少C的量,移向新平衡的是();(4)、增加A的量,移向新平衡的是(),此时B的转化率(填“增大”或“减小”或“不变”,下空同);(5)、使用催化剂,达到平衡的是(),C的质量分数 。
(2)、为研究不同条件对反应Ⅰ的影响.恒温条件下,向 恒容密闭容器中加入 ,经 反应Ⅰ达到平衡.测得 内 ,则平衡时 的转化率 . 保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时 的转化率为 ,则 (填“>”“<”“=”)24. 在一定条件下,反应A(g)+B(g) ⇋ C(g),∆H < 0,达到平衡后,根据下列图像判断:(1)、升温,达到新的平衡的是();(2)、降压,达到新的平衡的是();(3)、减少C的量,移向新平衡的是();(4)、增加A的量,移向新平衡的是(),此时B的转化率(填“增大”或“减小”或“不变”,下空同);(5)、使用催化剂,达到平衡的是(),C的质量分数 。


三、综合题
-
25. 回答下列问题:(1)、工业上用二氧化碳催化加氢可合成乙醇,其反应原理为。通过表格中的数值可以推断:该反应的(填“>”、“<”或“=”)0;其正反应在(填“高温”、“低温”或“任何温度”)下能自发进行。若达到平衡时,液化分离出 , 反应速率将(填“增大”、“减小”或“不变”)。
温度/
400
500
平衡常数K
9
5.3
 (2)、工业上也可以利用和合成甲醇:。某恒温恒容密闭容器中充入和发生反应,测得和浓度随时间变化如上图所示。
(2)、工业上也可以利用和合成甲醇:。某恒温恒容密闭容器中充入和发生反应,测得和浓度随时间变化如上图所示。①内,的平均反应速率为 , 该温度下的平衡常数为。若达平衡时,保持温度不变,向容器中再充入、、和各 , 则此时(填“>”、“<”或=”)。
②下列说法能说明反应达到化学平衡状态的是(填字母序号)。
A.的消耗速率与的消耗速率之比为3∶1
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.和的浓度相等时