上海市崇明区2022年中考二模化学试题
试卷更新日期:2022-08-10 类型:中考模拟
一、单选题
-
1. 属于非金属元素的是( )A、碳 B、银 C、汞 D、钾2. 日常生活中的现象没有发生化学变化的是( )A、光合作用 B、海水晒盐 C、纸张燃烧 D、铁锅生锈3. 属于纯净物的是( )A、自来水 B、矿泉水 C、天然水 D、蒸馏水4. 电子产品触摸屏的主要材料是氧化铟(In2O3)氧化铟中铟元素的化合价是( )A、+1 B、+2 C、+3 D、+45. 对碳酸钠进行焰色反应,火焰呈( )A、紫色 B、黄色 C、绿色 D、红色6. 实验测得一些液体室温时的pH,其中属于碱性的是( )A、雪碧:5 B、牛奶:6 C、食醋:3 D、肥皂水:107. 不属于碳元素同素异形体的物质是()A、金刚石 B、石墨 C、C60 D、木炭8. 冶炼钛(Ti)的反应之一为 ,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应9. 实验操作正确的是( )A、滴加液体
 B、细铁丝在氧气中燃烧
B、细铁丝在氧气中燃烧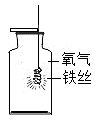 C、量取液体
C、量取液体 D、加热液体
D、加热液体 10. 有关硫粉在氧气中燃烧的现象,描述错误的是( )A、有刺激性气味 B、放出热量 C、生成二氧化硫 D、发出蓝紫色火焰11. 所采取的安全措施错误的是( )A、油锅着火,锅盖盖灭 B、燃气泄漏,点火检查 C、点燃氢气,提前验纯 D、加油站内,禁止吸烟12. 有关物质的性质与用途对应关系正确的是( )A、盐酸有挥发性,可用于金属除锈 B、活性炭有吸附性,可用于自来水杀菌消毒 C、氢氧化钠是碱,可用于改良酸性土壤 D、氦气密度小和化学性质稳定,可充填飞艇13. 二氧化碳和氢气在一定条件下生成甲醇(一种燃料)和水,反应的微观示意图如下图。有关说法正确的是( )
10. 有关硫粉在氧气中燃烧的现象,描述错误的是( )A、有刺激性气味 B、放出热量 C、生成二氧化硫 D、发出蓝紫色火焰11. 所采取的安全措施错误的是( )A、油锅着火,锅盖盖灭 B、燃气泄漏,点火检查 C、点燃氢气,提前验纯 D、加油站内,禁止吸烟12. 有关物质的性质与用途对应关系正确的是( )A、盐酸有挥发性,可用于金属除锈 B、活性炭有吸附性,可用于自来水杀菌消毒 C、氢氧化钠是碱,可用于改良酸性土壤 D、氦气密度小和化学性质稳定,可充填飞艇13. 二氧化碳和氢气在一定条件下生成甲醇(一种燃料)和水,反应的微观示意图如下图。有关说法正确的是( ) A、甲醇的化学式为CH3O B、甲醇中碳元素的质量分数最小 C、参加反应的二氧化碳和氢气的分子个数比为1∶3 D、该反应有单质生成14. 下列图像能正确反应其对应变化关系的是( )A、
A、甲醇的化学式为CH3O B、甲醇中碳元素的质量分数最小 C、参加反应的二氧化碳和氢气的分子个数比为1∶3 D、该反应有单质生成14. 下列图像能正确反应其对应变化关系的是( )A、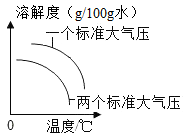 气体物质的溶解度与温度和压强的关系
B、
气体物质的溶解度与温度和压强的关系
B、 一定量的镁在过量氧气中充分燃烧
C、
一定量的镁在过量氧气中充分燃烧
C、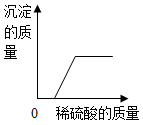 向NaOH和BaCl2的混合溶液中加入足量的稀硫酸
D、
向NaOH和BaCl2的混合溶液中加入足量的稀硫酸
D、 高温煅烧一定质量的石灰石
15. 说法正确的是( )A、含氢元素和酸根的化合物一定是酸 B、显碱性的溶液一定是碱的溶液 C、有氧气参加的反应一定是氧化反应 D、酸和碱反应一定没有明显现象
高温煅烧一定质量的石灰石
15. 说法正确的是( )A、含氢元素和酸根的化合物一定是酸 B、显碱性的溶液一定是碱的溶液 C、有氧气参加的反应一定是氧化反应 D、酸和碱反应一定没有明显现象二、多选题
-
16. 有关水与硝酸钾溶液的说法,正确的是( )A、电解水时,连接正极一段产生的是氧气 B、水由二个氢原子和一个氧原子构成 C、硝酸钾饱和溶液不能再溶解少量氯化钾 D、硝酸钾溶液均一、稳定、透明17. 依据实验目的设计的实验方案合理的是( )
选项
实验目的
实验方案
A
配制100g质量分数为5%的NaCl溶液
向盛有5.0g NaCl固体的烧杯中,加入100g水,搅拌
B
除去CaCl2溶液中少量的盐酸
加入过量的CaCO3 , 过滤
C
鉴别碳粉、铁粉、氧化铜三种固体
取样,分别滴加稀盐酸,观察现象
D
检验CO2中混有的少量O2
将带火星的木条伸入气体中
A、A B、B C、C D、D三、填空题
-
18. 化学与我们的生活、生产、能源密切相关。(1)、空气中含量最多的气体是;二氧化硫若排放到空气中造成的后果是。(2)、以四氯化碳(CCl4)和金属钠为原料,在700℃下隔绝空气反应得到金刚石和化合物X,反应为CCl4 + 4NaC + 4X
Ⅰ、四氯化碳有种元素组成。
Ⅱ、金刚石中碳元素以(选填“化合态”或“游离态”)存在,化合物X的化学式是。
(3)、天然气是一种重要的能源,主要成分是甲烷(CH4)。请结合表中信息回答。体 积
0℃/101kPa
20℃/101kPa
0℃/202kPa
16g甲烷
22.4L
24.0L
11.2L
Ⅰ、甲烷属于(选填“有机物”或“无机物”)。
Ⅱ、16g甲烷中约含个甲烷分子(用科学记数法表示)。
Ⅲ、压强变大,甲烷分子间的间隔(选填“变大”、“变小”或“不变”)。
四、综合题
-
19. 我国化学家侯德榜创立了“侯氏制碱法”,为世界制纯碱的工业作出了杰出贡献。(1)、“侯氏制碱法”生产出Na2CO3的同时得到副产品NH4Cl,生产原理如下图。
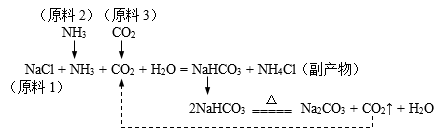
Ⅰ、Na2CO3的类别属于(选填“酸”、“碱”或“盐”);副产品NH4Cl可作(选填“氮”、“磷”或“钾”)肥。
Ⅱ、制纯碱的过程中,可以循环利用的物质是。
(2)、下图是氯化钠、碳酸氢钠、氯化铵的溶解度曲线(资料:60℃时溶液中的碳酸氢铵受热分解)
Ⅰ、0℃时,碳酸氢钠的溶解度是。
Ⅱ、20℃时,将20g氯化钠加入50g水中,充分溶解后得到(填“饱和”或“不饱和”)溶液。
Ⅲ、产物中NaHCO3比NH4Cl先结晶析出。结合①中生产原理及溶解度曲线解释其原因。
(3)、“侯氏制碱法”生产的纯碱中含有氯化钠。为测定纯碱样品(Na2CO3和NaCl的混合物)中碳酸钠的质量分数,兴趣小组进行了下图的实验。(过滤后滤渣损失忽略不计)
Ⅰ、纯碱样品中碳酸钠的物质的量为。
Ⅱ、实验中个别同学过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该纯碱样品中碳酸钠的质量分数(选填“偏大”、“不变”或“偏小”)。
20. 探究是学习化学的重要方法(1)、第一兴趣小组对金属的化学性质进行了探究。将a mol锌粉加入到含0.1mol硝酸铜和0.4mol硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。Ⅰ、锌粉与硝酸铜反应的化学方程式是。
Ⅱ、若取少量滤液于试管中,滴加稀盐酸,产生白色沉淀,则滤液中溶质的成分是(用化学式表示)。
Ⅲ、若滤渣中含有两种金属,则a的取值范围是。
(2)、第二兴趣小组对硫酸、氢氧化钠的化学性质进行了如下探究。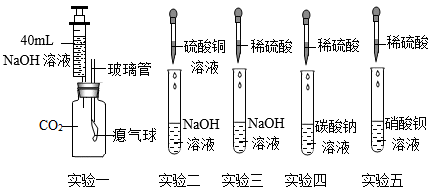
Ⅰ、实验一中,将注射器中氢氧化钠溶液全部推入集气瓶中,过一会儿观察到气球鼓起。甲同学认为二氧化碳与氢氧化钠发生了反应;乙同学认为该实验不严谨,于是将该注射器中氢氧化钠溶液换成 , 做了对比实验,从而证明二者发生了反应。
Ⅱ、实验二中,反应的化学方程式为。
Ⅲ、取少量实验三中的剩余溶液,滴加几滴酚酞试液,溶液呈无色,证明稀硫酸与氢氧化钠溶液能发生反应。该实验方案是否可行,并说明理由。
Ⅳ、将实验四、实验五两支试管反应后的物质倒入同一洁净的烧杯中,充分反应后过滤,得到无色滤液和白色沉淀。同学们对白色沉淀的成分继续进行了实验。
实验操作
实验现象
实验结论
取少量白色沉淀于试管中,加入足量的稀盐酸
白色沉淀是BaSO4、BaCO3
实验结束后,同学们对废液进行了回收和处理。
21. 化学是一门以实验为基础的科学。根据如图回答问题。 (1)、仪器a的名称是。(2)、实验室可选择装置A用于制备氧气,该反应的化学方程式为;若用D装置且采用排水法收集氧气,是先将集气瓶装满水,再将氧气从(填“m”或“n”)端通入,水从另一端排出。(3)、实验室用大理石和稀盐酸制取二氧化碳,发生装置可选用B和C,装置C的优点是。(4)、草酸溶液可除铁锈和污渍。草酸晶体加热发生的反应为H2C2O4·2H2OCO2↑ + CO↑ + 3H2O。为检验分解后的产物,设计了下图所示实验。
(1)、仪器a的名称是。(2)、实验室可选择装置A用于制备氧气,该反应的化学方程式为;若用D装置且采用排水法收集氧气,是先将集气瓶装满水,再将氧气从(填“m”或“n”)端通入,水从另一端排出。(3)、实验室用大理石和稀盐酸制取二氧化碳,发生装置可选用B和C,装置C的优点是。(4)、草酸溶液可除铁锈和污渍。草酸晶体加热发生的反应为H2C2O4·2H2OCO2↑ + CO↑ + 3H2O。为检验分解后的产物,设计了下图所示实验。
Ⅰ、实验中证明有水生成的现象是。
Ⅱ、乙中澄清石灰水的作用是检验二氧化碳,该反应的化学方程式为。
Ⅲ、要证明有CO生成,在不连接其他装置的情况下,可进行的操作是。
-