江苏省南京市玄武区2022年中考二模化学试题
试卷更新日期:2022-08-10 类型:中考模拟
一、单选题
-
1. 下列资源的利用过程中,一定发生了化学变化的是( )A、风力发电 B、胆矾炼铜 C、海水晒盐 D、分离液态空气2. 下列属于人体必需微量元素的是( )A、铁 B、氧 C、氮 D、碳3. 常温下,下列物质为白色固体的是( )A、氧化汞 B、氧化铜 C、二氧化锰 D、五氧化二磷4. 下列物质由分子构成的是( )A、镁 B、水 C、氯化钠 D、硫酸铜5. 下列物质中,属于纯净物的是( )A、海水 B、空气 C、臭氧 D、加碘盐6. 下列粒子结构示意图中,表示稀有气体原子的是( )A、
 B、
B、 C、
C、 D、
D、 7. 2022年世界环境日中国主题为“共建清洁美丽城市”。下列做法不符合这一主题的是( )A、布袋购物,努力减少“白色污染” B、实行垃圾分类,节约使用资源 C、提倡使用一次性餐具,方便又卫生 D、绿色出行,积极步行“低碳生活”8. 钛合金具有记忆效应,元素周期表中钛元素的某些信息如图所示。下列有关钛的说法错误的是( )
7. 2022年世界环境日中国主题为“共建清洁美丽城市”。下列做法不符合这一主题的是( )A、布袋购物,努力减少“白色污染” B、实行垃圾分类,节约使用资源 C、提倡使用一次性餐具,方便又卫生 D、绿色出行,积极步行“低碳生活”8. 钛合金具有记忆效应,元素周期表中钛元素的某些信息如图所示。下列有关钛的说法错误的是( ) A、属于金属元素 B、原子序数为22 C、元素符号是Ti D、相对原子质量为47.87g9. 下列实验操作图示正确的是( )A、加热液体
A、属于金属元素 B、原子序数为22 C、元素符号是Ti D、相对原子质量为47.87g9. 下列实验操作图示正确的是( )A、加热液体 B、取用液体
B、取用液体 C、稀释浓硫酸
C、稀释浓硫酸 D、塞紧橡胶塞
D、塞紧橡胶塞 10. 蛋白质是由多种氨基酸[如丙氨酸(C3H7NO2)等]构成的。下列说法错误的是( )A、丙氨酸由13个原子构成 B、丙氨酸中碳元素的质量分数最高 C、蛋白质属于有机高分子化合物 D、蛋白质是人体所需的基本营养素之一11. 某同学为了探究微粒性质,按图示进行实验,并借助传感器测得U型管a、b中氨气浓度随时间变化的曲线。下列关于该实验的说法错误的是( )
10. 蛋白质是由多种氨基酸[如丙氨酸(C3H7NO2)等]构成的。下列说法错误的是( )A、丙氨酸由13个原子构成 B、丙氨酸中碳元素的质量分数最高 C、蛋白质属于有机高分子化合物 D、蛋白质是人体所需的基本营养素之一11. 某同学为了探究微粒性质,按图示进行实验,并借助传感器测得U型管a、b中氨气浓度随时间变化的曲线。下列关于该实验的说法错误的是( )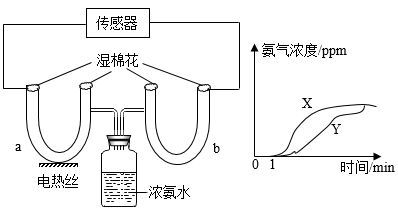 A、曲线X对应的U型管为a B、实验证明了微粒运动速率与温度有关 C、湿棉花的作用是吸收NH3 , 减少NH3对空气的污染 D、0﹣1分钟,因为微粒静止不动,所以氨气浓度为零12. 下列实验能达到实验目的的是( )A、测定空气中氧气含量
A、曲线X对应的U型管为a B、实验证明了微粒运动速率与温度有关 C、湿棉花的作用是吸收NH3 , 减少NH3对空气的污染 D、0﹣1分钟,因为微粒静止不动,所以氨气浓度为零12. 下列实验能达到实验目的的是( )A、测定空气中氧气含量 B、探究燃烧条件
B、探究燃烧条件 C、验证质量守恒定律
C、验证质量守恒定律 D、探究铁生锈与水有关
D、探究铁生锈与水有关 13. 在Cu(NO3)2、Al(NO3)3和AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有( )A、Cu B、Al C、Ag D、Fe14. 除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是( )
13. 在Cu(NO3)2、Al(NO3)3和AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有( )A、Cu B、Al C、Ag D、Fe14. 除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是( )实验目的
实验方案
A
N2气体(O2气体)
缓缓通过灼热的铜网
B
CO2气体(CO气体)
通入少量氧气,点燃
C
KCl溶液(K2SO4溶液)
加入过量BaCl2溶液,过滤
D
CaO固体(CaCO3固体)
加入足量的稀盐酸至无气体产生
A、A B、B C、C D、D15. 取24.8g过氧化银(Ag2O2)在真空条件下加热至固体质量不再发生变化,产生3.2gO2 , 固体质量随温度的变化如图所示(图中各点对应固体均为纯净物)。下列说法正确的是( ) A、X→Y过程中,固体中银元素的质量分数逐渐减小 B、Y点对应的固体中银元素和氧元素的质量比为27:4 C、Z→W过程中产生的氧气质量为2.4g D、Z→W过程中发生的反应为
A、X→Y过程中,固体中银元素的质量分数逐渐减小 B、Y点对应的固体中银元素和氧元素的质量比为27:4 C、Z→W过程中产生的氧气质量为2.4g D、Z→W过程中发生的反应为二、填空题
-
16. 能源与材料在日常生活、工农业生产和科学研究中有着广泛的用途。(1)、化石燃料属于(填“可再生”或“不可再生”)能源,包括煤、石油和等。将石油加热炼制,利用石油中各成分的不同,将它们分离,可得到不同的产品(如汽油、煤油等)。(2)、液氨有望成为新一代的绿色能源。氨气在氧气中燃烧时可释放大量热,且生成氮气和水,请写出该反应的化学方程式。(3)、单层的石墨片(有人称为石墨烯)是目前世界上人工制得的最薄的材料,其物理性质与金刚石存在明显差异,原因是。(4)、塑料是一种常见材料,请设计实验验证聚乙烯塑料中含有碳元素,并完成实验报告。
实验步骤
实验现象
实验结论
17. 水和溶液对我们生活、生产有着重要作用。(1)、往适量的水中加入下列物质,温度明显升高的是____(填字母)。A、氧化钙 B、氯化钠 C、硝酸铵 D、氢氧化钠(2)、硬水是指含有较多的水。生活中常采用的方法降低水的硬度。(3)、在20℃时,氢气的溶解度为0.018的含义是。(4)、甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是____(填字母)。 A、20℃时,甲的溶解度为40 B、甲中含有少量乙,可用降温结晶的方法提纯 C、10℃时,甲、乙的饱和溶液中,溶质与溶剂的质量比相等 D、在35℃时,分别将20g甲、乙溶于100g水中,降温至5℃时,乙溶液的溶质质量分数可能会大于甲
A、20℃时,甲的溶解度为40 B、甲中含有少量乙,可用降温结晶的方法提纯 C、10℃时,甲、乙的饱和溶液中,溶质与溶剂的质量比相等 D、在35℃时,分别将20g甲、乙溶于100g水中,降温至5℃时,乙溶液的溶质质量分数可能会大于甲三、综合题
-
18. 化学是一门以实验为基础的科学。
 (1)、写出实验室用高锰酸钾制取氧气的化学方程式 , 可选用的发生装置是(填字母);氧气可用排水法收集的原因是。(2)、实验室可用A、D装置来制取二氧化碳并进行“喷泉”实验。将A装置的导管和D装置的导管a连接,打开导管a、c上的活塞,关闭导管b上的弹簧夹,可收集CO2 , 检验集气瓶中已收集满CO2气体的方法是;收集满CO2后,关闭导管a、c上的活塞,打开导管b上的弹簧夹,用热毛巾捂住集气瓶,一段时间后观察到氢氧化钠溶液进入集气瓶内,形成了“喷泉”,请写出集气瓶中发生反应的化学方程式。(3)、实验室常用C装置制备气体,C装置与A装置相比具有的优点是。19. 合金有着广泛的应用。(1)、以下属于合金的是____。A、黄铜 B、焊锡 C、不锈钢 D、磁铁矿(2)、Mg2Cu是一种贮氢合金,如图是制取与贮存氢气的一种方法,
(1)、写出实验室用高锰酸钾制取氧气的化学方程式 , 可选用的发生装置是(填字母);氧气可用排水法收集的原因是。(2)、实验室可用A、D装置来制取二氧化碳并进行“喷泉”实验。将A装置的导管和D装置的导管a连接,打开导管a、c上的活塞,关闭导管b上的弹簧夹,可收集CO2 , 检验集气瓶中已收集满CO2气体的方法是;收集满CO2后,关闭导管a、c上的活塞,打开导管b上的弹簧夹,用热毛巾捂住集气瓶,一段时间后观察到氢氧化钠溶液进入集气瓶内,形成了“喷泉”,请写出集气瓶中发生反应的化学方程式。(3)、实验室常用C装置制备气体,C装置与A装置相比具有的优点是。19. 合金有着广泛的应用。(1)、以下属于合金的是____。A、黄铜 B、焊锡 C、不锈钢 D、磁铁矿(2)、Mg2Cu是一种贮氢合金,如图是制取与贮存氢气的一种方法,
①ZnFe2O4中Fe的化合价为。
②循环制氢体系中制取氢气的总反应的化学方程式是。
③贮氢反应过程中,一定质量的Mg2Cu合金完全吸收氢气,生成MgH2、合金MgCu2的混合物,将该混合物与过量的稀盐酸完全反应放出氢气的质量Mg2Cu合金吸收氢气的质量。(选填“大于”、“等于”或“小于”)。(已知:MgH2+2HCl=MgCl2+2H2↑)。
(3)、生铁和钢均为铁的合金。①生铁的含碳量钢的含碳量(选填“大于”、“等于”或“小于”)。
②取一定量生铁与足量稀硫酸充分反应后,产生0.1g氢气。则该生铁样品中含铁的质量是多少(生铁中其余成分均不与稀硫酸反应)?(写出计算过程)
20. A~J是初中化学常见的物质,且分别是由C、H、O、N、Na、S、Fe、Cl中的一种或几种元素组成。I为单质,A、B、F、G、J均由两种元素组成,其中A、F、J为氧化物且A为红棕色固体,其余物质均由三种元素组成。D物质俗称为烧碱,物质H可作氮肥。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。 (1)、写出化学式:D , I。(2)、写出H→G反应的化学方程式。(3)、写出A与B反应的化学方程式。(4)、C→I反应的基本反应类型为。21. 化学兴趣小组对某“酸碱灭火器”(如图所示)进行了相关探究。
(1)、写出化学式:D , I。(2)、写出H→G反应的化学方程式。(3)、写出A与B反应的化学方程式。(4)、C→I反应的基本反应类型为。21. 化学兴趣小组对某“酸碱灭火器”(如图所示)进行了相关探究。查阅资料:
①酸碱灭火器反应原理:内筒中的稀硫酸或稀盐酸与外筒中的碳酸钠或碳酸氢钠的浓溶液发生反应,产生大量的CO2气体。
②常温下,饱和碳酸钠溶液、碳酸氢钠溶液的pH分别为12.3和8.3。
③碳酸氢钠浓溶液与氯化钙浓溶液反应的化学方程式:2NaHCO3 + CaCl2= CaCO3↓ + CO2 ↑+ 2NaCl + H2O。
(1)、材质分析:如图所示,制作喷嘴的塑料属于(填字母,下同);制作外筒的钢属于。
A.合成材料 B.金属材料 C.复合材料
(2)、实验探究:I、内筒试剂
【猜想与假设】猜想一:稀盐酸 ;猜想二:稀硫酸。
【进行实验】分别取少量内筒中的溶液于两支试管中;向一支试管中加入适量的氯化钡溶液,观察到试管中无明显现象;向另一支试管中加入溶液(写名称),观察到试管中。
【实验结论】内筒中盛放的试剂为稀盐酸。
(3)、II、外筒试剂【猜想与假设】猜想一:碳酸钠溶液;猜想二:碳酸氢钠溶液。
【进行实验1】如图所示,组装好实验装置;取适量外筒中的溶液于仪器a中,向a中滴入氯化钙浓溶液,一段时间后,观察到。
 (4)、【进行实验2】取适量外筒中的溶液于烧杯中,插入pH计。测得溶液的 pH为。
(4)、【进行实验2】取适量外筒中的溶液于烧杯中,插入pH计。测得溶液的 pH为。【实验结论】外筒中盛放的试剂为饱和碳酸钠溶液。
根据上述实验结论,请写出该“酸碱灭火器”产生二氧化碳的化学方程式。
(5)、反思与拓展:小组同学查阅了化学教材等相关资料,认为可以向样品中持续通入二氧化碳气体,观察溶液中是否出现沉淀来确定外筒盛放的试剂。
【查阅资料】
①资料卡片
石笋和钟乳石的形成
如果你参观过溶洞,一定会为溶洞中形态各异的石笋和钟乳石而惊叹。在赞叹大自然的鬼斧神工之余,你是否会想:这些石笋和钟乳石是怎样形成的?
溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:。

②20℃时,物质在水中的溶解度:
物质
Na2CO3
NaHCO3
溶解度/g
21.5
9.6
【进行实验】在20℃时,小组同学分别取等量饱和Na2CO3、NaHCO3溶液于试管中,持续通入CO2(如图所示),饱和 Na2CO3溶液中会出现白色沉淀,而饱和NaHCO3溶液中无明显现象。

【实验分析】根据资料推测将二氧化碳气体持续通入饱和碳酸钠溶液中出现白色沉淀的原因。
【实验结论】可以利用向样品中持续通入二氧化碳气体的方法,确定外筒中溶液的成分。