2022年化学中考真题汇编:金属活动性顺序
试卷更新日期:2022-08-10 类型:二轮复习
一、单选题
-
1. 向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是( )A、滤液中一定含有Cu(NO3)2 B、滤液呈无色 C、滤渣只含有Ag D、向滤渣中滴加稀硫酸有气泡产生2. 下列图像不能正确反映对应变化关系的是( )A、
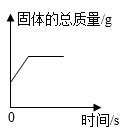 在密闭容器中用足量铜粉测定空气中氧气的含量
B、
在密闭容器中用足量铜粉测定空气中氧气的含量
B、 向等质量的镁粉和锌粉中分别加入足量稀硫酸
C、
向等质量的镁粉和锌粉中分别加入足量稀硫酸
C、 向一定溶质质量分数的氢氧化钠溶液中不断加水
D、
向一定溶质质量分数的氢氧化钠溶液中不断加水
D、 向氯化铜和盐酸的混合溶液中加入氢氧化钠溶液至过量
3. 为探究铜、锌、X三种金属的活动性,某同学做了如下实验。则三种金属的活动性由强到弱的顺序是( )
向氯化铜和盐酸的混合溶液中加入氢氧化钠溶液至过量
3. 为探究铜、锌、X三种金属的活动性,某同学做了如下实验。则三种金属的活动性由强到弱的顺序是( )实验操作



现象
产生气泡
无明显现象
X丝表面析出红色固体
A、锌、X、铜 B、X、锌、铜 C、锌、铜、X D、铜、X、锌4. 向一定量CuSO4溶液中加入过量铁粉,充分反应后过滤得到滤渣和滤液,下列判断正确的是( )A、得到的滤液呈蓝色 B、所得滤渣的质量比加入铁粉的大 C、向滤渣中滴加稀盐酸无气泡产生 D、滤液中一定有FeSO4 , 可能有CuSO45. 在硝酸铜、硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤。下列说法正确的是( )A、若滤液为无色,则滤渣中一定有银和锌,可能有铜 B、若滤液为蓝色,则滤液中一定有Cu2+、Zn2+ , 可能有Ag+ C、若往滤渣中加入稀盐酸有气泡产生,则滤液中一定有Zn2+、Ag+ , 可能有Cu2+ D、若往滤液中加入稀盐酸有白色沉淀产生,则滤渣中一定有银和铜,可能有锌6. 如图所示,用导线将锌片和铜片分别连接到电流表的正负极,插入硫酸铜溶液中即可构成化学电池。下列说法错误的是( ) A、该装置将化学能直接转化成电能 B、反应后烧杯中溶液的质量变小 C、实验说明锌的金属活动性大于铜 D、涉及的反应为7. 竞争无处不在,微观粒子之间的反应也是如此。将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中发生反应,溶液的质量随时间的变化关系如图所示。
A、该装置将化学能直接转化成电能 B、反应后烧杯中溶液的质量变小 C、实验说明锌的金属活动性大于铜 D、涉及的反应为7. 竞争无处不在,微观粒子之间的反应也是如此。将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中发生反应,溶液的质量随时间的变化关系如图所示。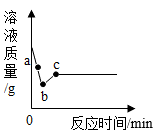
下列说法错误的是( )
A、a点对应的溶液中含有三种金属阳离子 B、b点处的固体中含Ag和Zn C、取少量b点处的溶液于试管中,滴加稀盐酸会有沉淀出现 D、溶液先不变色,一段时间后由蓝色逐渐变为无色8. 现有X、Y、Z三种金属,常温下只有X能和稀硫酸反应,把Y、Z两种金属分别放入硝酸银溶液中,只有Y表面有银白色物质析出。三种金属的活动性顺序为( )A、Y>X>Z B、Y>Z>X C、X>Y>Z D、X>Z>Y9. 现有 X、Y、Z 三种金属。如果把 X 和 Y 分别放入稀硫酸中,X 溶解并产生氢气,Y 不反应。如果 Y 和 Z 分别放入硝酸银溶液中,过一会儿,在 Y 表面有银析出,而 Z 没有变化。根据以上实验事实,金属活泼性由强到弱( )A、X>Y>Z B、Z>X>Y C、X>Z>Y D、Y>X>Z10. 金属活动性顺序在科学研究中有重要应用。将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝表面会覆盖一层物质,这层物质是( )A、银和锌 B、银 C、锌 D、银和铁11. 为验证锌、铁、铜三种金属的活动性颗序,小红设计了如图所示的四个实验,下列说法中正确的是( ) A、通过实验①②③能验证锌的金属活动性比铁的强 B、实验③中溶液的质量变大 C、X可能为锌,Y可能为硫酸亚铁 D、只做实验③和④,一定不能验证锌、铁、铜的金属活动性顺序12. 为验证Zn、Cu和Ag三种金属的活动性顺序,设计的下列实验方案能达到目的是( )A、将Zn、Cu分别加入AgNO3溶液中 B、将Zn、Cu和Ag分别加入稀盐酸中 C、将Zn、Ag分别加入CuSO4溶液中 D、将Zn分别加入CuSO4、AgNO3溶液中13. 向装有等量的同种盐酸的四支试管中,分别随机加入相同规格的Mg、Fe、Cu、Ag片,甲和丙均有气泡产生,且丙更剧烈,乙和丁无明显现象(如图)。则甲中放置的是( )
A、通过实验①②③能验证锌的金属活动性比铁的强 B、实验③中溶液的质量变大 C、X可能为锌,Y可能为硫酸亚铁 D、只做实验③和④,一定不能验证锌、铁、铜的金属活动性顺序12. 为验证Zn、Cu和Ag三种金属的活动性顺序,设计的下列实验方案能达到目的是( )A、将Zn、Cu分别加入AgNO3溶液中 B、将Zn、Cu和Ag分别加入稀盐酸中 C、将Zn、Ag分别加入CuSO4溶液中 D、将Zn分别加入CuSO4、AgNO3溶液中13. 向装有等量的同种盐酸的四支试管中,分别随机加入相同规格的Mg、Fe、Cu、Ag片,甲和丙均有气泡产生,且丙更剧烈,乙和丁无明显现象(如图)。则甲中放置的是( ) A、Mg B、Fe C、Cu D、Ag14. 实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )A、滤液中一定含有硫酸镁,可能含有硫酸亚铁 B、若滤液为浅绿色,则滤渣中一定含有镁和铁 C、向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁 D、所得滤液的质量一定比原溶液的质量大15. 为了验证镁、锌、铁、铜四种金属的金属活动性强弱,某同学进行了如下实验(如图甲所示),充分反应后发现试管中均有少量固体残留。实验结束后,将三支试管中的物质全部倒入一只洁净的烧杯中,最终得到无色溶液a和固体b(如图乙所示)。由此得出以下结论:①反应前后三支试管中溶液的颜色均发生明显变化;②固体b中至少含有1种金属;③固体b中最多含有四种金属;④溶液a中至少含有2种金属离子;⑤该实验能得出4种金属的金属活动性顺序:Mg>Zn>Fe>Cu。其中正确结论的个数是( )
A、Mg B、Fe C、Cu D、Ag14. 实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )A、滤液中一定含有硫酸镁,可能含有硫酸亚铁 B、若滤液为浅绿色,则滤渣中一定含有镁和铁 C、向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁 D、所得滤液的质量一定比原溶液的质量大15. 为了验证镁、锌、铁、铜四种金属的金属活动性强弱,某同学进行了如下实验(如图甲所示),充分反应后发现试管中均有少量固体残留。实验结束后,将三支试管中的物质全部倒入一只洁净的烧杯中,最终得到无色溶液a和固体b(如图乙所示)。由此得出以下结论:①反应前后三支试管中溶液的颜色均发生明显变化;②固体b中至少含有1种金属;③固体b中最多含有四种金属;④溶液a中至少含有2种金属离子;⑤该实验能得出4种金属的金属活动性顺序:Mg>Zn>Fe>Cu。其中正确结论的个数是( ) A、1 B、2 C、3 D、416. 老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是( )A、
A、1 B、2 C、3 D、416. 老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是( )A、 B、
B、 C、
C、 D、
D、 17. 向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是( )A、
17. 向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是( )A、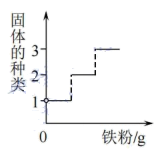 B、
B、 C、
C、 D、
D、 18. 向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是( )
18. 向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是( ) A、a点时,溶液的总质量与反应前相比减小 B、b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液 C、c点时,溶液呈无色 D、d点时,过滤所得滤渣为Cu和Ag的混合物19. 现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )A、Cu>X>Y B、X>Cu>Y C、X>Y>Cu D、Y>X>Cu
A、a点时,溶液的总质量与反应前相比减小 B、b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液 C、c点时,溶液呈无色 D、d点时,过滤所得滤渣为Cu和Ag的混合物19. 现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )A、Cu>X>Y B、X>Cu>Y C、X>Y>Cu D、Y>X>Cu二、填空题
-
20. 将铝粉和锌粉的混合物加入一定量的硝酸镁和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。则滤渣中一定含有的物质是(填化学式,下同),滤液中可能含有的溶质是。
三、综合题
-
21. 构建知识网络是学习化学的重要方法之一。酸、碱、盐及金属的知识网络如图(图中“一”两端的物质一定条件下可以反应),利用图中信息回答问题:
 (1)、某运送硫酸的罐车发生侧翻,造成硫酸泄漏,为防止造成腐蚀和污染,用熟石灰进行处理。这是利用反应①的原理,有关反应的化学方程式是。(2)、某同学利用反应⑤探究金属活动性强弱:将锌粒加入一定量的CuSO4溶液中,充分反应后过滤,得到滤渣和无色滤液。滤渣中一定含有的金属是(填化学式),反应的化学方程式是。22. 从废旧电脑的某些零部件中回收金属银,设计流程如图所示:
(1)、某运送硫酸的罐车发生侧翻,造成硫酸泄漏,为防止造成腐蚀和污染,用熟石灰进行处理。这是利用反应①的原理,有关反应的化学方程式是。(2)、某同学利用反应⑤探究金属活动性强弱:将锌粒加入一定量的CuSO4溶液中,充分反应后过滤,得到滤渣和无色滤液。滤渣中一定含有的金属是(填化学式),反应的化学方程式是。22. 从废旧电脑的某些零部件中回收金属银,设计流程如图所示: (1)、步骤Ⅰ和步骤Ⅱ都涉及的实验操作是 。(2)、步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为 。(3)、溶液X中只含有一种溶质,该溶质的化学式为 。(4)、据此判断,铜、银、铝的金属活动性由强到弱的顺序是 (填元素符号)。23. 知图,研究金属的活动性顺序实验。
(1)、步骤Ⅰ和步骤Ⅱ都涉及的实验操作是 。(2)、步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为 。(3)、溶液X中只含有一种溶质,该溶质的化学式为 。(4)、据此判断,铜、银、铝的金属活动性由强到弱的顺序是 (填元素符号)。23. 知图,研究金属的活动性顺序实验。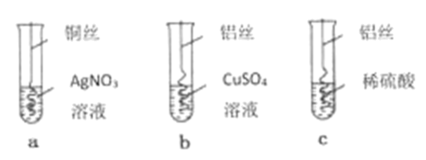 (1)、实验a观察到的现象是。(2)、要验证铜、铝、银的活动性顿序,不必做的实验是(填实验序号)。24. 常见的金属有镁、铝、铜、银等。请根据金属的化学性质回答下列问题:(1)、将一定质量的镁粉放入到含有溶质为硝酸铝、硝酸铜、硝酸银的溶液中,充分反应后过滤,得到滤渣和滤液。
(1)、实验a观察到的现象是。(2)、要验证铜、铝、银的活动性顿序,不必做的实验是(填实验序号)。24. 常见的金属有镁、铝、铜、银等。请根据金属的化学性质回答下列问题:(1)、将一定质量的镁粉放入到含有溶质为硝酸铝、硝酸铜、硝酸银的溶液中,充分反应后过滤,得到滤渣和滤液。①若滤液呈蓝色,则滤渣中可能含有的金属是。
②若向滤渣中加入稀盐酸无气泡产生,则滤液中一定含有的溶质是。(填化学式)
(2)、某金属粉末中含有镁、铝、铜、银中的一种或几种,取12g该金属粉末与足量稀盐酸反应产生1g氢气,则该金属粉末的组成有种情况。25. 铁铜双金属粉末可用于生产机械零件。利用还原铁粉和CuSO4溶液制备该产品的工艺流程如图所示。
 (1)、“搅拌”时发生的反应利用了铁的金属活动性比铜的(填“强”或“弱”)。(2)、“过滤”后滤液的主要成分是(写化学式)。(3)、若用该工艺制备了1000g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。(4)、“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图所示。若(3)中产品是在500℃时干燥还原后得到的,则其中最多含Fe元素g(产品中只含三种元素)。
(1)、“搅拌”时发生的反应利用了铁的金属活动性比铜的(填“强”或“弱”)。(2)、“过滤”后滤液的主要成分是(写化学式)。(3)、若用该工艺制备了1000g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。(4)、“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图所示。若(3)中产品是在500℃时干燥还原后得到的,则其中最多含Fe元素g(产品中只含三种元素)。
 26. 百色市某铝厂为了“变废为宝,点渣成金”,从含有Al2O3、SiO2等成分的工业废渣中提取金属铝,其工艺流程如下:
26. 百色市某铝厂为了“变废为宝,点渣成金”,从含有Al2O3、SiO2等成分的工业废渣中提取金属铝,其工艺流程如下:
回答下列问题:
(1)、流程图中含铝元素的物质里属于碱的是。(2)、“过量的酸溶液”中使用的酸是____ (填字母序号)。A、醋酸 B、HNO3 C、H2SO4(3)、通过该流程可得出SiO2的性质有:(写一条)。(4)、电解Al2O3产生两种单质,该反应的化学方程式为: , 它所属的基本反应类型是反应。27. 我国西汉时期就有用胆矾湿法炼铜的记载。现阶段,这种方法在生产有色金属方面的作用越来越大。为了验证铁和硫酸铜溶液的反应,认识其反应原因,同学们设计了如下实验方案,请根据下列提示,补全实验内容:【实验方案】
⑴实验方法:将洁净的铁丝伸入盛有硫酸铜溶液的试管中。
⑵实验原理:(用化学方程式表示)。
⑶实验现象:。
⑷实验结论:。
【问题与交流】
①该实验成功的关键是什么?(写1点)。
②简述铁和硫酸铜溶液反应的微观实质。
28. 垃圾分类有利于保护环境,充分利用资源。某厂从废旧电子产品中回收贵重金属同时制备CuSO4·5H2O的工艺流程如下:
已知:步骤3中发生反应的化学方程式为: 。
回答下列问题:
(1)、从垃圾分类的角度,该厂加工的废旧电子产品属于____。A、有害垃圾 B、可回收垃圾 C、厨余垃圾 D、其他垃圾(2)、流程中步骤③回收的贵重金属为。(3)、流程中操作a表示一系列的操作,包括:蒸发浓缩、、过滤、洗涤、干燥等。(4)、步骤②中发生反应的化学方程式为。29. 白铜是铜、镍(Ni)合金,某学习小组同学欲利用废弃的白铜回收铜、镍两种金属。(1)、先向盛有等量镍粉和锌粉的两支试管中分别加入溶质质量分数相同的稀硫酸,观察到都有气泡产生,且锌粉与稀硫酸反应更剧烈,镍粉与稀硫酸反应后的溶液为绿色,说明镍的金属活动性比锌(填“强”或“弱”)。查阅资料可知,镍与稀硫酸反应的化学方程式为:。
(2)、接下来,同学们设计了如下实验流程回收铜和镍。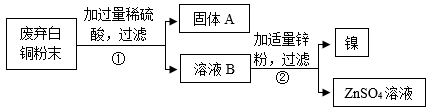
上图中,固体A是 , ②中反应的化学方程式是(只写一个)。
(3)、要验证Ni、Zn、Cu的金属活动性顺序,用下列各组药品进行实验,不能达到目的的是____(填字母)。A、Ni、Zn、Cu、稀盐酸 B、Ni、Cu、ZnSO4溶液 C、Zn、Cu、NiSO4溶液 D、Ni、ZnSO4溶液、CuSO4溶液30. 钢铁是应用最普遍的金属材料,也是最容易发生锈蚀的金属材料之一、人类为金属的锈蚀付出了巨大的代价,所以金属的防腐和废旧金属的回收有着十分重要的意义。(1)、工业上用赤铁矿(主要成分Fe2O3)炼铁的原理:(用化学方程式表示)。(2)、钢铁生锈是铁与空气中发生化学反应的结果。(3)、处理某废旧金属后的溶液中含有Cu(NO3)2和AgNO3两种溶质,为回收其中的金属,向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生。则滤液中一定含有的金属离子是;滤渣中可能含有。31. 用下图所示实验研究金属的性质。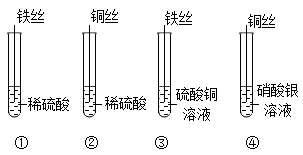 (1)、①中有气体生成,生成的气体为。(2)、③中反应的化学方程式为。(3)、下列实验组合中,能得出铁、铜、银的金属活动性顺序的是____(填序号)。A、①④ B、③④ C、①②④32. 神舟十三号载人飞行任务的顺利完成,彰显了中国航天的力量。在航天领域中使用了大量金属材料。(1)、新型镁锂合金用于制造火星车的车结构,体现了镁锂合金具有密度小、耐腐蚀、的优良性能。生铁和钢是常见的两种铁合金,其主要区别是。(2)、铝制品具有很好的抗腐蚀性能,原因(用化学方程式表示)。(3)、为了防止铁制品生锈,常在其表面喷漆或镀一层金属,其防锈原理是。(4)、向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到蓝色滤液。则滤液中一定含有的溶质是。33. 2022年6月5日10时44分07秒,神舟十四号载人飞船成功发射。人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,镍(Ni)元素在化合物中常见的化合价为+2价。(1)、请写出金属镍与稀硫酸发生置换反应的化学方程式;(2)、选择镍片和溶液,能比较出镍和铜的金属活动性顺序。34. 人类社会需要充足的能源、丰富的材料、良好的环境。(1)、Ⅰ.自然界中的“碳循环”(见图)为生态系统的正常运转提供了可靠的资源保障。
(1)、①中有气体生成,生成的气体为。(2)、③中反应的化学方程式为。(3)、下列实验组合中,能得出铁、铜、银的金属活动性顺序的是____(填序号)。A、①④ B、③④ C、①②④32. 神舟十三号载人飞行任务的顺利完成,彰显了中国航天的力量。在航天领域中使用了大量金属材料。(1)、新型镁锂合金用于制造火星车的车结构,体现了镁锂合金具有密度小、耐腐蚀、的优良性能。生铁和钢是常见的两种铁合金,其主要区别是。(2)、铝制品具有很好的抗腐蚀性能,原因(用化学方程式表示)。(3)、为了防止铁制品生锈,常在其表面喷漆或镀一层金属,其防锈原理是。(4)、向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到蓝色滤液。则滤液中一定含有的溶质是。33. 2022年6月5日10时44分07秒,神舟十四号载人飞船成功发射。人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,镍(Ni)元素在化合物中常见的化合价为+2价。(1)、请写出金属镍与稀硫酸发生置换反应的化学方程式;(2)、选择镍片和溶液,能比较出镍和铜的金属活动性顺序。34. 人类社会需要充足的能源、丰富的材料、良好的环境。(1)、Ⅰ.自然界中的“碳循环”(见图)为生态系统的正常运转提供了可靠的资源保障。
化石燃料主要包括煤、石油和 , 煤的燃烧过程中能转化为热能。
(2)、人们积极开发和利用新能源,以减少二氧化碳的排放。下列属于新能源的是(填序号)。a.氢能 b.木炭 c.太阳能 d.秸秆
(3)、光合作用是自然界中“碳循环”和“氧循环”的重要环节,光合作用生成的有机物的化学式为。(4)、泰州拥有我国最大的二氧化碳气田。请写出二氧化碳的一种用途:。(5)、Ⅱ.金属材料为促进生产发展、改善人类生活发挥了重要作用。《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明铜锡合金相较于铜、锡的特点是。
(6)、分别向盛有硫酸锌溶液、硝酸银溶液的两支试管中加入铜片,其中发生反应的化学方程式为。(7)、金属锈蚀给人类带来了巨大损失。请写出防止铁生锈的一种方法:。35. 金属材料对于促进生产发展,改善人类生活发挥了重大作用,因此学习金属性质,根据性质合理使用金属就显得十分重要。请按要求回答下列有关金属性质的问题:(1)、铝具有很好的抗腐蚀性能原因是。(2)、向含有硝酸铜、硝酸银和硝酸锌的混合溶液中,加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣。滤液中一定含有的溶质是 , 滤渣中一定含有的物质是。36. 金属及金属材料在生产、生活中应用广泛。(1)、铝具有很好的抗腐蚀性,是因为其表面生成一层致密的薄膜,该薄膜是(填化学式)。(2)、向一定质量的氧化铜中加入一定量稀硫酸使其完全溶解,得到蓝色溶液。再加入铁粉充分反应,过滤,得到滤渣和滤液。向滤渣中加入稀硫酸,有气泡冒出,则滤液中的溶质是(填化学式)。(3)、早在春秋战国时期,我国就开始生产和使用铁器。炼铁原理是利用一氧化碳与氧化铁在高温条件下反应,该反应的化学方程式为。现将某铁合金(只含铁和碳)8.7 g 放入盛有 100 g 稀盐酸的烧杯中,恰好完全反应,得到 108.1 g 溶液,则该样品中碳的质量分数为(结果精确到 0.1%)。该铁合金属于(填“钢”或“生铁”)。37. 金属及其制品是现代生活中不可缺少的材料和工具。请用所学化学知识回答下列问题:(1)、我国神舟十三号载人飞船用的是砷化镓太阳能电池。镓在元素周期表中的信息和原子结构示意图如图所示:
镓原子核内质子数为 , 镓原子在化学反应中所形成的镓离子的符号为。
(2)、“天问一号”探测器应用了世界上目前最轻的金属结构材料一新型镁锂合金,该合金具有减震、消噪和抗电磁干扰性能。关于该材料,下列说法错误的是____(填字母序号)。A、该材料硬度很小 B、该材料对电磁波有屏弊作用 C、该材料可有效的降低卫星发射时的噪音(3)、某同学在探究金属与盐溶液反应的实验时,向铝粉和锌粉的混合物中加入一定质量的Mg(NO3)2和AgNO3混合溶液,充分反应后,过滤,可得到滤渣和滤液。则反应后滤液的质量比反应前混合溶液的质量(填“增大”或“减小”):若滤渣中含有三种金属,则此时滤液中的溶质是(填化学式)。38. 第24届冬奥会于2022年2月4日在北京隆重举行,本届冬奥会体现了绿色办奥的理念。(1)、冬奥会速滑馆“冰丝带”制冰采用了世界上最先进的二氧化碳跨临界直冷制冰技术。固态二氧化碳叫做。(2)、本届冬奥会用氢能源汽车作为交通工具,这将需要大量高纯度、低成本的氢气满足氢燃料汽车的使用。有专家研究出一种新型的催化剂,在光照下实现水的高效分解制氢气,其中部分过程的微观示意图如下图所示: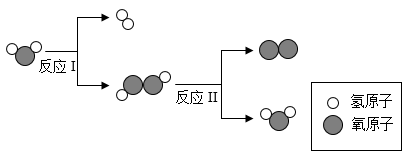
请写出反应I的化学方程式 , 该反应属于反应(填基本反应类型)。
(3)、可口可乐为冬奥会场馆清理废弃物的清废团队提供。温暖包-----工作服套装(如图)。服装面料的可乐瓶环保布,是利用回收的可口可乐塑料瓶加工成的丝线纺织而成,为区分可乐瓶环保布和棉布,可采用的化学方法。 (4)、冬奥会利用废旧电子设备回收金、银来制作奖牌。从废旧电子粗产品中回收金、银的部分流程如下:
(4)、冬奥会利用废旧电子设备回收金、银来制作奖牌。从废旧电子粗产品中回收金、银的部分流程如下:
①操作I的名称是 , 溶液A中的阳离子有(填离子符号)。
②步骤二中加入硝酸银溶液的作用是。
39. 2018年世界权威期刊《自然》,连刊两文报道石墨烯超导重大发现,论文的第一作者是四川成都籍中科大年轻博士曹原。下面让我们一起重走“超导材料”发现的神奇之路。请回答相关问题。(1)、1911年荷兰物理学家海克·卡莫林·昂内斯经过无数次实验确认,汞在温度接近-273℃时几乎处于“零电阻状态”,称之为“超导电性”。汞属于元素(填“金属”或“非金属”),其导电的原因是含有自由移动的。(2)、1980年有人发现了铜氧化合物的“超导电性”,将温度提高到约为-140℃。YBa2Cu3O5为其代表之一,其中Cu为+1价,O为-2价,则Y为价。(3)、2017年曹原团队发现了石墨烯中的非规“超导电性”,石墨烯是一层碳原子(如图,黑球代表碳原子)。
①曹原推测,当两层石墨烯叠在一起,若彼此之间发生轻微偏移时,有可能产生超导现象,经过不懈努力,困扰世界107年的常温超导难题,终于被曹原团队突破!石墨烯属于(填“单质”或“化合物”),两层石墨烯叠在一起轻微偏移时发生的是变化(填“物理”或“化学”)。
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银。该实验是否产生了氢气?(填“是”或“否”),原因是。我们坚信未来的中国,必定有十个、百个乃至成千上万个“曹原”,用自己的科技之梦去推动中华民族的伟大复兴。
40. 金属及金属材料广泛应用于生产、生活及科学实验,其应用推动了社会的发展。(1)、下列实验中,铜片上的白磷燃烧,说明铜具有性:黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度(填“大”或“小")。 (2)、铁在潮湿的空气中容易生锈,写出一种防止铁制品生锈的具体方法。(3)、春秋战国时期,我国就开始生产和使用铁器。工业上用赤铁矿(主要成分Fe2O3)和一氧化碳反应炼铁的化学方程式为。(4)、某同学对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液进行探究,流程如下(M表示一种金属元素):
(2)、铁在潮湿的空气中容易生锈,写出一种防止铁制品生锈的具体方法。(3)、春秋战国时期,我国就开始生产和使用铁器。工业上用赤铁矿(主要成分Fe2O3)和一氧化碳反应炼铁的化学方程式为。(4)、某同学对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液进行探究,流程如下(M表示一种金属元素):
根据实验探究流程,回答下列问题:
①气体X的化学式为。
②金属Fe、Cu、Ag、M的活动性由强到弱的顺序是。
③滤液D中所含溶质的成分可能有种情况。
四、推断题
-
41. 已知A-F是初中化学常见的物质,其中A-E是五种不同类别的物质,A在工业上广泛用于玻璃、造纸、纺织、洗涤剂的生产等,实验室常用C和E反应来制取氢气,F可用来配制农药波尔多液。它们相互之间的关系如图所示(图中“—”表示相连的两种物质之间可以相互反应,“→”表示一种物质可以转化为另一种物质,部分反应物和生成物及反应条件已略去),请回答下列问题:
 (1)、B→A的化学方程式是。(2)、足量的C与D反应的现象是。(3)、E与F的溶液能够发生反应的原因是。
(1)、B→A的化学方程式是。(2)、足量的C与D反应的现象是。(3)、E与F的溶液能够发生反应的原因是。五、实验探究题
-
42. 人类的生产、生活离不开金属材料,金属的发现和使用推动了人类社会发展。部分金属的发现历程如下图所示,请根据要求回答下列问题:
 (1)、根据上图分析,金属的发现历程与金属的有关。(2)、铝被广泛地应用,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝的性能好。(3)、某兴趣小组为探究Fe、Cu、R的金属活动性顺序。展开了一系列探究。
(1)、根据上图分析,金属的发现历程与金属的有关。(2)、铝被广泛地应用,除了因为改进铝的冶炼方法使其成本降低,以及铝的密度小外,还由于铝的性能好。(3)、某兴趣小组为探究Fe、Cu、R的金属活动性顺序。展开了一系列探究。【提出问题】如何判断 Fe、Cu、R 的金属活动性顺序?
【猜想与假设】
猜想一:Fe>Cu>R 猜想二:Fe>R>Cu 猜想三:
(4)、【进行实验】实验操作
实验现象
实验结论
猜想二正确
(5)、【拓展与应用】为了回收利用金属,同学们将反应后的物质倒入同一容器中,向其中加入过量的铝粉,充分反应后过滤,则滤渣中的金属单质为。43. 我国西汉时期就有用胆矾湿法炼铜的记载。现阶段,这种方法在生产有色金属方面的作用越来越大。为了验证铁和硫酸铜溶液的反应,认识其反应原因,同学们设计了如下实验方案,请根据下列提示,补全实验内容:
实验方法:将洁净的铁丝伸入盛有硫酸铜溶液的试管中。
(1)、实验原理:(用化学方程式表示)。(2)、实验现象:(3)、实验结论:44. 已知某金属材料中含有镁、锌、铁、铜中的两种。小明在老师的指导下对该金属材料的成分进行探究。(1)、【查阅资料】金属与盐酸反应的比较,如下图所示。得出这四种金属的活动性由强到弱的顺序是。 (2)、【进行实验】
(2)、【进行实验】实验一:
实验步骤
实验现象
实验结论
取少量金属材料样品于试管中,加入过量的稀硫酸。观察现象
固体全部溶解,
金属材料中一定有铁,一定没有
实验完成后,将废液倒入废液缸中
――――
―――――
(3)、实验二:步骤1:另取金属材料,用砂纸打磨,称量其质量为20g:
步骤2:将打磨过的金属材料浸入过量的硫酸锌溶液中,过一会儿取出,洗净,在一定条件下烘干,称量其质量大于20g:
步骤3:实验完成后,将废液倒入废液缸中。
【得出结论】该金属材料中除铁外,还含有。
(4)、【实验反思】步骤2中,“一定条件”指的是。(5)、【拓展提升】小红想对废液缸中的废液进行回收利用。请你帮她分析废液成分,废液中溶质的成分是(填化学式)。
 45. 化学是一门以实验为基础的自然科学(1)、(一)实验帮助我们研究物质的组成
45. 化学是一门以实验为基础的自然科学(1)、(一)实验帮助我们研究物质的组成如图是测定空气中氧气体积分数的实验装置,请回答下列问题:

红磷在空气中燃烧的现象是 , 发生反应的化学方程式为:。
(2)、实验结论:氧气约占空气总体积的。(3)、(二)实验帮助我们研究物质的性质

图1实验中,食用油溶解于中,该实验表明影响物质溶解性的因素是。
(4)、图2试管B中发生反应的化学方程式为:。(5)、为了探究Zn、Fe、Cu的金属活动性顺序,图2试管C中需要补全的一组试剂是。(6)、(三)实验帮助我们研究物质的制法实验室模拟炼铁原理的装置如下图所示,请回答下列问题:

写出A装置玻璃管中发生反应的化学方程式: , 该反应前后碳元素化合价发生的变化是。
(7)、B装置中的现象是。(8)、实验中需要进行尾气处理的原因是。46. 根据如图所示的实验回答问题。
 (1)、甲是粗盐提纯实验中的过滤操作。仪器a的名称是;若过滤后所得溶液仍然浑浊,可能的原因是。(2)、乙是金属化学性质的实验。实验前先用砂纸打磨铝丝的目的是;步骤②中观察到铝丝表面的现象是。设计该实验的依据是。
(1)、甲是粗盐提纯实验中的过滤操作。仪器a的名称是;若过滤后所得溶液仍然浑浊,可能的原因是。(2)、乙是金属化学性质的实验。实验前先用砂纸打磨铝丝的目的是;步骤②中观察到铝丝表面的现象是。设计该实验的依据是。
-
-