2022年化学中考真题汇编:常见的金属
试卷更新日期:2022-08-10 类型:二轮复习
一、单选题
-
1. 下列有关金属材料的说法错误的是( )A、铜常用作导线,说明铜具有良好的导电性 B、“真金不怕火炼”说明金的化学性质不活泼 C、生铁和钢是含碳量不同的两种铁合金 D、铝制品具有很好的抗腐蚀性,说明铝的金属活动性比较弱2. 下列自行车构件及配件所用的材料中,属于金属材料的是( )A、塑料车筐 B、橡胶车胎 C、钢制车圈 D、棉布座套3. 下列生活用品,利用金属导电性的是( )A、铁锅 B、铜导线 C、铝箔包装纸 D、金饰品4. 火箭推进剂涉及的下列元素中,属于金属元素的是( )A、H B、N C、O D、Al5. 下列有关金属的说法正确的是( )A、所有金属都呈银白色 B、常温下,所有的金属都是固体 C、为了增加金属产量,大量开采金属矿物 D、金属的回收利用,能减少对环境的污染6. 推理是化学学习过程中一种重要的思维方法,下列推理正确的是( )A、可燃性气体点燃前要检验纯度,所以点燃甲烷气体前要先检验其纯度 B、置换反应有单质和化合物生成,所以有单质和化合物生成的反应都是置换反应 C、单质中只含有一种元素,则只含有一种元素的物质一定是单质 D、通常相比铁更易与氧气发生化学反应,所以在空气中铝制品比铁制品更易被腐蚀7. 下列四组实验均是向盛有不同物质的烧杯中逐滴加入X溶液至过量。生成沉淀或气体的质量与加入X溶液的质量关系,符合图像的一组是( )
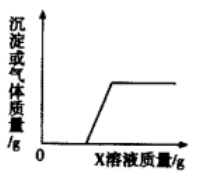
组别
烧杯中的物质
X溶液
①
CuSO4和Na2SO4溶液
NaOH溶液
②
铜锌合金
稀H2SO4
③
稀HNO3和稀H2SO4
BaCl2溶液
④
NaOH和Na2CO3溶液
稀盐酸
A、① B、② C、③ D、④8. 用下图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( ) A、锌粒参加的反应均为置换反应 B、硫酸铜溶液所含阳离子只有Cu2+ C、可推知金属活动性顺序:铜>锌 D、若用银片代替锌粒,可观察到相似实验现象9. 大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是( )A、赤铁矿(主要成分是Fe2O3) B、炉甘石(主要成分是ZnCO3) C、铝土矿(主要成分是Al2O3) D、赤铜矿(主要成分是Cu2O)10. 某金属混合物由Mg、Al、Zn、Cu四种金属中的两种组成。6.5g该金属混合物与足量的盐酸反应,可得到0.2g氢气,则该金属混合物中一定不含有的金属是( )A、Mg B、Al C、Zn D、Cu11. 人类从石器时代进入青铜器时代,继而进入铁器时代,都是以金属材料的使用作为标志的。下列说法正确的是( )A、铝制品在常温下有良好的抗腐蚀性 B、纯铜比铜合金更适合用于制作耐磨齿轮 C、铁锅清洗后未擦干的水可隔绝空气减缓锈蚀 D、含铅、汞等重金属的废旧电池不可回收利用12. 合金的应用和发展印证了人类文明的进步。下列有关合金的说法错误的是( )A、人类生产和使用铁器早于青铜器 B、生铁和钢是铁、碳等元素形成的合金 C、不锈钢属于金属材料 D、合金拓宽了金属材料的应用范围
A、锌粒参加的反应均为置换反应 B、硫酸铜溶液所含阳离子只有Cu2+ C、可推知金属活动性顺序:铜>锌 D、若用银片代替锌粒,可观察到相似实验现象9. 大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是( )A、赤铁矿(主要成分是Fe2O3) B、炉甘石(主要成分是ZnCO3) C、铝土矿(主要成分是Al2O3) D、赤铜矿(主要成分是Cu2O)10. 某金属混合物由Mg、Al、Zn、Cu四种金属中的两种组成。6.5g该金属混合物与足量的盐酸反应,可得到0.2g氢气,则该金属混合物中一定不含有的金属是( )A、Mg B、Al C、Zn D、Cu11. 人类从石器时代进入青铜器时代,继而进入铁器时代,都是以金属材料的使用作为标志的。下列说法正确的是( )A、铝制品在常温下有良好的抗腐蚀性 B、纯铜比铜合金更适合用于制作耐磨齿轮 C、铁锅清洗后未擦干的水可隔绝空气减缓锈蚀 D、含铅、汞等重金属的废旧电池不可回收利用12. 合金的应用和发展印证了人类文明的进步。下列有关合金的说法错误的是( )A、人类生产和使用铁器早于青铜器 B、生铁和钢是铁、碳等元素形成的合金 C、不锈钢属于金属材料 D、合金拓宽了金属材料的应用范围二、多选题
-
13. 把200g一定溶质质量分数的稀盐酸平均分成两份,分别加入两个相同的烧杯中,放在已调平的天平左右两盘上,此时天平平衡,然后在左盘烧杯中加入5.6g铁粉。下列有关说法正确的是( )A、若在右盘烧杯中加入5.6g锌粉,反应停止后,天平可能平衡 B、若在右盘烧杯中加入5.6g黄铜粉,反应停止后,天平不可能平衡 C、在右盘烧杯中加入5.6g镁粉,反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3% D、在右盘烧杯中加入5.6g铝粉,反应停止后,若天平不平衡,则左、右两盘烧杯中金属一定都无剩余
三、科普阅读题
-
14. 阅读下列材料。
镁在自然界中分布广泛,存在于光卤石(主要成分KCl·MgCl2·6H2O)、菱镁矿(主要成MgCO3)、白云石【主要成分CaMg(CO3)2】等矿石中,海水中也含镁盐。工亚上电解熔融MgCl2制取金属镁。镁化学性质比较活泼,与CO2或水都能反应,当镁等活泼金属着火时,不能使用CO2或水扑救,可以用沙土灭火。
镁合金被称作21世纪的绿色工程材料,在增强交通工具的架构强度、减轻质量、节药能源、抗冲击与振动等方面具有优势,已大量应用于自行车组件的制造。
镁元素对人体健康有着重要作用,通过对心脏的调节,使心脏的节律和兴奋传导减弱,从而有利于心脏的舒张,还可以保护心血管、防止经脉硬化。人体缺镁可能会出现眩晕、出汗过多、记记力下降等症状。
回答下列问题:
(1)、下列矿物的主要成分不含镁元素的是____(填标号)。A、菱镁矿 B、白云石 C、光卤石 D、赤铁矿(2)、镁在CO2中燃烧生成氧化镁和一种黑色单质,该反应的化学方程式为。(3)、镁合金在增强交通工具的架构强度、、节约能源、抗冲击与振动等方面具有优势,可用于制造自行车组件。(4)、人体缺镁可能会出现____(填标号)等症状。A、眩晕 B、水保病 C、出汗过多 D、记忆力下降(5)、向镁和铁的混合物ag中加入足量稀硫酸,产生0.2g氢气,侧a的取值范围是。(6)、小智同学进行金属与盐反应的实验(如图试管1、试管2所示),待反应停止后将所得混合物倒入同一洁净的烧杯中,充分混合后分离得到滤渣m和滤液n,下列说法正确的是____(填标号)。 A、若滤液为无色,则滤渣m组成情况可能有4种 B、若滤渣m中有红色固体,则滤液n中无法确定的金属离子有两种 C、若试管1和试管2中溶液均为无色,滤液n为蓝色,则可判断出Mg、Zn、Cu、Ag的活动性 D、试管1和试管2中的反应停止后,所得固体质量之和一定不大于滤渣m的质量
A、若滤液为无色,则滤渣m组成情况可能有4种 B、若滤渣m中有红色固体,则滤液n中无法确定的金属离子有两种 C、若试管1和试管2中溶液均为无色,滤液n为蓝色,则可判断出Mg、Zn、Cu、Ag的活动性 D、试管1和试管2中的反应停止后,所得固体质量之和一定不大于滤渣m的质量四、简答题
-
15. 金属用途广泛,金属的用途与其性质密切相关。(1)、如图中将两块金属片相互刻画,该实验的目的是什么?
 (2)、某同学在Cu(NO3)2和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,发现滤液仍呈蓝色。分析滤液中溶质的成分,并写出Zn与AgNO3溶液反应的化学方程式。
(2)、某同学在Cu(NO3)2和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,发现滤液仍呈蓝色。分析滤液中溶质的成分,并写出Zn与AgNO3溶液反应的化学方程式。五、综合题
-
16. 早在春秋战国时期,我国就开始生产和使用铁器。(1)、用赤铁矿(主要成分是Fe2O3)和一氧化碳炼铁的化学方程式为。(2)、常见的铁合金有和钢。医疗器械用不锈钢制而不用纯铁制是因为不锈钢具有、的性质。(3)、铁制品锈蚀会造成金属资源的浪费,防止铁锈蚀可采用的方法之一是;为了保护金属资源,除防止金属的腐蚀外,还可以采取的措施有(写一条)。17. 用下图所示实验研究金属的性质。
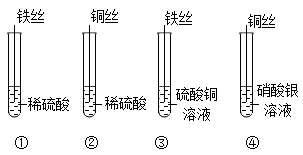 (1)、①中有气体生成,生成的气体为。(2)、③中反应的化学方程式为。(3)、下列实验组合中,能得出铁、铜、银的金属活动性顺序的是____(填序号)。A、①④ B、③④ C、①②④18. 硼(B)是制造火箭耐热合金的原料。镁还原法生产硼的主要工艺流程如下图。
(1)、①中有气体生成,生成的气体为。(2)、③中反应的化学方程式为。(3)、下列实验组合中,能得出铁、铜、银的金属活动性顺序的是____(填序号)。A、①④ B、③④ C、①②④18. 硼(B)是制造火箭耐热合金的原料。镁还原法生产硼的主要工艺流程如下图。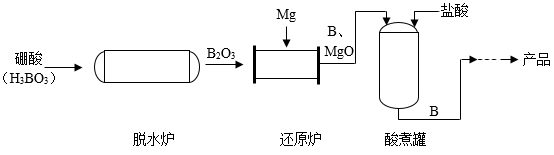 (1)、脱水炉中,硼酸发生分解反应,配平该反应的化学方程式H3BO3B2O3+H2O:。(2)、还原炉中,发生反应的基本反应类型为。(3)、酸煮罐中,加入盐酸的目的是。19. 化学使世界变得绚丽多彩。请回答:(1)、高铁电网通过石墨电刷给动车供电,因为石墨具有良好的 性。(2)、煤、石油和天然气都是 (填“可再生”或“不可再生”)能源。(3)、合理施用化肥有利于粮食增产,让“中国人的饭碗端在中国人手中”。下列可以作为复合肥的是____(填标号)。A、KCl B、NH4H2PO4 C、CO(NH2)2(4)、北京冬奥会的吉祥物“冰墩墩”的冰晶外壳由塑料制成,塑料属于____(填标号)。A、金属材料 B、天然材料 C、合成材料20. 神舟十三号载人飞行任务的顺利完成,彰显了中国航天的力量。在航天领域中使用了大量金属材料。(1)、新型镁锂合金用于制造火星车的车结构,体现了镁锂合金具有密度小、耐腐蚀、的优良性能。生铁和钢是常见的两种铁合金,其主要区别是。(2)、铝制品具有很好的抗腐蚀性能,原因(用化学方程式表示)。(3)、为了防止铁制品生锈,常在其表面喷漆或镀一层金属,其防锈原理是。(4)、向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到蓝色滤液。则滤液中一定含有的溶质是。21. 2022年6月5日10时44分07秒,神舟十四号载人飞船成功发射。人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,镍(Ni)元素在化合物中常见的化合价为+2价。(1)、请写出金属镍与稀硫酸发生置换反应的化学方程式;(2)、选择镍片和溶液,能比较出镍和铜的金属活动性顺序。22. 金属材料对于促进生产发展,改善人类生活发挥了重大作用,因此学习金属性质,根据性质合理使用金属就显得十分重要。请按要求回答下列有关金属性质的问题:(1)、铝具有很好的抗腐蚀性能原因是。(2)、向含有硝酸铜、硝酸银和硝酸锌的混合溶液中,加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣。滤液中一定含有的溶质是 , 滤渣中一定含有的物质是。23. 对于金属材料,我们应从多角度了解。(1)、金属的性质
(1)、脱水炉中,硼酸发生分解反应,配平该反应的化学方程式H3BO3B2O3+H2O:。(2)、还原炉中,发生反应的基本反应类型为。(3)、酸煮罐中,加入盐酸的目的是。19. 化学使世界变得绚丽多彩。请回答:(1)、高铁电网通过石墨电刷给动车供电,因为石墨具有良好的 性。(2)、煤、石油和天然气都是 (填“可再生”或“不可再生”)能源。(3)、合理施用化肥有利于粮食增产,让“中国人的饭碗端在中国人手中”。下列可以作为复合肥的是____(填标号)。A、KCl B、NH4H2PO4 C、CO(NH2)2(4)、北京冬奥会的吉祥物“冰墩墩”的冰晶外壳由塑料制成,塑料属于____(填标号)。A、金属材料 B、天然材料 C、合成材料20. 神舟十三号载人飞行任务的顺利完成,彰显了中国航天的力量。在航天领域中使用了大量金属材料。(1)、新型镁锂合金用于制造火星车的车结构,体现了镁锂合金具有密度小、耐腐蚀、的优良性能。生铁和钢是常见的两种铁合金,其主要区别是。(2)、铝制品具有很好的抗腐蚀性能,原因(用化学方程式表示)。(3)、为了防止铁制品生锈,常在其表面喷漆或镀一层金属,其防锈原理是。(4)、向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到蓝色滤液。则滤液中一定含有的溶质是。21. 2022年6月5日10时44分07秒,神舟十四号载人飞船成功发射。人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,镍(Ni)元素在化合物中常见的化合价为+2价。(1)、请写出金属镍与稀硫酸发生置换反应的化学方程式;(2)、选择镍片和溶液,能比较出镍和铜的金属活动性顺序。22. 金属材料对于促进生产发展,改善人类生活发挥了重大作用,因此学习金属性质,根据性质合理使用金属就显得十分重要。请按要求回答下列有关金属性质的问题:(1)、铝具有很好的抗腐蚀性能原因是。(2)、向含有硝酸铜、硝酸银和硝酸锌的混合溶液中,加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣。滤液中一定含有的溶质是 , 滤渣中一定含有的物质是。23. 对于金属材料,我们应从多角度了解。(1)、金属的性质①在常温下,铝能与氧气反应,该反应的化学方程式为。
②将铝丝浸入硫酸镁和硫酸铜的混合溶液中,过一会儿取出,观察到铝丝表面有固体析出,溶液呈蓝色。此时溶液中含有(填数字)种溶质。
(2)、金属的冶炼在高温条件下,利用一氧化碳将铁从赤铁矿石(主要成分为氧化铁)里还原出来,该反应的化学方程式为。
(3)、金属材料的应用铁制品应用广泛,作医疗器械时,通常使用不锈钢而不用纯铁,主要是因为两者相比,不锈钢具有(答一点)的性能。
(4)、金属资源的保护下列保护金属资源的做法正确的是____(填字母)。
A、寻找金属代用品 B、任意开采金属矿物 C、回收利用废旧金属24. 下图是炼铁高炉内部的物料说明和一套工业炼铁设备模型。请分析回答问题: (1)、高炉炼铁的原理是(用化学方程式表示)。(2)、高炉炼铁得到的产品是生铁,生铁和钢都是铁的合金,性能不同是因为。(3)、如图副产品中的又回到了高炉,副产品综合利用的好处是。25. 锰元素能形成MnO、MnO2、Mn2O3和Mn3O4等多种氧化物,其中Mn3O4是重要的结构材料。工业用硫酸锰(MnSO4)制备Mn3O4的流程如下:
(1)、高炉炼铁的原理是(用化学方程式表示)。(2)、高炉炼铁得到的产品是生铁,生铁和钢都是铁的合金,性能不同是因为。(3)、如图副产品中的又回到了高炉,副产品综合利用的好处是。25. 锰元素能形成MnO、MnO2、Mn2O3和Mn3O4等多种氧化物,其中Mn3O4是重要的结构材料。工业用硫酸锰(MnSO4)制备Mn3O4的流程如下: (1)、“沉淀”反应是。该反应的基本类型为。(2)、写出“过滤”所得滤液的一种用途:。(3)、将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是。(4)、“氧化”时,Mn(OH)2与空气中的氧气在60℃条件下反应生成Mn3O4 , 该反应的化学方程式为。(5)、通过测定固体产物中锰元素质量分数来推断产物成分。“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
(1)、“沉淀”反应是。该反应的基本类型为。(2)、写出“过滤”所得滤液的一种用途:。(3)、将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是。(4)、“氧化”时,Mn(OH)2与空气中的氧气在60℃条件下反应生成Mn3O4 , 该反应的化学方程式为。(5)、通过测定固体产物中锰元素质量分数来推断产物成分。“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
①通空气8小时左右,所得固体几乎全部为Mn3O4.推出该结论的依据是。
②通空气超过8小时,产物中锰元素质量分数减小的原因是。
26. 金属及金属材料在生产、生活中应用广泛。(1)、铝具有很好的抗腐蚀性,是因为其表面生成一层致密的薄膜,该薄膜是(填化学式)。(2)、向一定质量的氧化铜中加入一定量稀硫酸使其完全溶解,得到蓝色溶液。再加入铁粉充分反应,过滤,得到滤渣和滤液。向滤渣中加入稀硫酸,有气泡冒出,则滤液中的溶质是(填化学式)。(3)、早在春秋战国时期,我国就开始生产和使用铁器。炼铁原理是利用一氧化碳与氧化铁在高温条件下反应,该反应的化学方程式为。现将某铁合金(只含铁和碳)8.7 g 放入盛有 100 g 稀盐酸的烧杯中,恰好完全反应,得到 108.1 g 溶液,则该样品中碳的质量分数为(结果精确到 0.1%)。该铁合金属于(填“钢”或“生铁”)。27. 日常生活用品很多是由金属材料制成的。(1)、三星堆出土的文物使用了贴金技艺,贴金技艺利用了金具有良好的性,将黄金锤成极薄的薄片。(2)、铝的化学性质很活泼,通常铝制品却很耐腐蚀,原因是(用化学方程式表示)。(3)、春秋战国时期,我国就开始生产和使用铁器。古法炼铁的原理包含一氧化碳与氧化铁在高温下反应,反应的化学方程式是。(4)、将一定质量的锌粒投入到含有CuSO4和FeSO4的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则滤渣中一定含有。28. 丰富多彩的中华文物铭刻着中华文化的脉络、记录着中华文明的传承。(1)、认识文物:青铜是铜与锡的合金。青铜硬度(填“大于”或“小于”)钝铜。(2)、文物锈蚀:汉代铁剪锈透斑斑(如图所示),其锈蚀是铁与空气中的发生化学反应的结果。 (3)、文物修复:含六偏磷酸钠【化学式为(NaPO3)6】的敷贴可使青铜器表面附着的土壤硬结物软化清除,该物质中磷元素的化合价为。去除文物上铁锈的步骤之一是将铁锈的主要成分(Fe2O3)用氢气在一定温度下还原成氧化亚铁,该反应的化学方程式为。
(3)、文物修复:含六偏磷酸钠【化学式为(NaPO3)6】的敷贴可使青铜器表面附着的土壤硬结物软化清除,该物质中磷元素的化合价为。去除文物上铁锈的步骤之一是将铁锈的主要成分(Fe2O3)用氢气在一定温度下还原成氧化亚铁,该反应的化学方程式为。六、推断题
-
29. A一F是初中化学常见的物质,它们之间的相互转化关系如下图所示(部分产物已略去)已知A是一种黑色的氧化物,B、C、D均为单质,B是目前世界上年产量最高的金属,C是密度最小的气体,F的水溶液在农业上常用来配制波尔多液。
 (1)、A物质的化学式为 , E溶液中一定存在的阳离子(填离子符号)。(2)、列举D物质的一条用途。(3)、写出反应③的化学方程式 , 其基本反应类型为。30. A-H 是初中化学中常见的物质。A-E 分别为五种不同类别的物质。A、B、C 中含有相同的金属元素,A 是黑色固体,B 的溶液为蓝色,可与石灰乳配制农药波尔多液。E 是目前世界上年产量最高的金属。G 是生活中最常见的液体物质。图中“—”表示相连两物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物以及反应条件已省略)。请回答:
(1)、A物质的化学式为 , E溶液中一定存在的阳离子(填离子符号)。(2)、列举D物质的一条用途。(3)、写出反应③的化学方程式 , 其基本反应类型为。30. A-H 是初中化学中常见的物质。A-E 分别为五种不同类别的物质。A、B、C 中含有相同的金属元素,A 是黑色固体,B 的溶液为蓝色,可与石灰乳配制农药波尔多液。E 是目前世界上年产量最高的金属。G 是生活中最常见的液体物质。图中“—”表示相连两物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物以及反应条件已省略)。请回答: (1)、C 的化学式;H 的固体俗称为 , H 的用途(举一个);(2)、②反应的化学方程式为 , 基本反应类型是反应。(3)、汽水中存在反应③,汽水能使紫色石蕊溶液变为。31. 某食品包装袋中脱氧剂的成分可能含有铁粉、碳粉、碳酸钠、氯化钠、氧化铁中的几种,兴趣小组为确定其成分,进行如下实验。
(1)、C 的化学式;H 的固体俗称为 , H 的用途(举一个);(2)、②反应的化学方程式为 , 基本反应类型是反应。(3)、汽水中存在反应③,汽水能使紫色石蕊溶液变为。31. 某食品包装袋中脱氧剂的成分可能含有铁粉、碳粉、碳酸钠、氯化钠、氧化铁中的几种,兴趣小组为确定其成分,进行如下实验。
回答下列问题:
(1)、固体A的化学式为。(2)、操作I的名称是。(3)、黄色溶液b中一定存在的阳离子是(填离子符号)。(4)、综合分析该脱氧剂中一定含有的成分是。(5)、为验证该脱氧剂中还未确定的物质是否存在,应采用的实验方案是(写出实验操作、现象及结论)。32. 今年北京冬奥会的成功举办,让我们领略了无穷的冰雪魅力,如图“雪花”顶角上的A、B、C、D、E、F是初中化学常见的六种物质。其中D是金属单质,A、C是氧化物,A是黑色固体,C是气体;B、E、F依次是酸、碱、盐,B的浓溶液能夺取纸张里的水分,生成黑色的炭,E俗称熟石灰,F的溶液呈蓝色(图中“一”表示物质间能相互发生反应,“→”表示物质间能发生转化)。请写出你的推断: (1)、A的化学式为 。(2)、D、F发生的反应属于基本反应类型中的 反应。(3)、B、E发生反应的化学方程式为 。33. 已知A、B、C、D、E为初中化学中常见的五种不同类别的物质,B为红棕色粉末,C由两种元素组成,D广泛应用于治金、造纸、纺织、印染和洗涤剂生产等领域,五种物质的转化关系如图所示(“-”表示相连的两种物质能发生反应,“→”表示相连物质能向箭头所指一方转化)。部分反应物、生成物及反应条件已省略。请回答下列问题:
(1)、A的化学式为 。(2)、D、F发生的反应属于基本反应类型中的 反应。(3)、B、E发生反应的化学方程式为 。33. 已知A、B、C、D、E为初中化学中常见的五种不同类别的物质,B为红棕色粉末,C由两种元素组成,D广泛应用于治金、造纸、纺织、印染和洗涤剂生产等领域,五种物质的转化关系如图所示(“-”表示相连的两种物质能发生反应,“→”表示相连物质能向箭头所指一方转化)。部分反应物、生成物及反应条件已省略。请回答下列问题: (1)、B物质的化学式为。(2)、A和C反应的化学方程式为。(3)、C和E反应的实质为。
(1)、B物质的化学式为。(2)、A和C反应的化学方程式为。(3)、C和E反应的实质为。七、计算题
-
34. 硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。在实验室里,模拟工业上制取硫酸亚铁的原理,向5.6g铁屑中加入100g稀硫酸,二者恰好完全反应。请计算:(1)、生成硫酸亚铁的质量为g。(2)、所用稀硫酸中溶质的质量分数。35. 小明同学用某铁粉样品(杂质不溶于水,也不与酸反应)进行了如图所示实验,请回答下列问题:
 (1)、样品中铁的质量是g。(2)、本实验最终所得不饱和溶液的溶质质量分数是多少?36. 实验室有一包铁粉和铜粉的混合物,现取该混合物10g于烧杯中,进行如下实验。请根据图中实验过程及数据进行计算。
(1)、样品中铁的质量是g。(2)、本实验最终所得不饱和溶液的溶质质量分数是多少?36. 实验室有一包铁粉和铜粉的混合物,现取该混合物10g于烧杯中,进行如下实验。请根据图中实验过程及数据进行计算。 (1)、混合物中铁粉的质量为。(2)、计算稀硫酸中溶质的质量分数。(写出计算过程)37. 为了测定某含杂质7%的黄铜样品中铜的质量分数(主要成分是铜和锌,杂质不溶于水,不与其他物质反应,受热也不分解),某化学小组进行了如下实验:
(1)、混合物中铁粉的质量为。(2)、计算稀硫酸中溶质的质量分数。(写出计算过程)37. 为了测定某含杂质7%的黄铜样品中铜的质量分数(主要成分是铜和锌,杂质不溶于水,不与其他物质反应,受热也不分解),某化学小组进行了如下实验: (1)、该黄铜样品中铜的质量分数为?(2)、向过滤后所得滤液中加入87.4g水,计算最终所得溶液中溶质的质量分数。38. 往盛有4.0g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图所示。请回答下列问题并计算:
(1)、该黄铜样品中铜的质量分数为?(2)、向过滤后所得滤液中加入87.4g水,计算最终所得溶液中溶质的质量分数。38. 往盛有4.0g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图所示。请回答下列问题并计算: (1)、充分反应后,产生氢气的质量是。(2)、刚开始滴加稀盐酸时,没有氢气放出的原因是。(3)、该铝片中铝的质量分数(写出计算过程)。39. 黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。某学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25g放入烧杯中,再将160g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下。
(1)、充分反应后,产生氢气的质量是。(2)、刚开始滴加稀盐酸时,没有氢气放出的原因是。(3)、该铝片中铝的质量分数(写出计算过程)。39. 黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。某学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25g放入烧杯中,再将160g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下。加入次数
第1次
第2次
第3次
第4次
加入稀硫酸的质量/g
40
40
40
40
充分反应后剩余固体的质量/g
18.5
12
10
m
请根据实验数据完成下列问题:
(1)、m的值为。(2)、黄铜样品中铜的质量分数为。(3)、所用稀硫酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
-
-
-