2022年化学中考真题汇编:溶解度
试卷更新日期:2022-08-10 类型:二轮复习
一、单选题
-
1. 我国航天员王亚平在太空演示“冰雪”实验时用到了过饱和醋酸钠溶液。如图是醋酸钠的溶解度曲线,下列说法正确的是( )
 A、常温下,醋酸钠属于微溶物质 B、图中P点所表示的醋酸钠溶液是不饱和的 C、40℃时,饱和醋酸钠溶液的溶质质量分数是65.6% D、将A点的饱和溶液降温至20℃,溶质质量分数增大2. 下图是硝酸钾和氯化钾的溶解度曲线,下列说法错误的是( )
A、常温下,醋酸钠属于微溶物质 B、图中P点所表示的醋酸钠溶液是不饱和的 C、40℃时,饱和醋酸钠溶液的溶质质量分数是65.6% D、将A点的饱和溶液降温至20℃,溶质质量分数增大2. 下图是硝酸钾和氯化钾的溶解度曲线,下列说法错误的是( )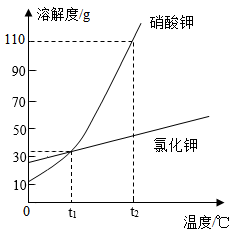 A、氯化钾的溶解度随温度的升高而增大 B、t1℃时,硝酸钾和氯化钾的溶解度相等 C、将t1℃时的硝酸钾饱和溶液升温至t2℃,溶质质量不变 D、t2℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:213. “侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是:。如图是三种物质的溶解度曲线,下列叙述正确的是( )
A、氯化钾的溶解度随温度的升高而增大 B、t1℃时,硝酸钾和氯化钾的溶解度相等 C、将t1℃时的硝酸钾饱和溶液升温至t2℃,溶质质量不变 D、t2℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:213. “侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是:。如图是三种物质的溶解度曲线,下列叙述正确的是( ) A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、NH4Cl中含有少量NaCl,可用降温结晶的方法提纯NH4Cl C、20℃时,NaHCO3饱和溶液的溶质质量分数一定大于NH4Cl不饱和溶液的溶质质量分数 D、20℃时,将9.6gNaHCO3加入到90.4g水中,可得到100g饱和溶液4. 根据下图,判断下列说法正确的是( )A、
A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、NH4Cl中含有少量NaCl,可用降温结晶的方法提纯NH4Cl C、20℃时,NaHCO3饱和溶液的溶质质量分数一定大于NH4Cl不饱和溶液的溶质质量分数 D、20℃时,将9.6gNaHCO3加入到90.4g水中,可得到100g饱和溶液4. 根据下图,判断下列说法正确的是( )A、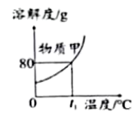 t1℃时,50g甲能完全溶于50g水
B、
t1℃时,50g甲能完全溶于50g水
B、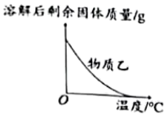 乙的溶解度随温度升高而降低
C、
乙的溶解度随温度升高而降低
C、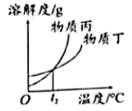 t2℃时,丙和丁的溶解度相同
D、
t2℃时,丙和丁的溶解度相同
D、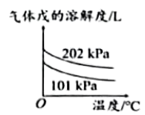 加压或升温能增加戊的溶解度
5. 甲、乙两种物质溶解度曲线如图所示。下列说法正确的是( )
加压或升温能增加戊的溶解度
5. 甲、乙两种物质溶解度曲线如图所示。下列说法正确的是( ) A、a1℃时,甲、乙的溶解度相同 B、甲的溶解度受温度影响比乙小 C、当甲中混有少量乙时,可采用蒸发的方法提纯甲 D、a2℃时,在100g水中加入30g甲,形成饱和溶液6. 下列说法正确的是( )A、气体的溶解度随着温度的升高而增大 B、稀释浓硫酸时将水缓慢加入浓硫酸中 C、不锈钢抗锈蚀性能比纯铁好 D、含黄曲霉素的食物煮熟后可以放心食用7. 甲、乙两种物质的溶解度曲线如图所示,下列说法中正确的是( )
A、a1℃时,甲、乙的溶解度相同 B、甲的溶解度受温度影响比乙小 C、当甲中混有少量乙时,可采用蒸发的方法提纯甲 D、a2℃时,在100g水中加入30g甲,形成饱和溶液6. 下列说法正确的是( )A、气体的溶解度随着温度的升高而增大 B、稀释浓硫酸时将水缓慢加入浓硫酸中 C、不锈钢抗锈蚀性能比纯铁好 D、含黄曲霉素的食物煮熟后可以放心食用7. 甲、乙两种物质的溶解度曲线如图所示,下列说法中正确的是( )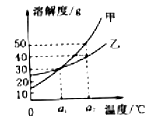 A、甲的溶解度一定大于乙的溶解度 B、升高温度可以将甲和乙的饱和溶液转化为不饱和溶液 C、α2℃时甲的饱和溶液中溶质和溶剂的质量比为1:3 D、α2℃时相同质量的甲和乙溶液,降温至α1℃时甲溶液析出的晶体一定比乙溶液多8. 固体甲、乙、丙在不同温度下的溶解度如下表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )
A、甲的溶解度一定大于乙的溶解度 B、升高温度可以将甲和乙的饱和溶液转化为不饱和溶液 C、α2℃时甲的饱和溶液中溶质和溶剂的质量比为1:3 D、α2℃时相同质量的甲和乙溶液,降温至α1℃时甲溶液析出的晶体一定比乙溶液多8. 固体甲、乙、丙在不同温度下的溶解度如下表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )温度/℃
0
20
40
60
80
溶解度/g
甲
0.18
0.16
0.14
0.12
0.09
乙
35.7
36.0
36.6
37.3
38.4
丙
13.3
31.6
63.9
110
169
A、固体甲的溶解度随温度的升高而增大 B、20℃时,丙溶液中溶质和溶剂质量比为31.6:100 C、分别将等质量的乙、丙饱和溶液由60℃降温到20℃,溶质质量大小:丙>乙 D、分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶剂质量大小:甲>丙9. 尿素[CO(NH2)2]在农业生产中的使用量较大,它在土壤中的转化和吸收过程模拟如下,土壤中两种物质的溶解度曲线如图Ⅳ、分析下图信息,所得结论正确的是( )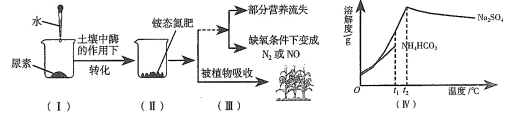 A、(Ⅰ)中氮元素可直接被植物吸收 B、(Ⅱ)生成的铵态氮肥一定含NH4Cl C、(Ⅲ)暴雨会使铵态氮肥营养流失 D、(Ⅳ)降温结晶可使两种物质分离10. 碳酸钠的溶解度曲线如图所示。下列说法正确的是( )
A、(Ⅰ)中氮元素可直接被植物吸收 B、(Ⅱ)生成的铵态氮肥一定含NH4Cl C、(Ⅲ)暴雨会使铵态氮肥营养流失 D、(Ⅳ)降温结晶可使两种物质分离10. 碳酸钠的溶解度曲线如图所示。下列说法正确的是( ) A、碳酸钠的溶解度随温度升高而增大 B、将20℃的碳酸钠饱和溶液升温至30℃,溶质质量分数不变 C、30℃时,将25g碳酸钠加入50g水中,所得溶液质量为75g D、40℃时,碳酸钠饱和溶液的溶质质量分数为50%11. 尿素【CO(NH2)2】在农业生产中的使用量较大,它在土壤中的转化和吸收过程模拟如下,土壤中两种物质的溶解度曲线如图Ⅳ。分析下图信息,所得结论正确的是( )
A、碳酸钠的溶解度随温度升高而增大 B、将20℃的碳酸钠饱和溶液升温至30℃,溶质质量分数不变 C、30℃时,将25g碳酸钠加入50g水中,所得溶液质量为75g D、40℃时,碳酸钠饱和溶液的溶质质量分数为50%11. 尿素【CO(NH2)2】在农业生产中的使用量较大,它在土壤中的转化和吸收过程模拟如下,土壤中两种物质的溶解度曲线如图Ⅳ。分析下图信息,所得结论正确的是( ) A、(Ⅰ)中氮元素可直接被植物吸收 B、(Ⅱ)生成的铵态氮肥一定含NH4Cl C、(Ⅲ)碱性土壤使铵态氮肥营养流失 D、(Ⅳ)降温结晶可使两种物质分离12. 氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法错误的是( )
A、(Ⅰ)中氮元素可直接被植物吸收 B、(Ⅱ)生成的铵态氮肥一定含NH4Cl C、(Ⅲ)碱性土壤使铵态氮肥营养流失 D、(Ⅳ)降温结晶可使两种物质分离12. 氯化铵常用作铁制品的除锈剂。不同温度时,氢化铵固体的溶解度曲线如图所示。20℃时,将50g氯化铵固体加入到盛有100g水的烧杯中,搅拌使其充分溶解。下列说法错误的是( ) A、烧杯中剩余固体的质量为13g B、再加入100g水,充分溶解后烧杯中仍有固体剩余 C、升温至40℃,溶液的质量分数约为31.5% D、升温至60℃,溶液变为不饱和溶液13. KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )
A、烧杯中剩余固体的质量为13g B、再加入100g水,充分溶解后烧杯中仍有固体剩余 C、升温至40℃,溶液的质量分数约为31.5% D、升温至60℃,溶液变为不饱和溶液13. KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )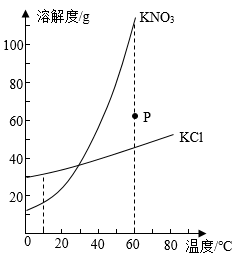 A、10℃时,KNO3的溶解度比KCl大 B、KCl的溶解度受温度影响的程度比KNO3大 C、60℃时,P点表示的KNO3溶液还能继续溶解KNO3固体 D、将60℃的KCl饱和溶液降温至10℃,溶液中溶质质量分数不变14. t1℃时,将相同质量的KNO3和KCl分别加入盛有100g水的甲、乙烧杯中,充分搅拌后现象如图I所示,图Ⅱ为两物质的溶解度曲线。以下说法正确的是( )
A、10℃时,KNO3的溶解度比KCl大 B、KCl的溶解度受温度影响的程度比KNO3大 C、60℃时,P点表示的KNO3溶液还能继续溶解KNO3固体 D、将60℃的KCl饱和溶液降温至10℃,溶液中溶质质量分数不变14. t1℃时,将相同质量的KNO3和KCl分别加入盛有100g水的甲、乙烧杯中,充分搅拌后现象如图I所示,图Ⅱ为两物质的溶解度曲线。以下说法正确的是( ) A、甲烧杯中的溶质为KNO3 B、将温度升高到t2℃时,乙烧杯中仍然有固体剩余 C、若KNO3中混有少量KCl,可采用蒸发结晶的方法提纯KNO3 D、若取t3℃时KNO3和KCl的饱和溶液各100g,降温至t2℃时,析出晶体较多的是KNO315. 已知:温度超过35℃时,NH4HCO3开始分解,其溶解度表如下。下列说法正确的是( )
A、甲烧杯中的溶质为KNO3 B、将温度升高到t2℃时,乙烧杯中仍然有固体剩余 C、若KNO3中混有少量KCl,可采用蒸发结晶的方法提纯KNO3 D、若取t3℃时KNO3和KCl的饱和溶液各100g,降温至t2℃时,析出晶体较多的是KNO315. 已知:温度超过35℃时,NH4HCO3开始分解,其溶解度表如下。下列说法正确的是( )温度/℃
0
10
20
30
NH4HCO3溶解度(g/100g水)
11.9
15.8
21.0
27.0
A、用NH4HCO3晶体配制浓溶液时,可加热煮沸以加快溶解 B、NH4HCO3是铵态复合肥料,与其它肥料都可以混合使用 C、20℃时,50.0g蒸馏水就能使11.0g NH4HCO3晶体完全溶解 D、127.0g NH4HCO3饱和溶液,由30℃降至20℃可析出6.0g晶体16. 甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是( )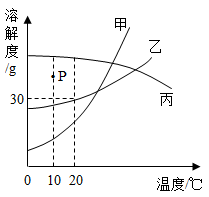 A、图中P点表示10℃时丙的饱和溶液 B、10℃时,甲、乙、丙三种物质的溶解度,甲的溶解度最大 C、20℃时,甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多 D、20℃时,向130g乙的饱和溶液中加入20g水,所得溶液的溶质质量分数变为20%17. 为探究硝酸钾的溶解性,进行了下图所示实验(实验过程)
A、图中P点表示10℃时丙的饱和溶液 B、10℃时,甲、乙、丙三种物质的溶解度,甲的溶解度最大 C、20℃时,甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多 D、20℃时,向130g乙的饱和溶液中加入20g水,所得溶液的溶质质量分数变为20%17. 为探究硝酸钾的溶解性,进行了下图所示实验(实验过程)
结合硝酸钾在不同温度下的溶解度,判断下列说法错误的是( )
温度/℃
10
20
30
40
50
60
KNO3溶解度/g
20.9
31.6
45.8
63.9
85.5
110.0
A、①③中的溶液均为不饱和溶液 B、②③中溶液的质量:③>② C、②③④中溶液的溶质质量分数:③>②>④ D、④中析出晶体的质量是0.9g18. 下列关于溶解度图像分析(不考滤结晶水合物)正确的是( ) A、高于t1℃时甲溶液溶质质量分数一定更大 B、降温是将a处的甲溶液变饱和的唯一方法 C、t1℃时50g乙投入水中一定能完全溶解 D、t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大19. 根据图示实验和溶解度表,下列说法正确的是( )
A、高于t1℃时甲溶液溶质质量分数一定更大 B、降温是将a处的甲溶液变饱和的唯一方法 C、t1℃时50g乙投入水中一定能完全溶解 D、t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大19. 根据图示实验和溶解度表,下列说法正确的是( )
温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
KNO3
13.3
31.6
63.9
110
169
A、若a是NaCl,则③中的溶液是不饱和溶液 B、若a是NaCl,则④中溶质的质量分数约为27.2% C、若a是KNO3 , 则③到④溶液由不饱和转化为饱和 D、实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关20. KCl和KNO3的溶解度(见下表)和溶解度曲线(见图)。下列说法正确的是( )温度/℃
0
10
20
30
40
50
60
溶解度/g
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
KCl
27.6
31.0
34.0
37.0
40.0
42.6
45.5
 A、曲线甲代表KCl的溶解度曲线 B、40℃时KNO3饱和溶液中KNO3的质量分数为63.9% C、t1的值在20~30之间 D、将t1℃时甲和乙的饱和溶液升温至t2℃时,溶液中溶质的质量分数:甲>乙21. 下列图像与描述不相符的个数有( )
A、曲线甲代表KCl的溶解度曲线 B、40℃时KNO3饱和溶液中KNO3的质量分数为63.9% C、t1的值在20~30之间 D、将t1℃时甲和乙的饱和溶液升温至t2℃时,溶液中溶质的质量分数:甲>乙21. 下列图像与描述不相符的个数有( )图像
描述

向盛有HCl和BaCl2的混合溶液中,逐滴滴入一定溶质质量分数的NaOH溶液至过量

1g硫和1g氧气在密闭容器中充分反应

NaOH和NaCl固体分别溶于室温下足量的水中

向氢氧化钙的饱和溶液中加入一定量的氧化钙固体
A、1个 B、2个 C、3个 D、4个二、多选题
-
22. 如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
 A、t2℃时甲的饱和溶液中溶质和溶剂的质量比为 1:2 B、t1℃时,等质量的甲、乙饱和溶液中,溶质的质量一定相等 C、加溶剂可将 b 点的乙溶液转变成 a 点的乙溶液 D、t1时,分别将甲、乙两种物质的饱和溶液升温至 t2时,它们的溶解度和溶质的质量分数都增大23. 甲、乙两个烧杯中各盛有100.0g水,T2℃时,分别加入质量均为ag的KNO3或KCl固体,充分溶解后,甲烧杯中现象如图1所示,再将两个烧杯同时降温至T1℃、乙烧杯中现象如图2所示。
A、t2℃时甲的饱和溶液中溶质和溶剂的质量比为 1:2 B、t1℃时,等质量的甲、乙饱和溶液中,溶质的质量一定相等 C、加溶剂可将 b 点的乙溶液转变成 a 点的乙溶液 D、t1时,分别将甲、乙两种物质的饱和溶液升温至 t2时,它们的溶解度和溶质的质量分数都增大23. 甲、乙两个烧杯中各盛有100.0g水,T2℃时,分别加入质量均为ag的KNO3或KCl固体,充分溶解后,甲烧杯中现象如图1所示,再将两个烧杯同时降温至T1℃、乙烧杯中现象如图2所示。
KNO3和KCl在不同温度时的溶解度表
温度/℃
0
T1
20
T2
40
60
80
100
溶解度/g
KNO3
13.3
25.0
31.6
35.1
63.9
110
169
246
KCl
27.6
31.8
34.0
35.1
40.0
45.5
51.1
56.7
下列说法正确的是( )
A、乙烧杯中加入的固体一定是KNO3 B、图1中溶液可能是该溶质的饱和溶液,图2中上层清液一定是该溶质的饱和溶液 C、若从T1℃重新升高到T2℃,甲、乙两溶液中的溶质质量分数一定不相等 D、a的取值范围为31.8<a≤35.1三、选择填充题
-
24. 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
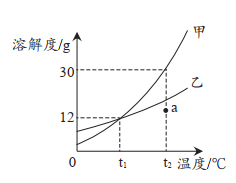
A.甲物质的溶解度大于乙物质的溶解度
B.t1℃时,100g甲、乙两种物质的溶液中所含溶质的质量相等
C.将a点的乙溶液转化为饱和溶液,溶质质量分数不一定改变
D.t2℃时,在50g水中加入20g甲物质所得溶液的质量为g
四、填空题
-
25. 如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
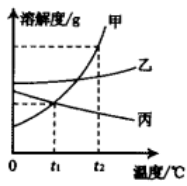
t1℃时甲、乙、丙溶解度最大的是 , 将该温度时三种物质的饱和溶液升温到t2℃(不考虑溶剂蒸发),有固体析出的是 , 此时所得溶液的溶质质量分数由大到小的顺序是。
五、综合题
-
26. 如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
 (1)、在℃时,a、c两种物质的溶解度相等。(2)、在t1℃时:向盛有30g a物质的烧杯中加入50g水。充分溶解后,所得溶液的质量为g。(3)、若a物质中混有少量b物质,最好采用(填“降温结晶”或“蒸发结晶”)的方法提纯a。(4)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶质质量由大到小的顺序为。27. 如图是氯化钾和硝酸钾的溶解度曲线。
(1)、在℃时,a、c两种物质的溶解度相等。(2)、在t1℃时:向盛有30g a物质的烧杯中加入50g水。充分溶解后,所得溶液的质量为g。(3)、若a物质中混有少量b物质,最好采用(填“降温结晶”或“蒸发结晶”)的方法提纯a。(4)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶质质量由大到小的顺序为。27. 如图是氯化钾和硝酸钾的溶解度曲线。 (1)、两种物质中,溶解度受温度影响较大的是。(2)、使氯化钾饱和溶液变成不饱和溶液,可采用的方法之一是。(3)、t℃时,硝酸钾饱和溶液中溶质和溶剂的质量比是。(4)、硝酸钾中含有少量氯化钾,提纯硝酸钾可采用的方法是。28. t1℃时,将等质量的硝酸钾和氯化钾分别加入到盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)、两种物质中,溶解度受温度影响较大的是。(2)、使氯化钾饱和溶液变成不饱和溶液,可采用的方法之一是。(3)、t℃时,硝酸钾饱和溶液中溶质和溶剂的质量比是。(4)、硝酸钾中含有少量氯化钾,提纯硝酸钾可采用的方法是。28. t1℃时,将等质量的硝酸钾和氯化钾分别加入到盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。 (1)、烧杯②中的上层清液属于溶液(填“饱和”或“不饱和”)。(2)、烧杯①中溶解的溶质是。(写化学式)(3)、将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水g。(4)、关于图中烧杯内的物质,下列说法正确的是____。A、烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数 B、蒸发一定量的水,两烧杯中都一定有固体析出 C、将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体 D、将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)29. 如图是甲、乙、丙三种固体物质的溶解度曲线图。请回答下列问题:
(1)、烧杯②中的上层清液属于溶液(填“饱和”或“不饱和”)。(2)、烧杯①中溶解的溶质是。(写化学式)(3)、将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水g。(4)、关于图中烧杯内的物质,下列说法正确的是____。A、烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数 B、蒸发一定量的水,两烧杯中都一定有固体析出 C、将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体 D、将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)29. 如图是甲、乙、丙三种固体物质的溶解度曲线图。请回答下列问题: (1)、℃时,甲、丙两种物质的溶解度相等;(2)、三种物质中,物质的溶解度随温度的升高而减小;(3)、t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是。30. 溶液有广泛的用途。请回答下列问题。(1)、【资料】两种物质在不同温度时的溶解度
(1)、℃时,甲、丙两种物质的溶解度相等;(2)、三种物质中,物质的溶解度随温度的升高而减小;(3)、t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是。30. 溶液有广泛的用途。请回答下列问题。(1)、【资料】两种物质在不同温度时的溶解度温度/℃
20
40
60
80
100
溶解度/g
KCl
34.0
40.0
45.5
51.1
56.7
KNO3
31.6
63.9
110
169
246
分析、比较表中的数据可知,溶解度受温度的影响较大的物质是。
(2)、40℃时,能否配制质量分数为35%的KCl溶液,原因是。(3)、为除去KNO3中混有的少量KCl,将固体样品加水溶解,然后加入适量的溶液,过滤、蒸发即可。也可以用的结晶方法。在实验中,常将固体样品配制成溶液进行化学反应的目的是。31. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。某同学在研究甲、乙(均不含结晶水)两种物质在水中的溶解度与温度的关系时,绘制了如下溶解度曲线,请回答下列问题: (1)、图中M点的含义是。(2)、t1℃时,把含有甲、乙物质各60g的混合物投入到100g水中,升温至t2℃时,充分搅拌,趁热过滤,得到的固体是。(选填“甲”或“乙”)(3)、t2℃时,一定质量甲物质的饱和密液,从t2℃降温至t1℃,析出30g甲,则该溶液中溶剂水的质量为。32. 利用溶解度曲线,可以获得许多有关物质溶解度的信息。下图是甲、乙、丙三种固体物质的溶解度曲线。请回答下列问题:
(1)、图中M点的含义是。(2)、t1℃时,把含有甲、乙物质各60g的混合物投入到100g水中,升温至t2℃时,充分搅拌,趁热过滤,得到的固体是。(选填“甲”或“乙”)(3)、t2℃时,一定质量甲物质的饱和密液,从t2℃降温至t1℃,析出30g甲,则该溶液中溶剂水的质量为。32. 利用溶解度曲线,可以获得许多有关物质溶解度的信息。下图是甲、乙、丙三种固体物质的溶解度曲线。请回答下列问题: (1)、t3℃时,取等质量的甲、乙、丙分别配成饱和溶液,所得溶液质量最多的是;(2)、若甲中混有少量的乙,提纯甲物质的步骤是:加水溶解、加热浓缩、、过滤、洗涤、;(3)、保持温度不变,将甲的不饱和溶液转化为饱和溶液的方法是;(4)、将t1℃时甲、乙、丙的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是。33. KCl和KNO3在不同温度下的溶解度如下表:
(1)、t3℃时,取等质量的甲、乙、丙分别配成饱和溶液,所得溶液质量最多的是;(2)、若甲中混有少量的乙,提纯甲物质的步骤是:加水溶解、加热浓缩、、过滤、洗涤、;(3)、保持温度不变,将甲的不饱和溶液转化为饱和溶液的方法是;(4)、将t1℃时甲、乙、丙的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是。33. KCl和KNO3在不同温度下的溶解度如下表:温度/℃
0
10
20
30
40
溶解度/g
KCl
27.6
31.0
34.0
37.0
40.0
KNO3
13.3
20.9
31.6
45.8
63.9
(1)、请在图中补充另一种物质的溶解度曲线。(2)、在图中标明两条曲线对应物质的名称。 (3)、KNO3中混有少量KCl,可用什么方法除去?请结合图解释其原因。34. a、b两种物质的溶解度曲线如图所示,请根据要求填空:
(3)、KNO3中混有少量KCl,可用什么方法除去?请结合图解释其原因。34. a、b两种物质的溶解度曲线如图所示,请根据要求填空: (1)、P点的含义。(2)、t2℃时,向50g水中加入40g固体a,形成溶液的质量为g。(3)、a中混有少量的b,提纯a的方法是。(4)、配置一定质量分数的a溶液除烧杯、玻璃棒外,还需要的玻璃仪器(填序号)
(1)、P点的含义。(2)、t2℃时,向50g水中加入40g固体a,形成溶液的质量为g。(3)、a中混有少量的b,提纯a的方法是。(4)、配置一定质量分数的a溶液除烧杯、玻璃棒外,还需要的玻璃仪器(填序号)①托盘天平 ②量筒 ③胶头滴管 ④漏斗
35. 如图是甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线,请回答下列问题。 (1)、交点P的含义是。(2)、将乙溶液中的溶质结晶的方法通常是。(3)、三种物质中溶解度受温度的影响最大的是。(4)、t2℃时,将甲、乙、丙各30g分别充分溶于100g水中,所得溶液质量大小关系为 , 其中是饱和溶液。36. 甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答下列问题:
(1)、交点P的含义是。(2)、将乙溶液中的溶质结晶的方法通常是。(3)、三种物质中溶解度受温度的影响最大的是。(4)、t2℃时,将甲、乙、丙各30g分别充分溶于100g水中,所得溶液质量大小关系为 , 其中是饱和溶液。36. 甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答下列问题: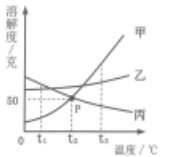 (1)、P点的含义是。(2)、t2℃时,将15克甲物质加入到20克水中,充分溶解后,所得溶液的质量是g。(3)、若乙中混有少量甲,可用的方法提纯乙(填“蒸发结晶”减“降温结晶”)。(4)、将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是。37. 甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。
(1)、P点的含义是。(2)、t2℃时,将15克甲物质加入到20克水中,充分溶解后,所得溶液的质量是g。(3)、若乙中混有少量甲,可用的方法提纯乙(填“蒸发结晶”减“降温结晶”)。(4)、将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是。37. 甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。 (1)、t2℃时,甲、乙、丙三种物质中溶解度由大到小的顺序是。(2)、随温度升高,溶解度减小的物质是。(3)、曲线中P点表示。(4)、t2℃时,向50g水中加入30g甲,充分搅拌后所得溶液中溶质的质量分数为(计算结果精确到0.1%)。(5)、若甲的饱和溶液中含有少量丙,提纯甲的方法是。38. 如图是甲、乙两种固体物质的溶解度曲线,请根据要求回答下列问题:
(1)、t2℃时,甲、乙、丙三种物质中溶解度由大到小的顺序是。(2)、随温度升高,溶解度减小的物质是。(3)、曲线中P点表示。(4)、t2℃时,向50g水中加入30g甲,充分搅拌后所得溶液中溶质的质量分数为(计算结果精确到0.1%)。(5)、若甲的饱和溶液中含有少量丙,提纯甲的方法是。38. 如图是甲、乙两种固体物质的溶解度曲线,请根据要求回答下列问题: (1)、℃时,甲、乙两物质的溶解度相等。(2)、t1℃时,将15g甲放入在20g水中,充分溶解后所得溶液溶质质量分数为。(3)、t2℃时,将甲、乙两种物质的饱和溶液降温到0℃,析出溶质质量多少的关系是____(填序号)。A、甲>乙 B、甲<乙 C、无法确定39. 请根据如图溶解度曲线,回答下列问题。
(1)、℃时,甲、乙两物质的溶解度相等。(2)、t1℃时,将15g甲放入在20g水中,充分溶解后所得溶液溶质质量分数为。(3)、t2℃时,将甲、乙两种物质的饱和溶液降温到0℃,析出溶质质量多少的关系是____(填序号)。A、甲>乙 B、甲<乙 C、无法确定39. 请根据如图溶解度曲线,回答下列问题。 (1)、10℃时,KNO3的溶解度比NaCl的。(2)、将不饱和的NaCl溶液变饱和的方法是。(3)、蒸发结晶和降温结晶是获得晶体的两种常用方法。当NaCl中混有少量KNO3时,提纯NaCl的方法是。40. 下表是NaCl、NH4Cl的部分溶解度数据,请按要求回答下列问题:
(1)、10℃时,KNO3的溶解度比NaCl的。(2)、将不饱和的NaCl溶液变饱和的方法是。(3)、蒸发结晶和降温结晶是获得晶体的两种常用方法。当NaCl中混有少量KNO3时,提纯NaCl的方法是。40. 下表是NaCl、NH4Cl的部分溶解度数据,请按要求回答下列问题:温度/℃
10
20
30
40
50
60
70
NaCl的溶解度/g
35.8
36.0
36.3
36.6
37.0
37.3
37.8
NH4Cl的溶解度/g
33.3
37.2
41.4
45.8
50.4
55.2
60.2
(1)、NaCl、NH4Cl两种固体物质的溶解度曲线如图所示,结合上表数据,则NH4Cl固体的溶解度曲线是(填“a”或“b”); (2)、参照上表数据,交点M的取值范围正确的是(填字母);A.10℃~20℃ B.40℃~50℃ C.33.3g~35.8g D.35.8g~36.0g(3)、50℃时,NaCl的溶解度是g,在此温度下,取20gNaCl固体放入50g水里,充分搅拌后,该溶液中溶质的质量分数是(结果精确到0.1%)。41. 氢氧化钙固体的溶解度曲线如图所示。
(2)、参照上表数据,交点M的取值范围正确的是(填字母);A.10℃~20℃ B.40℃~50℃ C.33.3g~35.8g D.35.8g~36.0g(3)、50℃时,NaCl的溶解度是g,在此温度下,取20gNaCl固体放入50g水里,充分搅拌后,该溶液中溶质的质量分数是(结果精确到0.1%)。41. 氢氧化钙固体的溶解度曲线如图所示。 (1)、由图可知,氢氧化钙的溶解度随着温度的升高而(填“增大”或“减小”)。(2)、20℃时,氢氧化钙饱和溶液中溶质的质量分数为(写出计算式即可)。42. 溶液与人们的生活息息相关。(1)、下表是两种物质在不同温度时的溶解度:
(1)、由图可知,氢氧化钙的溶解度随着温度的升高而(填“增大”或“减小”)。(2)、20℃时,氢氧化钙饱和溶液中溶质的质量分数为(写出计算式即可)。42. 溶液与人们的生活息息相关。(1)、下表是两种物质在不同温度时的溶解度:温度/℃
0
10
20
30
40
50
溶解度/g
氯化钾
27.6
31.0
34.0
37.0
40.0
42.6
次氯酸钠
22.7
26.7
34.8
50.0
52.4
56.5
①0℃时,100g水里最多只能溶解g氯化钾。
②30℃时,将30g次氯酸钠加入到装有50g水的烧杯中,充分溶解后,所得溶液的质量是g。将此溶液恒温蒸发10g水,烧杯中固体的质量为g。
③50℃时,将氯化钾和次氯酸钠的饱和溶液各100g分别降温至20℃,两溶液中溶质的质量大小关系是:氯化钾次氯酸钠(填“大于”“等于”或“小于”)。
(2)、我们常用含次氯酸钠的“84”消毒液定期对教室消毒。配制2000g质量分数为0.05%的消毒液,需要质量分数为10%的“84”消毒液g。43. 如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题。 (1)、在℃时,AB两种物质的溶解度相等。(2)、t2℃时,A,B,C三种物质中溶解度最大的是。(3)、若A中含有少量B时,可用的方法提纯A。(4)、t2℃时,将35gA固体加入100g水中,充分溶解并恢复到原温度后,形成A物质的(填“饱和”或“不饱和”)溶液,溶液的质量为g,溶质的质量分数为。44. NaCl和NH4Cl在不同温度下的溶解度数据如下表。
(1)、在℃时,AB两种物质的溶解度相等。(2)、t2℃时,A,B,C三种物质中溶解度最大的是。(3)、若A中含有少量B时,可用的方法提纯A。(4)、t2℃时,将35gA固体加入100g水中,充分溶解并恢复到原温度后,形成A物质的(填“饱和”或“不饱和”)溶液,溶液的质量为g,溶质的质量分数为。44. NaCl和NH4Cl在不同温度下的溶解度数据如下表。温度/℃
0
10
20
30
40
50
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
(1)、50℃时,NaCl的溶解度是g。(2)、如图是NaCl和NH4Cl的溶解度曲线,则NH4Cl的溶解度曲线是(填“a”或“b”)。t℃时,若饱和NaCl溶液和饱NH4Cl溶液中溶质的质量相等,则下列说法错误的是(填字母)。
A.两种溶液中溶剂的质量相等
B.两种溶液中溶质质量分数相等
C.t℃大于20℃
(3)、20℃时,将mgNaCl不饱和溶液平均分为三份,并分别进行如下操作:


据此分析,x= , mgNaCl不饱和溶液中水的质量为g。
45. 几种固体物质的溶解度曲线如图所示,请回答下列问题。 (1)、在50℃时,硝酸钾的溶解度氯化钾的溶解度。(填“大于”“小于”或“等于”)。(2)、使接近饱和的硝酸钾溶液变为饱和溶液的方法是。(任写一种)(3)、硝酸钾、氯化钾和氢氧化钙中,溶解度随温度升高而减小的是。(4)、在40℃时,向50g水中加入25g氯化钾,充分溶解后,所得溶液的溶质质量分数是。(精确到0.1%)46. 20℃时溶解度和溶解性的关系如下表,a、b、c三种物质的溶解度曲线如下图。
(1)、在50℃时,硝酸钾的溶解度氯化钾的溶解度。(填“大于”“小于”或“等于”)。(2)、使接近饱和的硝酸钾溶液变为饱和溶液的方法是。(任写一种)(3)、硝酸钾、氯化钾和氢氧化钙中,溶解度随温度升高而减小的是。(4)、在40℃时,向50g水中加入25g氯化钾,充分溶解后,所得溶液的溶质质量分数是。(精确到0.1%)46. 20℃时溶解度和溶解性的关系如下表,a、b、c三种物质的溶解度曲线如下图。溶解度S
溶解性
S≥10g
易溶
10g>S≥lg
可溶
1g>S≥0.0lg
微溶
S<0.01g
难溶
 (1)、20℃时a、b两物质的溶解性均为溶。(2)、c在水中的溶解度随温度的变化趋势与____相似(填序号)。A、KNO3 B、NaCl C、Ca(OH)2(3)、某温度时,将b的饱和溶液升温(填“一定”或“不一定”)能形成不饱和溶液。(4)、关于a、b溶液说法正确的是____(填序号)。A、20℃时可配制质量分数为25%的a溶液 B、使60℃的a饱和溶液析出晶体的方法不止一种 C、阴影区域(不包括b曲线上的点)对应的b溶液为饱和溶液47. 根据下表信息填空。
(1)、20℃时a、b两物质的溶解性均为溶。(2)、c在水中的溶解度随温度的变化趋势与____相似(填序号)。A、KNO3 B、NaCl C、Ca(OH)2(3)、某温度时,将b的饱和溶液升温(填“一定”或“不一定”)能形成不饱和溶液。(4)、关于a、b溶液说法正确的是____(填序号)。A、20℃时可配制质量分数为25%的a溶液 B、使60℃的a饱和溶液析出晶体的方法不止一种 C、阴影区域(不包括b曲线上的点)对应的b溶液为饱和溶液47. 根据下表信息填空。温度/C
0
20
40
60
80
100
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
KNO3
13.3
31.6
63.9
110
169
246
(1)、40℃时,向盛有30g NaCl的烧杯中加入50g水,充分溶解后得到的是(填“饱和”或“不饱和”)溶液。(2)、80℃时,分别用100g水配成NaCl和KNO3 , 的饱和溶液,同时降温到20℃时,析出固体较多的是。48. 根据图中KNO3、NaCl的溶解度曲线,回答下列问题: (1)、40℃时,KNO3、NaCl两种物质的溶解度大小关系:KNO3NaCl(填“>”“<”或“=”)。(2)、下列说法不正确的是____(填字母)。A、t℃时,将45gKNO3固体放入50g水中充分溶解,所得溶液的质量为95g B、NaCl溶液中含有少量KNO3 , 可以采用蒸发结晶的方法提纯NaCl C、40℃时,将KNO3的饱和溶液降温至20℃,溶液的溶质质量分数减小(不考虑水分损失)(3)、同学们查阅NaCl的溶解度曲线后,欲配制20℃时100g溶质质量分数为10%的NaCl溶液。已知配制溶液的步骤有:①溶解 ②计算 ③装瓶存放 ④称量
(1)、40℃时,KNO3、NaCl两种物质的溶解度大小关系:KNO3NaCl(填“>”“<”或“=”)。(2)、下列说法不正确的是____(填字母)。A、t℃时,将45gKNO3固体放入50g水中充分溶解,所得溶液的质量为95g B、NaCl溶液中含有少量KNO3 , 可以采用蒸发结晶的方法提纯NaCl C、40℃时,将KNO3的饱和溶液降温至20℃,溶液的溶质质量分数减小(不考虑水分损失)(3)、同学们查阅NaCl的溶解度曲线后,欲配制20℃时100g溶质质量分数为10%的NaCl溶液。已知配制溶液的步骤有:①溶解 ②计算 ③装瓶存放 ④称量I.上述步骤的正确顺序为(填序号)。
Ⅱ.溶解时玻璃棒的作用为。
-
-