2022年化学中考真题汇编:质量守恒定律及其应用
试卷更新日期:2022-08-10 类型:二轮复习
一、单选题
-
1. 我国发射卫星的火箭常用N2H4作燃料,点燃时与助燃剂X发生下列反应: , 则X的化学式是( )A、NO B、N2O C、NO2 D、N2O42. 制备硝酸的过程中,会产生氮的氧化物等空气污染物。为减少环境污染,需要用氢氧化钠溶液吸收尾气,反应的化学方程式为 , 则X的化学式为( )A、NO2 B、N2O C、N2O5 D、N2O33. 下列图像表示的对应关系正确的是( )A、
 向饱和的氯化钠溶液中不断加入氯化钾固体
B、
向饱和的氯化钠溶液中不断加入氯化钾固体
B、 等质量的镁和氧气在密闭容器中点燃,充分反应
C、
等质量的镁和氧气在密闭容器中点燃,充分反应
C、 向一定量的稀硫酸中不断加水
D、
向一定量的稀硫酸中不断加水
D、 向等质量的碳酸钠和碳酸氢钠固体中分别加入等质量分数且足量的稀盐酸
4. 硅是信息技术的关键材料,工业上制粗硅的反应原理是: ,其中X的化学式是( )A、CO2 B、H2O C、SiH4 D、CO5. 下列关于化学反应的说法,错误的是( )A、化学反应前后,分子种类发生改变,原子种类不变 B、化学反应前后,分子数目发生改变,原子数目不变 C、化学反应前后,物质种类发生改变,元素种类不变 D、化学反应的过程就是参加反应的各物质的原子重新组合生成其他物质的过程6. 利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为 , X的化学式为( )A、C B、CH4 C、CH3OH D、CH2O7. 硅是重要的半导体材料,(高纯)是工业制硅流程中的化学反应之一、下列说法错误的是( )A、反应中元素种类不变 B、反应中各原子数目不变 C、X的化学式是SiHCl2 D、副产品可用于生产盐酸8. 向溶液X中加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝。则溶液X中一定含有的微粒是( )A、Cl- B、 C、Ca2+ D、9. 北京2022年冬奥会火种灯的造型灵感来自“中华第一灯”一西汉长信宫灯,火种灯燃料是一种气体燃料X,点燃X发生反应的化学方程式是:X+5O23CO2+4H2O,则X的化学式为( )A、H2 B、CO C、C3H8 D、CH410. 甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )
向等质量的碳酸钠和碳酸氢钠固体中分别加入等质量分数且足量的稀盐酸
4. 硅是信息技术的关键材料,工业上制粗硅的反应原理是: ,其中X的化学式是( )A、CO2 B、H2O C、SiH4 D、CO5. 下列关于化学反应的说法,错误的是( )A、化学反应前后,分子种类发生改变,原子种类不变 B、化学反应前后,分子数目发生改变,原子数目不变 C、化学反应前后,物质种类发生改变,元素种类不变 D、化学反应的过程就是参加反应的各物质的原子重新组合生成其他物质的过程6. 利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为 , X的化学式为( )A、C B、CH4 C、CH3OH D、CH2O7. 硅是重要的半导体材料,(高纯)是工业制硅流程中的化学反应之一、下列说法错误的是( )A、反应中元素种类不变 B、反应中各原子数目不变 C、X的化学式是SiHCl2 D、副产品可用于生产盐酸8. 向溶液X中加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝。则溶液X中一定含有的微粒是( )A、Cl- B、 C、Ca2+ D、9. 北京2022年冬奥会火种灯的造型灵感来自“中华第一灯”一西汉长信宫灯,火种灯燃料是一种气体燃料X,点燃X发生反应的化学方程式是:X+5O23CO2+4H2O,则X的化学式为( )A、H2 B、CO C、C3H8 D、CH410. 甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )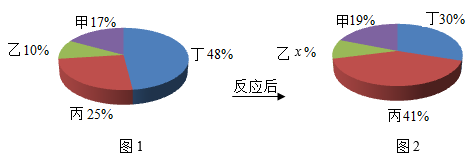 A、丁是反应物 B、x的值为20 C、乙是此化学反应的催化剂 D、生成38g甲,需消耗60g丁11. CuCl2是重要的化工原料。一种生成CuCl2的反应原理如下图。下列说法正确的是( )
A、丁是反应物 B、x的值为20 C、乙是此化学反应的催化剂 D、生成38g甲,需消耗60g丁11. CuCl2是重要的化工原料。一种生成CuCl2的反应原理如下图。下列说法正确的是( ) A、该反应的生成物只有CuCl2 B、该反应前后元素的种类没有发生变化 C、该反应前后含铁催化剂的质量发生变化 D、该反应属于置换反应12. 一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下表所示。下列说法错误的是( )
A、该反应的生成物只有CuCl2 B、该反应前后元素的种类没有发生变化 C、该反应前后含铁催化剂的质量发生变化 D、该反应属于置换反应12. 一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下表所示。下列说法错误的是( )纯净物
C2H5OH
O2
CO2
H2O
X
反应前质量/g
4.6
2.4
0
0
0
反应后质量/g
0
0
2.2
2.7
待测
A、反应后X的质量为2.1g B、X中一定含有碳元素和氧元素 C、X中一定含有碳元素和氢元素 D、X中两种元素的质量比是6:113. 北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为。推断X的化学式是( )A、C3H8 B、C3H6 C、C2H6O2 D、C3H8O314. 载人航天器中利用下图所示的“氧再生系统”处理宇航员排出的H2O和CO2.下列说法错误的是( ) A、排到舱外的物质是甲烷 B、反应器2中消耗
A、排到舱外的物质是甲烷 B、反应器2中消耗 和
和 生成的个数比为1:1
C、反应器2中生成
生成的个数比为1:1
C、反应器2中生成 和
和 的质量比为9:8
D、该系统在产生O2的同时降低了舱内CO2的浓度
15. 一种利用太阳能分解水的原理如图所示。下列说法错误的是( )
的质量比为9:8
D、该系统在产生O2的同时降低了舱内CO2的浓度
15. 一种利用太阳能分解水的原理如图所示。下列说法错误的是( ) A、反应I的化学方程式: B、理论上每生成2gH2 , 同时生成32gO2 C、反应Ⅲ中生成SO2和O2的分子个数比为2:1 D、反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变16. 取碳和氧化铜的混合物ag在一定条件下恰好完全反应,相关量的变化如下图,下列说法正确的是( )
A、反应I的化学方程式: B、理论上每生成2gH2 , 同时生成32gO2 C、反应Ⅲ中生成SO2和O2的分子个数比为2:1 D、反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变16. 取碳和氧化铜的混合物ag在一定条件下恰好完全反应,相关量的变化如下图,下列说法正确的是( )
 A、M点对应的固体物质只有两种 B、N点对应的固体为黑色 C、反应后产生气体的总质量为(a-b)g D、0~t2min内,固体中铜元素的质量分数不变17. 将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是( )
A、M点对应的固体物质只有两种 B、N点对应的固体为黑色 C、反应后产生气体的总质量为(a-b)g D、0~t2min内,固体中铜元素的质量分数不变17. 将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是( )物质
甲
乙
丙
丁
反应前质量/g
30
20
5
0
反应后质量/g
14
16
a
20
A、a=5 B、甲和乙为反应物 C、丙可能是催化剂 D、甲、乙、丁的相对分子质量之比为2:1:2二、综合题
-
18. 化学在生产、生活中有着广泛应用。(1)、现有三种物质:A.氧气 B.金刚石 C.氯化钾,选择适当的物质填空(填字母序号)。
①可用于医疗急救的是;②可用来裁玻璃的是;③可用作钾肥的是。
(2)、疫情防控,处处蕴含化学知识。①正确佩戴口罩能有效预防新冠肺炎,制作口罩用的无纺布主要成分是聚丙烯,聚丙烯属于(填字母序号)。
A.天然有机高分子材料 B.合成有机高分子材料
②“84消毒液”(有效成分是NaClO)可以消毒、杀菌。“84消毒液”与洁厕灵混用会使人中毒,反应原理为: , 其中X的化学式为。
19. 第二十四届冬季奥林匹克运动会向全世界展示了绿色奥运的理念。(1)、冬奥会场馆所用电能,主要来源于太阳能、风能发电,与燃煤发电相此,减少了二氧化碳气体的排放,可有效缓解的环境问题是。(2)、冬奥火炬采用氢气作燃料。从燃烧产物分析,氢气被认为是理想的清洁燃料,原因是。(3)、冬奥火种灯燃料是丙烷(C3H8),燃烧的化学方程式为: , 则X的数值为。关闭火种灯的燃料开关,会使火焰熄灭,采用的灭火原理是。20. 2022年4月16日,在太空遨游六个月的神舟十三号载人飞船安全返回,它的成功发射、在轨运行及安全着陆。标志着我国航天科技水平已处于世界领先地位。请分析图文信息,解答21~24题的相关问题。 (1)、飞船发射时,为增加发射动力和发射过程的有效性,选用偏二甲肼(C2H8N2 , 有毒)和四氧化二氮(N2O4 , 有毒)组成双元动力推进剂,二者反应可生成对环境无污染的CO2、H2O和 , 推进剂在使用时应注意。(2)、为保护宇航员的生命安全,一方面,“环控生保系统”向舱内输送的可供呼吸的气体是 , 另一方面,飞船往返过程中,宇航员要穿上压力服,当舱内压力突变时,压力服会迅速充满气体,这就需要压力服必须具有良好的性。(3)、舱外宇航服用铝、橡胶、聚酯材料等制作而成,其中的铝属于材料,铝的元素符号为。舱外宇航服的最外层使用了玻璃纤维和一种叫“特氟隆”的合成纤维,足以抵御像枪弹一般的微陨石的袭击,它具有的特性是(合理即可)。(4)、返回舱返回时的动力来自液氢和液氧,它们提供动力时,发生反应的化学方程式为。在即将着陆前,要迅速释放剩余的燃料,这样做的目的是。21. 钛合金、铝合金广泛应用于航空工业。(1)、下列矿石主要成分含相同金属元素的是____(填序号)。A、磁铁矿 B、铝土矿 C、菱铁矿(2)、钛与盐馥反应:2Ti+6HCl=2X+3H2↑,则X化学式为。若把钛放入硝酸银溶液中(填“有”或“没有“)单质银析出。(3)、工业制铝原理为电解熔融的Al2O3 , 生成铝和一种可供呼吸的气体。该反应的化学方程式为。22. 仪陇县龙岗气田天然气储量极为丰富,其天然气中因含有少量硫化氢(H2S)需脱硫处理,以防止污染空气。硫化氢具有可燃性,硫化氢完全燃烧的化学方程式是。(1)、X的化学式为。(2)、硫化氢中硫元素的化合价为。(3)、上述反应中出现的氧化物能形成酸雨的是。23. 太阳能属于新能源,光伏发电的关键元件是太阳能电池(主要材料为晶体硅)和铅酸蓄电池。如图是太阳能电池路灯。
(1)、飞船发射时,为增加发射动力和发射过程的有效性,选用偏二甲肼(C2H8N2 , 有毒)和四氧化二氮(N2O4 , 有毒)组成双元动力推进剂,二者反应可生成对环境无污染的CO2、H2O和 , 推进剂在使用时应注意。(2)、为保护宇航员的生命安全,一方面,“环控生保系统”向舱内输送的可供呼吸的气体是 , 另一方面,飞船往返过程中,宇航员要穿上压力服,当舱内压力突变时,压力服会迅速充满气体,这就需要压力服必须具有良好的性。(3)、舱外宇航服用铝、橡胶、聚酯材料等制作而成,其中的铝属于材料,铝的元素符号为。舱外宇航服的最外层使用了玻璃纤维和一种叫“特氟隆”的合成纤维,足以抵御像枪弹一般的微陨石的袭击,它具有的特性是(合理即可)。(4)、返回舱返回时的动力来自液氢和液氧,它们提供动力时,发生反应的化学方程式为。在即将着陆前,要迅速释放剩余的燃料,这样做的目的是。21. 钛合金、铝合金广泛应用于航空工业。(1)、下列矿石主要成分含相同金属元素的是____(填序号)。A、磁铁矿 B、铝土矿 C、菱铁矿(2)、钛与盐馥反应:2Ti+6HCl=2X+3H2↑,则X化学式为。若把钛放入硝酸银溶液中(填“有”或“没有“)单质银析出。(3)、工业制铝原理为电解熔融的Al2O3 , 生成铝和一种可供呼吸的气体。该反应的化学方程式为。22. 仪陇县龙岗气田天然气储量极为丰富,其天然气中因含有少量硫化氢(H2S)需脱硫处理,以防止污染空气。硫化氢具有可燃性,硫化氢完全燃烧的化学方程式是。(1)、X的化学式为。(2)、硫化氢中硫元素的化合价为。(3)、上述反应中出现的氧化物能形成酸雨的是。23. 太阳能属于新能源,光伏发电的关键元件是太阳能电池(主要材料为晶体硅)和铅酸蓄电池。如图是太阳能电池路灯。 (1)、下列不属于合成材料的是____(填序号)。A、塑料灯罩 B、合金边框 C、铁质灯杆(2)、光伏发电原理是将太阳能转化为能。(3)、铅酸蓄电池的反应原理为:PbO2+Pb+2H2SO42PbSO4+2H2O,放电过程中酸液的pH(填“增大”或“减小”)。(4)、高温下SiCl4和H2发生置换反应生成单质Si,该反应的化学方程式为。24. 2025年长安汽车厂将停止销售传统燃油车,新能源汽车发展成为主要趋势。(1)、下列不属于新能源的是____(填序号)。A、氢能 B、汽油 C、生物质能(2)、乙醇是一种生物燃料,它是(填 “可再生”或“不可再生”)能源。乙醇在空气中完全燃烧生成水和(写化学式),并放出大量热。(3)、肼-空气燃料电池有织应用于汽车工业,其原理是肼(N2H4)与氧气反应生成一种单质和水,反应化学方程式为。
(1)、下列不属于合成材料的是____(填序号)。A、塑料灯罩 B、合金边框 C、铁质灯杆(2)、光伏发电原理是将太阳能转化为能。(3)、铅酸蓄电池的反应原理为:PbO2+Pb+2H2SO42PbSO4+2H2O,放电过程中酸液的pH(填“增大”或“减小”)。(4)、高温下SiCl4和H2发生置换反应生成单质Si,该反应的化学方程式为。24. 2025年长安汽车厂将停止销售传统燃油车,新能源汽车发展成为主要趋势。(1)、下列不属于新能源的是____(填序号)。A、氢能 B、汽油 C、生物质能(2)、乙醇是一种生物燃料,它是(填 “可再生”或“不可再生”)能源。乙醇在空气中完全燃烧生成水和(写化学式),并放出大量热。(3)、肼-空气燃料电池有织应用于汽车工业,其原理是肼(N2H4)与氧气反应生成一种单质和水,反应化学方程式为。三、实验探究题
-
25. 同学们在学习过程中了解到Mg能在CO2中燃烧,根据金属活动性顺序表,Na比Mg活泼,由此猜想Na也能在CO2中燃烧,实验小组进行以下实验探究:
【查阅资料】
①金属钠性质活泼,常温下,金属钠极易与氧气反应,生成白色物质氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应,放出氢气。
②Na2CO3溶液显碱性;CaCl2溶液显中性。
(1)、【实验探究一】Na能在CO2中燃烧吗?步骤1:制取并收集一瓶纯净干燥的CO2气体。
步骤2:将燃着的钠迅速伸入集气瓶中,观察到钠在CO2中继续燃烧,发光放热,冷却后观察到瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
步骤2中生成的黑色固体是。
【初步结论】Na能在CO2中燃烧。
(2)、【实验探究二】Na在CO2中燃烧的产物中白色物质成分的探究。【提出问题】白色物质是什么?
【猜想与假设】
猜想一:氧化钠; 猜想二:碳酸钠; 猜想三:氧化钠和碳酸钠的混合物;
清想四:氢氧化钠。
大家讨论后一致认为猜想四是错误的,理由是。
(3)、【设计方案与实验】方案1:取该样品少里于试管中,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色。结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管中,滴加足量盐酸,溶液中有气泡冒出。结论:白色物质中一定有Na2CO3。
方案3:取该样品少量于试管中,加入适量的水,振荡,过滤,向滤液中加入过量的氯化钙溶液,出现白色沉淀,过滤,再向滤液中滴加无色酚酞溶液,无明显现象。
【反思与评价】
甲同学思考后提出方案1得出的结论不正确,其理由是。
(4)、方案3中加入过里CaCl2溶液的目的是。(5)、【实验结论】综上所述,你认为猜想成立。
(6)、写出Na在CO2中燃烧的化学方程式。四、计算题
-
26. 小红在实验时发现,向碳酸钠溶液中倾倒稀盐酸,很快就产生了气泡;向碳酸钠溶液中逐滴加入稀盐酸,滴加一定量后才有气泡产生。她查阅资料得知:向碳酸钠溶液中逐滴加入稀盐酸,先发生的反应是 ;当Na2CO3全部转化成NaHCO3后,再发生反应。她设计下图装置进行了实验:在广口瓶中加入20克溶质质量分数为10.6%的碳酸钠溶液,用注射器向瓶中缓慢注入一定量的溶质质量分数为7.3%的稀盐酸。

回答下列问题:
(1)、向一定量碳酸钠溶液中无论是倾倒还是逐滴加入足量的稀盐酸,完全反应后产生二氧化碳质量(填“相等”或“不等)。(2)、上述实验中,加入稀盐酸多少克后才开始产生二氧化碳(写出计算过程)?27. 硅及其重要化合物在现代高新技术领域应用广泛。(1)、金刚砂(SiC)用作航天器涂层,生产原理:。补齐上述化学方程式:(2)、高纯度焦炭与石英砂(SiO2)反应可制得硅:。现有120kg的SiO2 , 理论上可生产硅的质量为多少?28. 将12.0g大理石样品置于烧杯中,向其中逐渐加入稀盐酸(杂质既不溶于水,也不与稀盐酸反应)。当加入94.4g稀盐酸,恰好不再有气体生成,此时烧杯内混合物的质量为102.0g(假设CO2全部逸出,不考虑水的损失)。试计算:(1)、生成二氧化碳的质量是g。(2)、烧杯内所得溶液中溶质的质量分数。(写出计算过程)29. 为测定 10g 氧化铜样品(含少量铜)中氧化铜的质量分数,在高温的条件下加入足量木炭粉使其完全反应,固体总质量随时间的变化如图所示: (1)、完全反应后,产生二氧化碳的总质量是;(2)、试计算氧化铜样品中氧化铜的质量分数(写出计算过程)。30. 以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
(1)、完全反应后,产生二氧化碳的总质量是;(2)、试计算氧化铜样品中氧化铜的质量分数(写出计算过程)。30. 以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?

该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KCl的质量为16.7g。
请回答下列问题:
(1)、从图中可知完全反应后生成的O2质量是g。(2)、上述计算过程是否正确?(填“正确”或“不正确”)。如果不正确,请你重新利用化学方程式计算生成KCl的质量。31. 学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有10g钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀盐酸与钙片的总质量减少了3.3g。(钙片中其他成分不与稀盐酸反应放出气体)(1)、反应中生成二氧化碳的质量是g。(2)、计算该品牌钙片中含碳酸钙的质量分数。32. 医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如表。加盐酸的次数
第一次
第二次
加盐酸的质量/g
40.0
40.0
生成气体的质量/g
3.3
1.1
(1)、两次加稀盐酸后,生成二氧化碳的总质量是g。(2)、该样品中碳酸氢钠的质量分数(写出计算过程)。(反应的化学方程式为:)33. 计算下列小题。(1)、用100克溶质质量分数为30%的过氧化氢溶液配制成溶质质量分数为5%的过氧化氢溶液,需加水 克。(2)、取75克某过氧化氢溶液放入锥形瓶中并加入一定量的二氧化锰,用电子秤测其质量,不同时间电子秤的读数如表所示。试计算该过氧化氢溶液的溶质质量分数(不考虑H2O逸出,写出计算过程,结果保留到0.1%)。反应时间/min
0
1
2
3
4
5
6
锥形瓶+瓶内物质的总质量/g
375.00
371.56
366.28
365.56
365.40
365.40
365.40
34. 某同学在学习质量守恒定律时,称取0.6g镁条进行燃烧实验(如下图)。 (1)、计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。(2)、该同学称得反应后固体的质量小于0.6g,原因可能是。35. 铝碳酸镁咀嚼片(主要成分是AlMg(OH)3CO3)可治疗胃酸过多症,反应原理可用化学方程式表示为。某化学兴趣小组使用下图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入20片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中、已知AlMg(OH)3CO3的相对分子质量为162。请计算:
(1)、计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。(2)、该同学称得反应后固体的质量小于0.6g,原因可能是。35. 铝碳酸镁咀嚼片(主要成分是AlMg(OH)3CO3)可治疗胃酸过多症,反应原理可用化学方程式表示为。某化学兴趣小组使用下图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入20片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中、已知AlMg(OH)3CO3的相对分子质量为162。请计算:
时间(s)
0
10
20
30
40
50
60
70
读数(g)
198.4
197.8
197.4
196.0
195.8
195.7
195.7
195.7
(1)、生成二氧化碳g。(2)、每片该咀嚼片中铝碳酸镁的含量为多少(计算结果保留到0.1g)?
-
