2022年化学中考真题汇编:物质组成的综合计算
试卷更新日期:2022-08-10 类型:二轮复习
一、单选题
-
1. 碳酸钙和氧化钙组成的混合物中钙元素的质量分数为 60%,将 20g 该混合物高温煅烧固体质量不再改变,生成二氧化碳的质量是( )A、12g B、4.8g C、3.2g D、4.4g2. 以下对实验的相关分析,错误的是( )A、过滤液体时发现滤液浑浊,可能的原因是滤纸破损 B、给固体加热时,试管口略向下倾斜,以免冷凝水回流到热的试管底部使其炸裂 C、在测定空气里氧气的含量实验中,若弹簧夹没夹紧会造成所测得的氧气含量偏低 D、在利用红磷燃烧验证质量守恒定律的实验中,若红磷量不足不会影响实验结果3. 中印“东湖茶叙”使恩施州硒茶品牌迅速蹿红,享誉全球恩施绿茶中的茶多酚(C22H18O11)是形成茶叶色香味的主要成分之一、下列说法正确的是( )A、茶多酚的相对分子质量是458g B、茶多酚由碳、氢、氧三种元素组成 C、茶多酚中氧元素质量分数最小 D、茶多酚中碳、氧元素质量比为2:14. 下列说法正确的是( )A、目前计入空气污染指数的有∶SO2、CO、CO2、NO、PM2.5和O3等 B、医疗生理盐水浓度为0.9%,指的是 100g氯化钠溶液中含0.9g 医用氯化钠 C、23g有机物M在氧气中充分燃烧,生成44gCO2和27gH2O,则M中一定含碳、氢元素,可能含氧元素 D、某铁合金含 Mg、Zn、Cu中的一种或几种,现向5.6g 该合金中加入足量稀盐酸,生成0.2gH2 , 则该合金的金属组合可能有3种5. 将138g酒精(C2H5OH)点燃,酒精燃烧全部变为CO、CO2和H2O,恢复到室温,测得所得气体中氧元素质量分数为64%,则燃烧所耗氧气的质量为( )A、96g B、128g C、136g D、224g6. 天然气的主要成分是甲烷(CH4)。当氧气不足时,甲烷燃烧会生成CO2、CO和H2O,若16g甲烷燃烧生成CO2和CO的质量比为11:7,则参加反应的O2的质量为( )A、48g B、56g C、64g D、72g7. 由下列实验及现象可出相应结论的是( )
选项
实验
现象
结论
A
检验氢气的纯度

点燃氢气时发出尖锐爆鸣声
氢气较纯
B
称量盐酸和碳酸钠粉末反应前后的质量

反应前后称量结果不同
参加该反应的反应物质量总和不等于生成物质量总和
C
检验某混合气体的成分
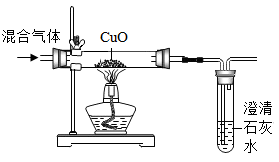
黑色粉末变红,澄清石灰水变浑浊
混合气体中可能含有CO
D
在酒精灯火焰上方罩一个冷而干燥的烧杯

烧杯内壁有无色液滴产生
酒精中含有碳元素和氢元素
A、A B、B C、C D、D8. 下列实验能达到目的的是( )A、 测定空气中氧气的含量
B、
测定空气中氧气的含量
B、 探究甲烷中是否含碳元素
C、
探究甲烷中是否含碳元素
C、 验证质量守恒定律
D、
验证质量守恒定律
D、 配制一定溶质质量分数的氯化钠溶液
9. 4月28日我国化学家团队公布了最新研究成果:通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖(C6H12O6)和脂肪酸。这项突破为人工和半人工合成“粮食”提供了新技术。葡萄糖中碳、氢、氧的元素质量比为( )A、1:1:1 B、1:2:1 C、6:1:6 D、6:1:810. 勤劳智慧的中国劳动人民在很早以前就掌握了湿法炼铜的技术。某实验小组模拟湿法炼铜,向50.0gCuSO4溶液中加入10.0g铁粉(铁粉过量),待溶液中CuSO4反应完全后,过滤,所得滤渣的质量为10.4g。则原溶液中CuSO4的质量分数为( )A、20% B、16% C、10% D、8%11. 下列各组溶液混合后,能发生化学反应且溶液总质量不变的是( )A、氢氧化钠溶液和稀硫酸 B、硫酸铜溶液和氯化钡溶液 C、氢氧化钾溶液和氯化钠溶液 D、碳酸钠溶液和稀盐酸12. 下列图像不能正确反映对应变化关系的是( )A、
配制一定溶质质量分数的氯化钠溶液
9. 4月28日我国化学家团队公布了最新研究成果:通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖(C6H12O6)和脂肪酸。这项突破为人工和半人工合成“粮食”提供了新技术。葡萄糖中碳、氢、氧的元素质量比为( )A、1:1:1 B、1:2:1 C、6:1:6 D、6:1:810. 勤劳智慧的中国劳动人民在很早以前就掌握了湿法炼铜的技术。某实验小组模拟湿法炼铜,向50.0gCuSO4溶液中加入10.0g铁粉(铁粉过量),待溶液中CuSO4反应完全后,过滤,所得滤渣的质量为10.4g。则原溶液中CuSO4的质量分数为( )A、20% B、16% C、10% D、8%11. 下列各组溶液混合后,能发生化学反应且溶液总质量不变的是( )A、氢氧化钠溶液和稀硫酸 B、硫酸铜溶液和氯化钡溶液 C、氢氧化钾溶液和氯化钠溶液 D、碳酸钠溶液和稀盐酸12. 下列图像不能正确反映对应变化关系的是( )A、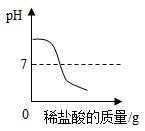 向一定质量的氢氧化钠溶液中逐滴加入稀盐酸
B、
向一定质量的氢氧化钠溶液中逐滴加入稀盐酸
B、 一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C、
一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C、 在密闭容器中用足量红磷燃烧测定空气中氧气的含量
D、
在密闭容器中用足量红磷燃烧测定空气中氧气的含量
D、 探究分解过氧化氢制氧气的反应中二氧化锰的作用
13. 载入航天器中处理CO2的一种方法为 ,X的化学式为( )A、Li B、Li2O C、Li2CO3 D、LiOH14. 诺贝尔化学奖得主德国化学家Gerhard Ertl对CO在催化剂【Pt/Al2O3/Ba】表面进行的研究,催生了汽车尾气净化装置。下图为汽车尾气净化装置内发生反应的微观示意图,有关说法错误的是( )
探究分解过氧化氢制氧气的反应中二氧化锰的作用
13. 载入航天器中处理CO2的一种方法为 ,X的化学式为( )A、Li B、Li2O C、Li2CO3 D、LiOH14. 诺贝尔化学奖得主德国化学家Gerhard Ertl对CO在催化剂【Pt/Al2O3/Ba】表面进行的研究,催生了汽车尾气净化装置。下图为汽车尾气净化装置内发生反应的微观示意图,有关说法错误的是( ) A、参加反应的甲与乙的分子个数比为1:1 B、参加反应的甲与丁的质量比为1:1 C、该反应符合质量守恒定律 D、该装置的应用能减少汽车尾气对空气的污染15. 实验室里一般不能制得氧气的物质是( )A、高锰酸钾 B、氯酸钾 C、氯化钠 D、过氧化氢16. 现代航空技术使用高能燃料液氢和助燃剂液氧,在发动机内氢气和氧气发生燃烧时生成水。下列有关氢气与氧气的说法中错误的是( )A、氢气、氧气和水都是由分子构成的 B、氢气和氧气燃烧生成水的过程中,分子种类发生了变化 C、氢气和氧气燃烧生成水的过程中,原子种类没有发生改变 D、氢气、氧气和水都是化合物17. 把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )
A、参加反应的甲与乙的分子个数比为1:1 B、参加反应的甲与丁的质量比为1:1 C、该反应符合质量守恒定律 D、该装置的应用能减少汽车尾气对空气的污染15. 实验室里一般不能制得氧气的物质是( )A、高锰酸钾 B、氯酸钾 C、氯化钠 D、过氧化氢16. 现代航空技术使用高能燃料液氢和助燃剂液氧,在发动机内氢气和氧气发生燃烧时生成水。下列有关氢气与氧气的说法中错误的是( )A、氢气、氧气和水都是由分子构成的 B、氢气和氧气燃烧生成水的过程中,分子种类发生了变化 C、氢气和氧气燃烧生成水的过程中,原子种类没有发生改变 D、氢气、氧气和水都是化合物17. 把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )物质
甲
乙
丙
丁
反应前的质量/g
7
10
28
37
反应后的质量/g
14
10
33
x
A、x的值是25 B、乙一定是催化剂 C、甲和丁都是反应物 D、反应中,甲与丙发生改变的质量比是14:3318. 有关下列图像的描述,正确的是( )A、 表示向硫酸铜溶液中不断滴入氢氧化钡溶液
B、
表示向硫酸铜溶液中不断滴入氢氧化钡溶液
B、 表示将两份质量相等的固体物质分别加热制取氧气
C、
表示将两份质量相等的固体物质分别加热制取氧气
C、 表示向一定温度下氢氧化钙的饱和溶液中加入少量氧化钙固体
D、
表示向一定温度下氢氧化钙的饱和溶液中加入少量氧化钙固体
D、 表示向等质量的镁条和铝条中分别加入足量的溶质质量分数相同的稀硫酸
19. 《抱朴子·金丹篇》记载:“丹砂(HgS)烧之成水银,积变又还成丹砂。”下列说法错误的是( )A、“水银”是指金属汞 B、“烧之”说明该反应需要加热 C、上述反应中可能有硫生成 D、“积变又还成丹砂”是物理变化20. 我国湿法炼铜的工艺在宋、元时期已相当成熟。小军同学在实验室模拟湿法炼铜,他取48.0g铁片放入一定质量的氯化铜溶液中,反应一段时间后, 得到50.0g固体。则所得固体中铁的质量分数为( )A、28.0% B、68.0% C、92.5% D、96.0%
表示向等质量的镁条和铝条中分别加入足量的溶质质量分数相同的稀硫酸
19. 《抱朴子·金丹篇》记载:“丹砂(HgS)烧之成水银,积变又还成丹砂。”下列说法错误的是( )A、“水银”是指金属汞 B、“烧之”说明该反应需要加热 C、上述反应中可能有硫生成 D、“积变又还成丹砂”是物理变化20. 我国湿法炼铜的工艺在宋、元时期已相当成熟。小军同学在实验室模拟湿法炼铜,他取48.0g铁片放入一定质量的氯化铜溶液中,反应一段时间后, 得到50.0g固体。则所得固体中铁的质量分数为( )A、28.0% B、68.0% C、92.5% D、96.0%二、多选题
-
21. 取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素质量分数为50.0%。下列判断正确的是( )A、原来CaCO3的质量为14.5g B、生成2.0gCO2气体 C、剩余8.0g固体为纯净物 D、剩余8.0g固体中加入稀盐酸有气泡产生22. 下列示意图与叙述对应正确的是( )A、
 向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠钠溶液
B、
向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠钠溶液
B、 两份等体积的 5%过氧化氢溶液,向其中一份加入少量二氧化锰
C、
两份等体积的 5%过氧化氢溶液,向其中一份加入少量二氧化锰
C、 向稀盐酸中滴加足量的水
D、
向稀盐酸中滴加足量的水
D、 等质量的不同金属分别放入到足量的相同稀盐酸中
23. 碳酸钠和碳酸氢钠是生活中常见的盐。已知碳酸钠很稳定受热不易分解,碳酸氢钠受热易分解,其反应原理为:。某同学进行如下实验:将碳酸钠和碳酸氢钠的混合物 13.7 g 充分加热至质量不再改变,冷却至室温,再向其中加入 100 g 质量分数为 7.3%的盐酸恰好完全反应。下列分析正确的是( )A、原混合物中钠元素的质量为 4.6 g B、整个实验过程中产生二氧化碳的质量为 4.4 g C、反应后所得溶液的溶质质量分数为 11.7% D、原混合物中碳酸钠的质量为 5.3 g
等质量的不同金属分别放入到足量的相同稀盐酸中
23. 碳酸钠和碳酸氢钠是生活中常见的盐。已知碳酸钠很稳定受热不易分解,碳酸氢钠受热易分解,其反应原理为:。某同学进行如下实验:将碳酸钠和碳酸氢钠的混合物 13.7 g 充分加热至质量不再改变,冷却至室温,再向其中加入 100 g 质量分数为 7.3%的盐酸恰好完全反应。下列分析正确的是( )A、原混合物中钠元素的质量为 4.6 g B、整个实验过程中产生二氧化碳的质量为 4.4 g C、反应后所得溶液的溶质质量分数为 11.7% D、原混合物中碳酸钠的质量为 5.3 g三、综合题
-
24. 3%的过氧化氢溶液可用于伤口消毒。(1)、H2O2属于(填“纯净物”或“混合物”)。(2)、H2O2中氢元素与氧元素的质量比为。25. 75%的乙醇(C2H5OH)溶液常用作消毒剂。(1)、C2H5OH属于(填“有机化合物”或“无机化合物”)。(2)、C2H5OH中氢原子与氧原子的个数比为。26. 化学兴趣小组收集到某水垢样品,其成分为氢氧化镁和碳酸钙。已知氢氧化镁受热易分解,化学方程式为。小组同学取22.9克该水垢样品进行实验,加热过程中剩余固体的质量随加热时间的变化关系如图所示。请回答下列问题:
 (1)、容易产生水垢的水是。(填“硬水”或“软水”)(2)、分析图像可知,开始加热到t1时,固体质量没有发生变化的原因是。(3)、b点对应固体的成分是。(4)、m的值是。(5)、样品中氢氧化镁的质量分数为。(结果保留一位小数)(6)、n是cd(不包括c、d两点)上的任意一点,n点对应的固体中含有氧元素的质量分数用x表示,则x值的范围是。(结果保留一位小数)(7)、取3.2克e点对应的固体于烧杯中,加入100克溶质质量分数为7.3%的稀盐酸,充分反应后,固体全部溶解,将所得溶液蒸发结晶,得到干燥固体6.5克(不含结晶水),反应过程中生成水的质量为g。27. 某纯净物A在空气中完全燃烧,配平的化学反应方程式为: , 请回答下列问题:(1)、物质A中含有的元素有(填元素符号);(2)、求9.2gA中含有的碳元素的质量是。28. 第24届冬奥会在北京成功举办,各项科技的运用向全世界展示了“中国智造”。
(1)、容易产生水垢的水是。(填“硬水”或“软水”)(2)、分析图像可知,开始加热到t1时,固体质量没有发生变化的原因是。(3)、b点对应固体的成分是。(4)、m的值是。(5)、样品中氢氧化镁的质量分数为。(结果保留一位小数)(6)、n是cd(不包括c、d两点)上的任意一点,n点对应的固体中含有氧元素的质量分数用x表示,则x值的范围是。(结果保留一位小数)(7)、取3.2克e点对应的固体于烧杯中,加入100克溶质质量分数为7.3%的稀盐酸,充分反应后,固体全部溶解,将所得溶液蒸发结晶,得到干燥固体6.5克(不含结晶水),反应过程中生成水的质量为g。27. 某纯净物A在空气中完全燃烧,配平的化学反应方程式为: , 请回答下列问题:(1)、物质A中含有的元素有(填元素符号);(2)、求9.2gA中含有的碳元素的质量是。28. 第24届冬奥会在北京成功举办,各项科技的运用向全世界展示了“中国智造”。 (1)、“冰墩墩”的冰晶外壳由塑料制成,塑料属于(填“天然材料”或“合成材料”)(2)、冬奥会新场馆建设中使用了大量铝合金,铝合金在建筑方面具有比金属铝硬度(填“大”或“小”)的优点。场馆内的冰壶机器人,其电池选用密度小且能提供足够能量的锂电池。请计算氧化锂(Li2O)中,锂、氧元素的质量比。(3)、冬奥会运用的5G通信技术是一大科技亮点,5G通信芯片是用氮化镓材料制成的。图甲是镓(Ga)原子的结构示意图,镓原子在化学反应中容易(填“失去”或“得到”)电子,形成镓离子的符号为。(4)、甲醇可做燃料。图乙是甲醇发生燃烧反应的微观示意图,请写出该反应的化学方程式。冬奥火炬“飞扬”采用氢气作燃料,致力于实现“碳中和”目标。献教育甲醇燃烧,氢气可实现零碳排放。关闭火炬的燃气开关,使火炬熄灭,其灭火原理是。29. 从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
(1)、“冰墩墩”的冰晶外壳由塑料制成,塑料属于(填“天然材料”或“合成材料”)(2)、冬奥会新场馆建设中使用了大量铝合金,铝合金在建筑方面具有比金属铝硬度(填“大”或“小”)的优点。场馆内的冰壶机器人,其电池选用密度小且能提供足够能量的锂电池。请计算氧化锂(Li2O)中,锂、氧元素的质量比。(3)、冬奥会运用的5G通信技术是一大科技亮点,5G通信芯片是用氮化镓材料制成的。图甲是镓(Ga)原子的结构示意图,镓原子在化学反应中容易(填“失去”或“得到”)电子,形成镓离子的符号为。(4)、甲醇可做燃料。图乙是甲醇发生燃烧反应的微观示意图,请写出该反应的化学方程式。冬奥火炬“飞扬”采用氢气作燃料,致力于实现“碳中和”目标。献教育甲醇燃烧,氢气可实现零碳排放。关闭火炬的燃气开关,使火炬熄灭,其灭火原理是。29. 从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:宏观辨识
(1)、通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针(填“向左”“向右”或“不”)偏转。
微观探析
(2)、下图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为反应。从微观角度分析,过程I表示分子分解成的过程。
符号表征
(3)、氢化镁(MgH2)是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为:↑。请补全该反应的化学方程式并写出补全依据。依据一:化学反应前后原子的种类和不变。
依据二:。
30. 化学来源于社会,服务于社会。(1)、防控新型冠状病毒传播要科学使用消毒剂。常用消毒剂中有84消毒液,其有效成分是次氯酸钠(化学式为NaClO)。NaClO中氯元素的化合价为价。(2)、氢燃料电池汽车作为载运工具亮相北京冬奥会。氢燃料电池利用氢气和氧气在铂(Pt)的催化作用下发生反应。从环保角度看,氢气作为新能源的优点是。(3)、“感知宇宙奥秘,放飞航天梦想”,神舟十三号航天员在中国空间站进行了太空授课,实验中用到了小苏打,其化学式为。(4)、铜曝露在潮湿的空气中会生锈,其反应原理: , 其中X物质的化学式为。四、实验探究题
-
31. 根据下图所示的实验回答问题:
 (1)、A实验(填“能”或“不能”)用来测定空气中氧气的含量;(2)、B实验现象说明:空气中的氧气含量比呼出气体中的(“高”或“低”);(3)、C实验中小灯泡发亮,说明石墨具有性;(4)、D实验用来验证质量守恒定律,其中气球的作用是。32. 根据下图所示实验回答问题。
(1)、A实验(填“能”或“不能”)用来测定空气中氧气的含量;(2)、B实验现象说明:空气中的氧气含量比呼出气体中的(“高”或“低”);(3)、C实验中小灯泡发亮,说明石墨具有性;(4)、D实验用来验证质量守恒定律,其中气球的作用是。32. 根据下图所示实验回答问题。 (1)、实验一,通过对比铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明可燃物燃烧的条件之一是。(2)、实验二,将稀盐酸倒入烧杯中,充分反应后,再次称量,发现物质总质量减小,原因是。(3)、实验三,一段时间后,观察到A中铁钉生锈,B、C中铁钉无明显变化,通过对比A、B、C中的现象,可得出铁生锈的条件是铁与和氧气等同时接触。(4)、实验四,加热蒸发食盐水过程中,当蒸发皿中出现时,停止加热。33. 氧气是人类不可离开的物质。根据下列装置图回答问题。
(1)、实验一,通过对比铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明可燃物燃烧的条件之一是。(2)、实验二,将稀盐酸倒入烧杯中,充分反应后,再次称量,发现物质总质量减小,原因是。(3)、实验三,一段时间后,观察到A中铁钉生锈,B、C中铁钉无明显变化,通过对比A、B、C中的现象,可得出铁生锈的条件是铁与和氧气等同时接触。(4)、实验四,加热蒸发食盐水过程中,当蒸发皿中出现时,停止加热。33. 氧气是人类不可离开的物质。根据下列装置图回答问题。 (1)、实验室用氯酸钾制氧气的化学方程式为 , 其发生装置可选用(填字每序号,下同): , 用C装置收集氧气前,将集气瓶内空气完全排尽的方法是。(2)、某同学欲按图F所示方法做细铁丝燃烧的实验,收集所需氧气最好选用的装置是;做硫燃烧实验,收集所需氧气最好选用的装置是。由此可见,选择气体的收集方法主要应考虑气体的性质,此外往往还要考虑。(3)、如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
(1)、实验室用氯酸钾制氧气的化学方程式为 , 其发生装置可选用(填字每序号,下同): , 用C装置收集氧气前,将集气瓶内空气完全排尽的方法是。(2)、某同学欲按图F所示方法做细铁丝燃烧的实验,收集所需氧气最好选用的装置是;做硫燃烧实验,收集所需氧气最好选用的装置是。由此可见,选择气体的收集方法主要应考虑气体的性质,此外往往还要考虑。(3)、如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。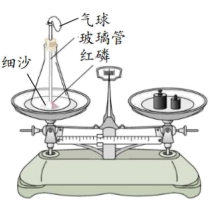
①用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是 , 反应的化学方程式为。
②待红磷熄灭后再次称量,天平不再平衡,其原因可能是。
A.装置漏气
B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少
D.没有等锥形瓶冷却就再次称量
34. CuSO4是化学实验中常见试剂。(1)、验证质量守恒定律。步骤1:在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为m1。
步骤2:将铁钉浸入到CuSO4溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有CuSO4溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为m2
①用砂纸将铁钉打磨干净的作用是。
②步骤2中可观察到明显的实验现象是。该变化可说明Fe和Cu的金属活动性由强到弱的顺序是。
③若m1=m2 , 可证明参加反应的Fe和CuSO4的质量总和等于。
(2)、探究CuSO4溶液对H2O2分解具有催化作用。①若要证明CuSO4溶液对H2O2分解具有催化作用,除需证明CuSO4在反应前后化学性质和质量不发生改变外,还需证明的是。
②为探究CuSO4在反应前后质量是否发生改变,某同学设计如下实验:
向H2O2溶液中滴入10ga%的CuSO4溶液,待反应完全后,向试管中加入足量的BaCl2溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为bg。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物bg计算出溶液中CuSO4的质量0.1ag。(填“大于”或“小于”或“等于”)
(3)、将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为。
②1000℃时,CuO开始发生分解反应,生成Cu2O和O2.计算图中m的值。(写出计算过程)
五、计算题
-
35. 疫情防控期间常用到一种免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。请回答下列问题:(1)、正丙醇的相对分子质量为。(2)、正丙醇中碳元素和氢元素的质量比为(写出最简整数比)。(3)、6g正丙醇中氧元素的质量为g。36. 某品牌免洗手消毒凝胶,是以乙醇和正丙醇为主要有效成分的消毒凝胶,其中正丙醇的化学式为C3H7OH。请计算:(1)、一个正丙醇分子中含有个原子。(2)、正丙醇中碳、氢元素的质量比为(填最简整数比)。37. 钾肥能增强植物抗倒伏能力,农民向土壤中施加草木灰,是因为草木灰中含碳酸钾(化学式为K2CO3)。(1)、碳酸钾中碳、氧元素的质量比(最简整数比)。(2)、138g碳酸钾中钾元素质量为g。38. 将一包锌粒在空气中加热一段时间后,得到锌和氧化锌的混合物14.6g,向其中加入146.6g稀硫酸恰好完全反应,测得生成氢气0.2g。(1)、根据化学方程式计算混合物中锌的质量。(2)、求反应后所得溶液中硫酸锌的质量分数。39. 在牙膏中,常用轻质碳酸钙粉末等作摩擦剂。已知某品牌牙膏中的摩擦剂是CaCO3 , 和SiO2(SiO2既不溶于水也不与稀盐酸反应),化学兴趣小组用该牙膏的摩擦剂测定某盐酸中溶质的质量分数,通过实验测得如图数据:(假设产生气体全部逸出)
 (1)、生成CO2的质量为g。(2)、求稀盐酸中溶质的质量分数。(写出计算过程)40. 实际生产的纯碱产品中往往会含有少量的氯化钠,化学实践小组的同学通过实验来测定某品牌工业品纯碱的指标等级。
(1)、生成CO2的质量为g。(2)、求稀盐酸中溶质的质量分数。(写出计算过程)40. 实际生产的纯碱产品中往往会含有少量的氯化钠,化学实践小组的同学通过实验来测定某品牌工业品纯碱的指标等级。国家标准规定工业品纯碱指标等级
指标项目
指标
I类
Ⅱ类
Ⅲ类
优等品
一等品
优等品
合格品
总碱量(Na2CO3计)%≥
99.2
98.8
99.1
98.0
实践小组成员进行的实验和有关数据如下图所示。
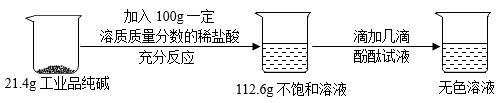 (1)、实验过程中滴加几滴酚酞试液的目的是。(2)、通过计算判断该品牌工业品纯碱属于哪一指标等级。(写出计算过程,结果数值四舍五入精确到0.1%)41. 国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与氢氧化钠反应的方法。某同学称取15g硫酸铵样品(杂质不含氮元素),与足量的NaOH混合后,放入试管中加热,发生如下反应:。充分反应后共收集到3.4gNH3。(1)、(NH4)2SO4中氮元素的质量分数(精确到0.1%)。(2)、样品中硫酸铵的质量(写出计算过程)。(3)、合格硫酸铵化肥中硫酸铵的质量分数需达到94.3%~99%,通过计算判断上述样品是否合格?42. 钙在冶炼工业中具有重要的作用。可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为CaCl2 Ca+Cl2↑,若制得40kgCa。请计算:参加反应的CaCl2的质量(写出计算过程及结果)。43. 二氧化锰因应用广泛而备受关注。某研究小组采用下图装置通过焙烧MnCO3制取MnO2 , 发生反应的化学方程式为:
(1)、实验过程中滴加几滴酚酞试液的目的是。(2)、通过计算判断该品牌工业品纯碱属于哪一指标等级。(写出计算过程,结果数值四舍五入精确到0.1%)41. 国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与氢氧化钠反应的方法。某同学称取15g硫酸铵样品(杂质不含氮元素),与足量的NaOH混合后,放入试管中加热,发生如下反应:。充分反应后共收集到3.4gNH3。(1)、(NH4)2SO4中氮元素的质量分数(精确到0.1%)。(2)、样品中硫酸铵的质量(写出计算过程)。(3)、合格硫酸铵化肥中硫酸铵的质量分数需达到94.3%~99%,通过计算判断上述样品是否合格?42. 钙在冶炼工业中具有重要的作用。可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为CaCl2 Ca+Cl2↑,若制得40kgCa。请计算:参加反应的CaCl2的质量(写出计算过程及结果)。43. 二氧化锰因应用广泛而备受关注。某研究小组采用下图装置通过焙烧MnCO3制取MnO2 , 发生反应的化学方程式为:
 (1)、实验过程中,石英管内剩余固体的质量和成分随温度的变化如上图所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于℃。(2)、若加热到300—900℃时,锰的氧化物会分解产生一种常见气体,该气体为(填化学式)。(3)、试根据化学方程式求46.0gMnCO3通过熔烧最多制得的MnO2的质量是多少?(请写出计算过程)(4)、若把反应温度控制在900℃,充分反应后管内剩余固体的质量为g·44. 取一定量NaCl和NaHCO3组成的固体样品放入烧杯中,然后将一定溶质质量分数的盐酸逐滴加入样品中,边加边搅拌,测得生成气体的质量与所加盐酸的质量关系如下图所示。请分析并计算:
(1)、实验过程中,石英管内剩余固体的质量和成分随温度的变化如上图所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于℃。(2)、若加热到300—900℃时,锰的氧化物会分解产生一种常见气体,该气体为(填化学式)。(3)、试根据化学方程式求46.0gMnCO3通过熔烧最多制得的MnO2的质量是多少?(请写出计算过程)(4)、若把反应温度控制在900℃,充分反应后管内剩余固体的质量为g·44. 取一定量NaCl和NaHCO3组成的固体样品放入烧杯中,然后将一定溶质质量分数的盐酸逐滴加入样品中,边加边搅拌,测得生成气体的质量与所加盐酸的质量关系如下图所示。请分析并计算: (1)、恰好完全反应时产生气体的质量是g;(2)、a点时溶液中含有的溶质是(填化学式);(3)、计算所加盐酸的溶质质量分数。(写出计算过程,结果精确到0.01%)45. 我国明代科技著作《天工开物》中有利用炉甘石(主要成分是ZnCO3)火法炼锌的工艺记载,主要反应原理为ZnCO3+2CZn+3CO↑,现用200 kg炉甘石与足量碳充分反应,产生CO的质量与加热时间的关系如图所示。
(1)、恰好完全反应时产生气体的质量是g;(2)、a点时溶液中含有的溶质是(填化学式);(3)、计算所加盐酸的溶质质量分数。(写出计算过程,结果精确到0.01%)45. 我国明代科技著作《天工开物》中有利用炉甘石(主要成分是ZnCO3)火法炼锌的工艺记载,主要反应原理为ZnCO3+2CZn+3CO↑,现用200 kg炉甘石与足量碳充分反应,产生CO的质量与加热时间的关系如图所示。 (1)、此过程中产生CO的质量是kg。(2)、列式计算此炉甘石中ZnCO3的质量分数。46. 实验室用质量分数为20.0%的稀硫酸处理含Ba(OH)2的废液。向100.0g废液中加入稀硫酸至溶液恰好呈中性,最终得到2.33 g沉淀。请计算:(1)、配制490.0 g 20.0%的稀硫酸需质量分数为98.0%的浓硫酸g。(2)、废液中Ba(OH)2的质量分数。47. 硫酸铜对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40g倒入锥形瓶中,向其中加入15%的硫酸铜溶液6.6g,使过氧化氢完全分解,若产生的气体全部逸出,请计算:(1)、过氧化氢的相对分子质量为 。(2)、产生氧气的质量(写出计算过程)。(3)、反应后所得硫酸铜溶液中溶质的质量分数为 。48. 为测定黄铜(铜锌合金)样品中铜的质量分数,小明取一定质量的样品放入烧杯中,分2次加入质量分数相同的稀硫酸,实验过程和数据如图所示。
(1)、此过程中产生CO的质量是kg。(2)、列式计算此炉甘石中ZnCO3的质量分数。46. 实验室用质量分数为20.0%的稀硫酸处理含Ba(OH)2的废液。向100.0g废液中加入稀硫酸至溶液恰好呈中性,最终得到2.33 g沉淀。请计算:(1)、配制490.0 g 20.0%的稀硫酸需质量分数为98.0%的浓硫酸g。(2)、废液中Ba(OH)2的质量分数。47. 硫酸铜对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40g倒入锥形瓶中,向其中加入15%的硫酸铜溶液6.6g,使过氧化氢完全分解,若产生的气体全部逸出,请计算:(1)、过氧化氢的相对分子质量为 。(2)、产生氧气的质量(写出计算过程)。(3)、反应后所得硫酸铜溶液中溶质的质量分数为 。48. 为测定黄铜(铜锌合金)样品中铜的质量分数,小明取一定质量的样品放入烧杯中,分2次加入质量分数相同的稀硫酸,实验过程和数据如图所示。
请计算:
(1)、生成氢气的总质量是g。(2)、黄铜样品中铜的质量分数。49. 我国科学家侯德榜发明了联合制碱法,为世界科学发展做出了重要贡献。该制碱法以食盐为原料制备纯碱,产品中会混有少量氯化钠。某学习小组为了探测产品中纯碱的质量分数,将5g纯碱样品溶于20g水中配成溶液,再加入30g氯化钙溶液恰好完全反应(Na2CO3+CaCl2=CaCO3↓+2NaCl),反应后静置、过滤、洗涤、干燥,称得沉淀质量为4.5g。请回答下列问题:(1)、过滤后的滤液质量为g。(2)、求纯碱样品中纯碱的质量分数。(写出计算过程)