高中化学人教版(2019)选择性必修1第一章第二节 反应热的计算
试卷更新日期:2022-08-10 类型:同步测试
一、单选题
-
1. 知反应: , 反应产物中的S实为 , 它是一个八元环状分子(即
 ),中可看成含2个键。部分共价键键能的数据如下::;:;:;:。则a为( ) A、 B、 C、 D、2. 已知共价键的键能与热化学方程式信息如表:
),中可看成含2个键。部分共价键键能的数据如下::;:;:;:。则a为( ) A、 B、 C、 D、2. 已知共价键的键能与热化学方程式信息如表:共价键
H—H
N—H
N≡N
键能/(kJ·mol-1)
436
391
x
热化学方程式
N2(g)+3H2(g)2NH3(g) △H=-92kJ·mol-1
则x等于( )
A、1130 B、946 C、691 D、3163. 在25℃和101kPa下,根据如图所示的H2(g)和Cl2(g)反应生成HCl(g)过程中能量变化情况,判断下列说法错误的是( ) A、1molH2和1molCl2的反应热△H=+183kJ•mol-1 B、2mol气态氢原子结合生成H2(g)时,能放出436kJ能量 C、断裂1molHCl分子中的化学键,需要吸收431kJ能量 D、如图所示,该反应中反应物所具有的总能量高于生成物所具有的总能量4. 已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为( )A、2912 kJ B、2953 kJ C、3236 kJ D、3867 kJ5. 已知:①2CO2(g)+4H2(g)═2CH3OH(g)+O2(g) △H=+385.8kJ/mol
A、1molH2和1molCl2的反应热△H=+183kJ•mol-1 B、2mol气态氢原子结合生成H2(g)时,能放出436kJ能量 C、断裂1molHCl分子中的化学键,需要吸收431kJ能量 D、如图所示,该反应中反应物所具有的总能量高于生成物所具有的总能量4. 已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为( )A、2912 kJ B、2953 kJ C、3236 kJ D、3867 kJ5. 已知:①2CO2(g)+4H2(g)═2CH3OH(g)+O2(g) △H=+385.8kJ/mol②2H2(g)+O2(g)═2H2O(l) △H=−571.6kJ/mol,则CH3OH(g) + O2(g)═CO2(g)+2H2O(l)的△H为( )
A、+478.7kJ/mol B、−764.5 kJ/mol C、−478.7kJ/mol D、+764.5kJ/mol6. 已知反应:H2(g)+I2(g) 2HI(g) ΔH=-14.8 kJ • mol-1。则反应:HI(g) H2(g)+ I2(g)的ΔH为( )
A、-7.4 kJ • mol-1 B、+7.4 kJ • mol-1 C、-14.8 kJ • mol-1 D、+14.8kJ • mol-17. 已知在 和 条件下, 燃烧生成水蒸气放出 热量,下列热化学方程式正确的是( )A、 ; B、 ; C、 ; D、 ;8. N2(g)与H2(g)化合生成NH3(g)的能量变化如图,下列说法正确的是( ) A、N2与H2的键能数值总和为1080 B、N2(g)+3H2(g)2NH3(g)+46 kJ C、1 mol H2(g)的能量比2 mol H(g)的能量低 D、若使用催化剂会改变反应的热效应9. 通常人们把拆开1mol化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
A、N2与H2的键能数值总和为1080 B、N2(g)+3H2(g)2NH3(g)+46 kJ C、1 mol H2(g)的能量比2 mol H(g)的能量低 D、若使用催化剂会改变反应的热效应9. 通常人们把拆开1mol化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ•mol﹣1)
414
489
565
155
根据键能数据估算反应CH4(g)+4F2(g)═CF4(g)+4HF(l)的反应热为( )
A、-1940kJ·mol-1 B、+1940kJ·mol-1 C、-485kJ·mol-1 D、+485kJ·mol-110. 工业上高炉炼铁时常以赤铁矿和焦炭为原料,而将赤铁矿中的转化为铁的过程中实际起作用的是CO。反应过程中发生的一系列变化:则反应的为( )
A、 B、 C、 D、11. 已知:C(s)+O2(g)=CO2(g) ΔH1;4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2 , 则Fe2O3(s)+C(s)=CO2(g)+2Fe(s)的ΔH是( )A、3ΔH1-2ΔH2 B、ΔH2-ΔH1 C、ΔH1-ΔH2 D、ΔH2-ΔH112. 化学反应与能量的说法正确的是( ) A、根据能量守恒,反应物总能量等于生成物总能量 B、如图中 C、凡经加热而发生的化学反应都是吸热反应 D、天然气和沼气是可再生资源13. 氢气和氧气反应生成水的能量关系如图所示:
A、根据能量守恒,反应物总能量等于生成物总能量 B、如图中 C、凡经加热而发生的化学反应都是吸热反应 D、天然气和沼气是可再生资源13. 氢气和氧气反应生成水的能量关系如图所示: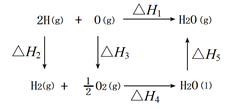
下列说法正确的是( )
A、△H5<0 B、△H1>△H2+△H3+△H4 C、△H1+△H2+△H3+△H4+△H5=0 D、O-H键键能为△H114. 根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( ) A、ΔH1=ΔH2=ΔH3=ΔH4 B、ΔH1+ΔH2=ΔH3+ΔH4 C、ΔH1+ΔH2+ΔH3=ΔH4 D、ΔH1=ΔH2+ΔH3+ΔH415. 已知:25℃,101 kPa时,反应①Mn(s)+ O2(g)=MnO2(s) ΔH1 =-520 kJ·mol-1;反应②Mn(s)+ SO2(g)+ O2(g)=MnSO4(s) ΔH2 =-768 kJ·mol-1 , 则反应MnO2 (s)+SO2(g)=MnSO4(s)的 ΔH为( )A、-248 kJ·mol-1 B、+248 kJ·mol-1 C、-1288 kJ·mol-1 D、+1288 kJ·mol-116. 已知热化学方程式:
A、ΔH1=ΔH2=ΔH3=ΔH4 B、ΔH1+ΔH2=ΔH3+ΔH4 C、ΔH1+ΔH2+ΔH3=ΔH4 D、ΔH1=ΔH2+ΔH3+ΔH415. 已知:25℃,101 kPa时,反应①Mn(s)+ O2(g)=MnO2(s) ΔH1 =-520 kJ·mol-1;反应②Mn(s)+ SO2(g)+ O2(g)=MnSO4(s) ΔH2 =-768 kJ·mol-1 , 则反应MnO2 (s)+SO2(g)=MnSO4(s)的 ΔH为( )A、-248 kJ·mol-1 B、+248 kJ·mol-1 C、-1288 kJ·mol-1 D、+1288 kJ·mol-116. 已知热化学方程式:① C2H2(g) + O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A、+228.2 kJ·mol-1 B、-228.2 kJ·mol-1 C、+1301.0 kJ·mol-1 D、+621.7 kJ·mol-117. 将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:TiO2(s) + 2Cl2(g) = TiCl4(l) + O2(g) △H = +140.5 kJ/mol
C(s,石墨) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨) = TiCl4(l) + 2CO(g) 的△H 是( )
A、+80.5 kJ/mol B、+30.0 kJ/mol C、-30.0 kJ/mol D、-80.5 kJ/mol18. 为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。已知:① ∆H=+180.50kJ·mol-1
② ∆H=-905.48kJ·mol-1
则反应 的∆H为( )
A、+2.98kJ·mol-1 B、-2.98kJ·mol-1 C、+1807.98kJmol-1 D、-1807.98kJ·mol-119. 根据下列热化学方程式:①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A、ΔH=+244.1 kJ/mol B、ΔH=-488.3 kJ/mol C、ΔH=-996.6 kJ/mol D、ΔH=+996.6 kJ/mol20. 在载人航天器中,可以利用CO2与H2的反应,将航天员呼出的CO2转化为H2O等,然后通过电解水得到O2 , 从而实现O2的再生。已知:①
②
③
则x等于( )
A、+252.9 B、-252.9 C、+1461.9 D、-318.721. 已知:Mn(s)+O2(g)=MnO2(s) △H1S(s)+O2(g)=SO2(g) △H2
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H3
下列表述正确的是( )
A、△H2>0 B、Mn+SO2 =MnO2 +S △H=△H1-△H2 C、△H3>△H1 D、MnO2(s)+SO2(g)=MnSO4(s) △H=△H3-△H2-△H1二、综合题
-
22. 在25 ℃、101 kPa的条件下,断裂1 mol H-H键吸收436 kJ能量,断裂1 mol Cl-Cl键吸收243 kJ能量,形成1 mol H-Cl键放出431 kJ能量。
H2+Cl2=2HCl的化学反应可用下图表示:

请回答下列有关问题:
(1)、反应物断键吸收的总能量为。(2)、生成物成键放出的总能量为。(3)、反应物总能量(填“>”或“<”)生成物总能量。23.(1)、已知C(s、金刚石)+O2(g)=CO2(g);ΔH= -395.4kJ·mol-1 , C(s、石墨)+O2(g)=CO2(g);ΔH= -393.5kJ·mol-1。①石墨和金刚石相比,石墨的稳定性金刚石的稳定性。
②石墨中C-C键键能金刚石中C-C键键能。(均填“大于” “小于”或“等于”)。
(2)、将4g CH4完全燃烧生成气态CO2和液态水,放出热量222.5kJ,其热化学反应方程式为:。(3)、0.5mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为:。(4)、已知下列反应的反应热:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1= +206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2= -247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式。
24. 肼( )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。 (1)、实验室用氯化铵和氢氧化钙制备氨气的化学方程式:(2)、已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。 (1)、实验室用氯化铵和氢氧化钙制备氨气的化学方程式:(2)、已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1②N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:
(3)、已知断裂1 mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O 为464、请根据N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1中数据计算断裂1 molN-H键所需的能量(kJ)是:(4)、写出NH3与NaClO反应得到肼的化学方程式:25. 2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题: (1)、图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;(2)、图中△H=KJ•mol﹣1;(3)、如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1 , 则υ(SO3)=mol•L﹣1•min﹣1;(4)、已知单质硫的燃烧热为296KJ•mol﹣1 , 计算由S(s)生成3molSO3(g)的△H=KJ•mol﹣1 .
(1)、图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;(2)、图中△H=KJ•mol﹣1;(3)、如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1 , 则υ(SO3)=mol•L﹣1•min﹣1;(4)、已知单质硫的燃烧热为296KJ•mol﹣1 , 计算由S(s)生成3molSO3(g)的△H=KJ•mol﹣1 .