高中化学人教版(2019)选择性必修1第一章第一节 反应热
试卷更新日期:2022-08-10 类型:同步测试
一、单选题
-
1. 下列设备工作时,主要将化学能转化为热能的是( )A、家用燃气灶
 B、锌锰干电池
B、锌锰干电池 C、锂离子电池
C、锂离子电池 D、硅太阳能电池
D、硅太阳能电池 2. 下列叙述正确的是( )A、物质发生变化时的质量和能量一定是守恒的 B、能量变化一定是化学变化引起的 C、化学反应过程中不一定有能量的变化 D、化学反应中能量变化只与化学键的变化有关3. 已知反应为放热反应,对于该反应,下列说法中正确的是( )A、1molA和1molB的总能量高于1molC和1molD的总能量 B、B的能量一定高于D C、因为该反应为放热反应,故不加热反应就可以发生 D、A的能量一定高于C4. 下列叙述正确的是( )A、升高温度或加入催化剂,可以改变化学反应的反应热 B、化学反应中的能量变化都是以热量的形式体现 C、因为石墨变成金刚石吸热,所以石墨比金刚石稳定 D、凡吸热反应均需在加热条件下才能发生5. 下列反应中热量变化与图一致的是( )
2. 下列叙述正确的是( )A、物质发生变化时的质量和能量一定是守恒的 B、能量变化一定是化学变化引起的 C、化学反应过程中不一定有能量的变化 D、化学反应中能量变化只与化学键的变化有关3. 已知反应为放热反应,对于该反应,下列说法中正确的是( )A、1molA和1molB的总能量高于1molC和1molD的总能量 B、B的能量一定高于D C、因为该反应为放热反应,故不加热反应就可以发生 D、A的能量一定高于C4. 下列叙述正确的是( )A、升高温度或加入催化剂,可以改变化学反应的反应热 B、化学反应中的能量变化都是以热量的形式体现 C、因为石墨变成金刚石吸热,所以石墨比金刚石稳定 D、凡吸热反应均需在加热条件下才能发生5. 下列反应中热量变化与图一致的是( ) A、天然气的燃烧能量生成物 B、锌与稀硫酸反应 C、NaOH溶液和溶液反应反应物 D、晶体和晶体反应6. 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是( )A、
A、天然气的燃烧能量生成物 B、锌与稀硫酸反应 C、NaOH溶液和溶液反应反应物 D、晶体和晶体反应6. 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是( )A、 B、
B、 C、
C、 D、
D、 7. 根据能量图,下列说法正确的是( )
7. 根据能量图,下列说法正确的是( ) A、A2(g)+ B2(g)=2AB(g)是一个放热反应 B、该反应中,反应物的总能量小于生成物的总能量 C、拆开1 mol AB(g)中的化学键需要吸收b kJ的能量 D、1 mol A2(g)和1 mol B2(g)的能量之和为a kJ8. 如图所示,1mol碳原子构成的金刚石比1mol碳原子构成的石墨在完全燃烧全部生成气体二氧化碳时,多放出1.9kJ的能量,下列说法正确的是( )
A、A2(g)+ B2(g)=2AB(g)是一个放热反应 B、该反应中,反应物的总能量小于生成物的总能量 C、拆开1 mol AB(g)中的化学键需要吸收b kJ的能量 D、1 mol A2(g)和1 mol B2(g)的能量之和为a kJ8. 如图所示,1mol碳原子构成的金刚石比1mol碳原子构成的石墨在完全燃烧全部生成气体二氧化碳时,多放出1.9kJ的能量,下列说法正确的是( )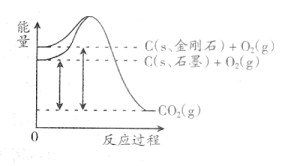 A、金刚石的总能量比石墨大1.9kJ B、石墨和金刚石的转化是物理变化 C、石墨的稳定性强于金刚石 D、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ9. 下列关于化学反应中能量变化的说法正确的是( )
A、金刚石的总能量比石墨大1.9kJ B、石墨和金刚石的转化是物理变化 C、石墨的稳定性强于金刚石 D、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ9. 下列关于化学反应中能量变化的说法正确的是( ) A、断开化学键会释放能量 B、化学反应过程中一定伴有能量变化 C、常温下进行的一定是放热反应 D、如图表示该反应为吸热反应10. 属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
A、断开化学键会释放能量 B、化学反应过程中一定伴有能量变化 C、常温下进行的一定是放热反应 D、如图表示该反应为吸热反应10. 属于氧化还原反应且反应过程中能量变化符合如图所示的是( ) A、 B、 C、 D、11. 下列反应属于非氧化还原反应,且能量变化与图示能量相符合的是( )
A、 B、 C、 D、11. 下列反应属于非氧化还原反应,且能量变化与图示能量相符合的是( ) A、与稀反应 B、氢气与氮气的化合反应 C、灼热的炭与反应 D、晶体与晶体反应12. 环己烷(C6H12)有椅型、半椅型、船型、扭船型等多种结构,不同结构的势能不同,它们的相对势能如图所示。下列说法不正确的是( )
A、与稀反应 B、氢气与氮气的化合反应 C、灼热的炭与反应 D、晶体与晶体反应12. 环己烷(C6H12)有椅型、半椅型、船型、扭船型等多种结构,不同结构的势能不同,它们的相对势能如图所示。下列说法不正确的是( ) A、上述四种结构中,半椅型结构最不稳定 B、C6H12)(船型)→C6H12)(椅型) △H=-28.9kJ·mol-1 C、相同条件下,椅型转化成扭船型的速率比逆向转化的慢 D、升温不利于椅型转化成扭船型13. 分析下表中的6个热化学方程式,可判断出和的燃烧热分别为( )
A、上述四种结构中,半椅型结构最不稳定 B、C6H12)(船型)→C6H12)(椅型) △H=-28.9kJ·mol-1 C、相同条件下,椅型转化成扭船型的速率比逆向转化的慢 D、升温不利于椅型转化成扭船型13. 分析下表中的6个热化学方程式,可判断出和的燃烧热分别为( )2022年北京冬奥会“飞扬”火炬使用的燃料
氧气
()
①
②
2008年北京奥运会“祥云”火炬使用的燃料
丙烷
()
③
④
⑤
⑥
A、、 B、、 C、、 D、、14. 航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,每千克固态铍完全燃烧放出的热量为62700kJ,则铍燃烧的热化学方程式正确的是( )A、Be(s)+O2(g)=BeO(s) △H=-564.3kJ•mol-1 B、Be(s)+O2(g)=BeO(g) △H=-62700kJ•mol-1 C、Be(s)+O2(g)=BeO(s) △H=+564.3kJ•mol-1 D、Be+O2=BeO △H=-564.3kJ•mol-115. 已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )A、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1 B、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1 C、C2H2(g)+O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 D、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-116. 已知热化学方程式:①H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
③H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
则氢气的燃烧热为( )
A、241.8 kJ·mol-1 B、483.6 kJ·mol-1 C、285.8 kJ·mol-1 D、571.6 kJ·mol-117. 下列热化学方程式中的“ ”表示 燃烧热的是( )A、 B、 C、 D、18. 沼气是一种能源,它的主要成分是CH4 , 0.5molCH4完全燃烧生成CO2和H2O时,放出445KJ热量,则下列热化学方程式正确的( )A、2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890KJ/mol B、CH4+2O2=CO2+2H2O △H=﹣890KJ/mol C、CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890KJ/mol D、 CH4(g)+O2(g)= CO2(g)+H2O(l) △H=﹣890KJ/mol.19. 如图为用稀盐酸和稀NaOH溶液测定中和热的装置,下列有关说法不正确的是( ) A、该装置缺少环形玻璃搅拌棒 B、小烧杯与大烧杯口相平 C、将NaOH溶液一次性快速加入盛有稀盐酸的小烧杯中 D、用稀硫酸和稀氨水替换上述药品实验,所测中和热结果相同20. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( )
A、该装置缺少环形玻璃搅拌棒 B、小烧杯与大烧杯口相平 C、将NaOH溶液一次性快速加入盛有稀盐酸的小烧杯中 D、用稀硫酸和稀氨水替换上述药品实验,所测中和热结果相同20. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( ) A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用玻璃搅拌器既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、擦干后再测碱溶液的温度
A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用玻璃搅拌器既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、擦干后再测碱溶液的温度二、综合题
-
21. 已知下列热化学方程式:
①H2O(l)=H2(g)+ O2(g) ΔH=+285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)、如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时(填“吸收”或“放出”)热量,△H0(填“>”或“<”)(2)、上述反应中属于吸热反应的是。(填序号)(3)、C(碳单质)的燃烧热为;0.5molH2燃烧生成气态水的热值为 kJ。22. 已知下列热化学方程式:①H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)、上述反应中属于放热反应的是。(2)、H2的燃烧热为 , C的燃烧热为。(3)、燃烧10 g H2生成液态水,放出的热量为。(4)、CO的燃烧热为 , 其热化学方程式为。23.(1)、已知C(s、金刚石)+O2(g)=CO2(g);ΔH= -395.4kJ·mol-1 , C(s、石墨)+O2(g)=CO2(g);ΔH= -393.5kJ·mol-1。①石墨和金刚石相比,石墨的稳定性金刚石的稳定性。
②石墨中C-C键键能金刚石中C-C键键能。(均填“大于” “小于”或“等于”)。
(2)、将4g CH4完全燃烧生成气态CO2和液态水,放出热量222.5kJ,其热化学反应方程式为:。(3)、0.5mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为:。(4)、已知下列反应的反应热:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1= +206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2= -247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式。
24.(1)、 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题: 
①图中A点表示:;C点表示:;
E的大小对该反应的反应热(填“有”或“无”)影响。
②图中△H=kJ/mol。
(2)、由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)①写出该反应的热化学方程式: ;
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH =kJ/mol。氢气的燃烧热为ΔH =kJ/mol。
25. 实验室利用如图装置进行中和热的测定,请回答下列问题: (1)、从实验装置上看,图中尚缺少的玻璃用品是 , 装置中还存在的不正确为 , 这种不正确会造成最高温度读数(填“偏大”、“偏小”或“无影响”)。(2)、在操作正确的前提下,提高中和热测定准确性的关键是。(3)、把温度为13℃,浓度为的酸溶液和的碱溶液各50mL混合[溶液密度均为 , 生成溶液的比热容],轻轻搅动,测得酸碱混合液的温度变化数据如表:
(1)、从实验装置上看,图中尚缺少的玻璃用品是 , 装置中还存在的不正确为 , 这种不正确会造成最高温度读数(填“偏大”、“偏小”或“无影响”)。(2)、在操作正确的前提下,提高中和热测定准确性的关键是。(3)、把温度为13℃,浓度为的酸溶液和的碱溶液各50mL混合[溶液密度均为 , 生成溶液的比热容],轻轻搅动,测得酸碱混合液的温度变化数据如表:反应物
起始温度/℃
终了温度/℃
中和热
13
13
①计算上述两组实验测出的中和热:提示。;
;。
②两组实验结果差异的原因是。
③根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:。